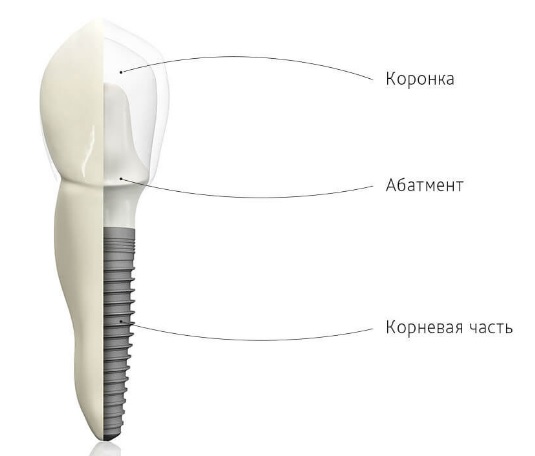
Выбор материала для зубного имплантата. Физиологические ограничения дизайна
Давно известно, что наличие фиброзной ткани снижает долгосрочную выживаемость корневидных имплантатов. Чрезмерные нагрузки на остеоинтегрированный имплантат могут привести к подвижности поддерживающего устройства, и те же нагрузки могут сломать какой-либо компонент или тело имплантата. Несколько состояний могут вызывать потерю крестальной кости, одним из них может быть перегрузка протеза. Чрезмерные нагрузки на кость прямо пропорционально влияют на скорость ремоделирования кости.
Показано, что стресс и напряжение являются важными параметрами сохранения крестальной кости и выживаемости имплантата. Эти факторы могут быть измерены и сравнены для разных дизайнов тел имплантатов. Как результат, могут быть установлены факторы риска для разных дизайнов. Чем выше стресс, действующий на крестальную кость, тем больше риск ее потери. Чем больше стресс, действующий на имплантат, тем выше риск его несостоятельности. Силы, действующие на дентальные имплантаты, можно характеризовать по 5 взаимосвязанным параметрам:
-
величине;
-
продолжительности;
-
типу;
-
направлению;
-
степени увеличения.
Каждый фактор следует тщательно рассмотреть при анализе дизайна имплантата.
Физиологические ограничения дизайна
Нормальная физиология влияет на величину сил, действующих в полости рта, посредством инженерных дизайнов. Величина окклюзионной силы зависит от анатомической области и состояния зубов. Окклюзионная сила может составлять 42-1245 Н. Величина силы больше в области моляров (883 Н), меньше в области клыка (441 Н) и наименьшая в области передних резцов (117-157 Н). Эти средние величины увеличиваются при парафункции до значений, которые могут приближаться к 4413 Н в задних областях полости рта.
После длительных периодов адентии кость становится менее плотной. Предельная прочность кости в наибольшей степени зависит от ее плотности. По сути, менее плотная кость может более не выдерживать нормальные физиологические окклюзионные силы, действующие на имплантаты. Кроме того, исследования нижних челюстей (с зубами и без зубов) показывают значительно большую плотность трабекулярной кости в передней области полости рта по сравнению с областью моляров и премоляров. Тщательное планирование лечения, включая правильный выбор дизайна имплантата, очень важно для уменьшения нагрузок, действующих в уязвимой области контакта «кость-имплантат».
Выбор биоматериала для зубного имплантата
Многие биосовместимые материалы не способны выдерживать парафункциональные нагрузки, которые действуют на дентальные имплантаты. Материалы, такие как силикон, гидроксиапатит и углерод, характеризуются предельной прочностью, которая слишком мала для использования их в качестве главного имплантационного материала, хотя они вполне совместимы с биологическими тканями. В современной стоматологии эти материалы используются в качестве покрытия, наносимого на более прочный материал.
Титан и сплавы титана давно и успешно применяются в стоматологии и ортопедии. Подтверждена отличная биосовместимость титана и его сплавов с биологическими тканями организма человека. Высокоактивный сплав ТіО2 исключительно хорошо переносится окружающими биологическими тканями. Показано, что из всех металлических биоматериалов титаново-алюминиево-ванадиевый сплав имеет наилучшую комбинацию механических и физических свойств, резистентность к коррозии и общую биосовместимость. Главным преимуществом титанового сплава по сравнению с чистым титаном является его прочность. Механические свойства титанового сплава намного лучше таковых чистого титана. Титановый сплав в 4 раза прочнее, чем титан 1-й категории чистоты (чистый титан), и почти в 2 раза прочнее титана 4-й категории чистоты. Предельная прочность и устойчивость к усталостным повреждениям металла являются главными факторами, которые важны для выживаемости имплантата и снижения риска разлома его компонентов.
Модули эластичности (упругости) 4 различных категорий чистоты титана одинаковы (103 ГПа), а сплава титана несколько выше (113 ГПа). Таким образом, хотя существует значительная разница в прочности между титаном различных категорий чистоты и его сплава, модуль эластичности сходен для всех этих материалов. Титан и его сплав в наибольшей степени приближаются по своей упругости к кости по сравнению с любым металлическим хирургическим материалом, используемым для искусственного замещения скелетной ткани, несмотря на то, что он почти в 6 раз более упругий, чем плотная кортикальная кость. Таким образом, титановый сплав представляет наилучшее компромиссное решение (учитывая современную технологию биоматериалов) между биомеханической прочностью, биосовместимостью и возможностями относительного смещения (при ошибках при изготовлении компонентов имплантационной системы) в зоне контакта «кость-имплантат».
О двух примерах несостоятельности тела имплантата, связанных с выбором биоматериала, сообщается в литературе об имплантатах. В стеклоуглеродных имплантатах был оптимизирован модуль эластичности (упругости) биоматериала (углерод) без должного внимания к конечной прочности. Наоборот, в керамических имплантатах на основе А1203 была оптимизирована конечная прочность без учета модуля эластичности.
Стеклоуглеродный имплантат состоит из углерода с внутренним штифтом из нержавеющей стали. Упругость углерода сравнима с окружающей имплантат костью. Однако углерод неспособен выдержать физиологические нагрузки в полости рта. Поэтому на теле имплантата появились микротрещины, и биологические жидкости стали двигаться по направлению к внутреннему стальному штифту. Это привело к значительной коррозии штифта с последующим высвобождением ионов металла в зоне контакта. В результате развилось выраженное воспаление тканей с последующей несостоятельностью имплантата и его удалением. Само по себе соответствие плотности биоматериала и кости не может обеспечить клинического успеха.
Керамические имплантаты в целом были полной антитезой углеродным. Предельная компрессионная прочность соответствовала кости. Модуль эластичности фарфора примерно в 33 раза больше такового кости. Результатом стало экранирование стресса имплантатом. На кость должно действовать микронапряжение величиной более 50 единиц, чтобы она могла функционировать в пределах физиологической нагрузки. Очень упругие керамические имплантаты несли диспропорциональную нагрузку, что приводило к атрофии кости в зоне контакта.
Продолжительность действия окклюзионных сил имеет широкий диапазон. При идеальных условиях зубы сходятся во время глотания и жевания для осуществления кратковременных контактов. Общее время этих коротких эпизодов составляет менее 30 мин в день. Пациенты с бруксизмом, стискиванием зубов или другими парафункциональными нарушениями могут осуществлять такие контакты в течение нескольких часов каждый день.
Материалы, которые подвержены многократным нагрузкам, имеют более высокий риск несостоятельности из-за усталости. Механический стресс может быть достаточно большим, чтобы сломать материал за 1 цикл (однократное приложение нагрузки). Если на материал действует меньший стресс, то он может все равно сломаться, но через большее число циклов. Предел выносливости или усталостная прочность материала определяются уровнем наивысшего стресса, которому материал можно неоднократно подвергать без разлома. Предел выносливости материала часто составляет менее половины его конечной прочности на разрыв. Таким образом, величины усталостной и предельной прочности взаимосвязаны, но усталость является более важным фактором, особенно для пациентов с парафункцией, поскольку они подвергаются стрессу большей величины и в течение большего числа циклов. Усталостная прочность на разлом титанового сплава в 4 раза больше, чем у чистого титана 1-й категории чистоты и почти в 2 раза больше, чем у титана 4-й категории чистоты. Таким образом, вероятность разлома тел имплантатов и их компонентов в долгосрочной перспективе может быть значительно уменьшена при использовании сплава титана, а не чистого титана любой категории чистоты.
Внеосевая циклическая нагрузка на имплантат или компоненты протеза даже при относительно низкой величине силы также может вызвать разлом и несостоятельность компонентов имплантата. Дентальные имплантаты проектируются для сопротивления нагрузке, действующей вдоль их продольной оси, и тело имплантата особенно восприимчиво к усталостному разлому при изгибающих нагрузках в щечно-язычной плоскости. Такие поперечные изгибающие нагрузки могут быть вызваны преждевременными контактами, бруксизмом или имплантатами, установленными под значительным углом. Корневидные имплантаты не проектируются специально для противодействия циклическим изгибающим нагрузкам. Поэтому следует соблюдать большую осторожность при планировании лечения, чтобы избежать действия деструктивных поперечных или изгибающих нагрузок на них.
Способность имплантатов и винтов абатментов противодействовать разлому вследствие изгибающих нагрузок, прямо пропорциональна моменту инерции компонента имплантата (или фактору резистентности к перелому при изгибе). Этот параметр зависит от геометрии поперечного сечения компонента. Тела имплантатов особенно чувствительны к усталостному разлому у апикального удлинения винта абатмента в теле имплантата или у крестального модуля вблизи винта абатмента, у которого нет прямого контакта с внутренним шестигранником. В этих областях поперечное сечение тела имплантата можно спроектировать в виде кольца, подобно поперечному сечению трубы. Сопротивление разлому при изгибе в этих условиях равно разности возведенных в 4-ю степень значений радиусов наружного и внутреннего кольца. Толщина стенки тела имплантата в этой области контролирует резистентность к усталостному перелому. Например, если имплантат с наружными диаметром 3,75 мм имеет резьбу глубиной 0,4 мм, то малый диаметр составляет 2,95 мм (радиус 1,47 мм). Если этот имплантат имеет отверстие для винта абатмента шириной 2,5 мм (радиус 1,25 мм), то его сопротивляемость перелому от изгиба составляет: 1,474 (радиус наружного кольца в 4-й степени) минус 1,254 (радиус внутреннего кольца в 4-й степени) равно 0,22 мм. Даже небольшое увеличение толщины стенки может привести к значительному увеличению сопротивления перелому при изгибе, поскольку это измерение возводится в 4-ю степень. Когда наружный диаметр увеличивается на 0,1 мм, а внутренний диаметр остается неизмененным, сопротивление разлому при изгибе увеличивается до 2,967, или на 33%. Когда наружный диаметр остается неизмененным, а внутренний возрастает на 0,1 мм, то увеличение составляет 2,671 (или 20%). Таким образом, увеличение наружного диаметра (который также увеличивает общую поверхность контакта с костной тканью) имеет более значительный эффект на прочность стенки тела имплантата. Общий стресс при изгибе (и вероятность разлома) уменьшается экспоненциально, по мере того как момент инерции (фактор сопротивляемости разлому при изгибе) возрастает.
Протез или винт колпачка часто имеет меньший момент инерции, чем тело имплантата. Таким образом, если протезный винт частично ослаблен и несет значительную часть поперечной нагрузки на окклюзионную поверхность, винт сломается из-за усталости при изгибе. Некоторые исследователи предположили, что феномен разлома винта является долгосрочным преимуществом для имплантата. Другими словами, пусть лучше сломается винт, чем имплантат, потому что винт легко удалить, а имплантат – нет. Хотя эта концепция имеет некоторую ценность, она также является ложным фактором безопасности. Большинство протезов с опорой на имплантаты имеют более одного абатмента имплантата. Как только один винт ослабнет или сломается, возрастает стресс на оставшиеся имплантаты, компоненты имплантатов или области контактов с костной тканью. Дополнительные консольные нагрузки увеличивают стресс и могут способствовать потере кости или перелому компонента имплантата. Наличие поперечных нагрузочных контактов должно быть установлено, и они должны быть исправлены за счет коррекции окклюзии, до того как произойдет разлом винта.
Длительность действия силы может также изменять реакции зоны контакта «кость-имплантат». Сообщается о повреждении из-за усталости при относительно высокой скорости роста нагрузки (шины голени у бегунов). Хотя в литературе не приводятся данные о повреждении альвеолярной кости из-за усталости, маловероятно, что альвеолярная кость реагирует по-иному на парафункциональные нагрузки. Roberts15 сообщает, что кость вокруг имплантата может ремоделироваться со скоростью 500% в год, в отличие от нормального трабекулярного физиологического ремоделирования со скоростью 20% в год. Frost считает, что постоянная регенерация отчасти может быть связана с усталостным повреждением и свидетельствовать о соответствии значений микронапряжения зоне перегрузки.
Клиническая несостоятельность дизайна имплантата, связанная с длительностью действия силы
Morgan и соавт. сообщают о несостоятельности имплантатов Branemark под воздействием изгибающих нагрузок. Микрограммы поверхностей дали возможность авторам определить, что направление нагрузок было щечно-язычным. Перелом происходил, как и предполагалось, в той области имплантата, в который площадь поперечного сечения уменьшалась.
Физиологические воздействия на дизайн
Три типа сил могут воздействовать на дентальные имплантаты в полости рта:
-
компрессионные;
-
растягивающие;
-
поперечно-сдвигающие.
Кость наиболее устойчива к действию компрессионных сил. Она на 30% менее прочна, если подвергается воздействию растягивающих сил, и на 65% — поперечно-сдвигающих. В зоне контакта «кость-имплантат» при установке эндостальных корневидных имплантатов действуют только поперечно-сдвигающие силы (например, цилиндрический имплантат с гладкими стенками), если только особенности поверхности дизайна не предусматривают их трансформацию в тип сил, к которым существует более высокая резистентность. Необходимо пытаться ограничить действие поперечно-сдвигающих сил на кость, поскольку она в таких условиях наименее резистентна к перелому.
Влияние на дизайн тела имплантата
Тело имплантата в виде гладкого цилиндра приводит к развитию поперечно-сдвигающих нагрузок в зоне контакта «кость-имплантат». Таким образом, для этой формы тела имплантата нужно использовать систему микроскопической ретенции посредством покрытия имплантата титаном или гидроксиапатитом. Интеграция зоны контакта зависит от прочности связи «гидроксиапатит-кость». Качество гидроксиапатитового покрытия исключительно важно. Если гидроксиапатит резорбируется из-за инфекции или ремоделирования или должен быть механически удален для лечения периимплантита, цилиндр без покрытия с гладкими сторонами значительно хуже передает нагрузку на окружающие ткани.
Винтовые имплантаты имеют способность трансформировать тип силы, действующей в зоне контакта с костью, вследствие тщательно контролируемой геометрии резьбы. Профиль резьбы дентальных имплантатов особенно важен для изменения типа силы в зоне контакта с костью. Он может быть:
-
квадратным;
-
V-образным;
-
упорным.
При аксиальных нагрузках, действующих на дентальный имплантат, V-образный профиль (типичный для имплантатов Paragon и Nobel Biocare) сравним с упорным (типичным для имплантатов SteriOss) и при аналогичном угле резьбы характеризуется примерно в 10 раз большим сдвигающим компонентом силы, чем квадратный профиль (типичный для имплантатов BioHorizons). Уменьшение поперечно-сдвигающей нагрузки в зоне контакта «резьба-кость» уменьшает риск перегрузки, что особенно важно в ослабленной кости D3 и D.
Клиническая несостоятельность дизайна имплантата, связанная с типом силы
Анатомия верхней и нижней челюсти создает значительные ограничения для хирургической установки корневидных имплантатов, дизайн которых предполагает, что нагрузка будет действовать вдоль их продольной оси. Схема развития процессов резорбции после длительного периода адентии усложняет решение проблемы ангуляции. Костные поднутрения еще больше ограничивают установку имплантатов, а также контроль направления силы. Почти все поднутрения находятся с лицевой стороны кости, за исключением поднижнечелюстной ямки в задней части челюсти. Таким образом, тела имплантатов часто наклоняют в язычную сторону, чтобы избежать пенетрации лицевого поднутрения во время установки. Кость наиболее прочна, когда нагружается вдоль продольной оси имплантата при действии компрессионных или растягивающих сил. Отклоняющаяся на 30° от оси нагрузка уменьшает компрессионную прочность кости на 11% и прочность при растяжении – на 25%.
Когда угол направления действия нагрузки увеличивается, то стресс вокруг имплантата также растет, особенно в области крестальной кости. Как результат, практически все имплантаты конструируются для установки перпендикулярно плоскости окклюзии. Такая установка позволяет обеспечить в основном аксиальную нагрузку на тело имплантата и уменьшает величину стресса в крестальной кости. Кроме того, аксиальное выравнивание создает меньший стресс на компоненты абатмента и снижает риск разлома в ближайшем будущем и долгосрочной перспективе.
Угол резьбы или плато могут изменить направление нагрузки, действующей в месте соединения протеза и абатмента, на другое у кромки кости. Как результат, аксиальная нагрузка на платформу имплантата становится в основном компрессионной, но 30° угол резьбы с V-образным профилем может уменьшить величину нагрузки, которой способна сопротивляться зона контакта «кость-имплантат» (как описано ранее).
Силовой дизайн резьбы способен воспринять нагрузку в месте соединения протеза с абатментом и трансформировать ее в более аксиальную вдоль тела имплантата, чтобы увеличить долю компрессионных сил в общей величине нагрузки.
Хирургическая установка с чрезмерной ангуляцией имплантата или вероятность наличия парафункциональной активности пациента приводят к невозможности для дизайна дентального имплантата выдерживать физиологические нагрузки. Консоли и высота коронки являются рычагами и, следовательно, увеличивают силы. Тщательное планирование лечения с особым вниманием к нему при использовании нескольких имплантатов для увеличения функциональной площади поверхности необходимо, если клиническая ситуация может привести к значительному увеличению силы. Умножение силы вокруг отдельного имплантата соотносится с плотностью кости, напрямую связанной с ее прочностью. Кость 04 примерно в 10 раз менее прочная, чем кость 01; при действии равных нагрузок в менее прочной кости происходит умножение силы и наблюдается клинический результат, который мог бы быть получен, если бы имплантаты устанавливались в еще более мягкие типы кости. Как результат, нужно приложить значительное усилие, чтобы снизить эффекты недостаточной плотности кости, включая изменение дизайна и размера, покрытие и прогрессивную нагрузку имплантата, чтобы уменьшить стресс или увеличить прочность кости. Кроме того, увеличение количества имплантатов является эффективным методом уменьшения стресса. Также увеличение количества имплантатов уменьшает длину консоли, что еще больше ограничивает влияние роста величины силы.
Нормальная анатомия верхней и нижней челюстей создает значительные геометрические ограничения для размера и конфигурации дентальных имплантатов. Эта анатомическая проблема заслуживает особого внимания, учитывая относительно большие окклюзионные нагрузки, которые должны быть распределены через очень небольшую структуру – тело имплантата.
Объем доступной кости зависит от ее анатомической локализации и степени резорбции. Объем начальной кости по ширине больше в задней части полости рта. Как общее правило, ширина кости чаще составляет 6, а не 8 мм в передней части полости рта. Поэтому в этой области наиболее часто используются имплантаты диаметром 4 мм. Задние отделы челюстей чаще всего имеют ширину более 7 мм, и можно использовать имплантаты диаметром 5 мм. Следовательно, диаметр имплантата может увеличиваться при росте действующей силы от передней области полости рта к задней. Высота кости, наоборот, обычно уменьшается от передней части нижней челюсти (по сравнению с передней частью верхней челюсти) к задним отделам челюстей и является наименьшей в адентичной задней части верхней челюсти. Таким образом, когда окклюзионные силы возрастают, высота кости и объем уменьшаются. Тщательно продуманный инновационный дизайн имплантатов требуется для установки в кость с такими анатомическими ограничениями. Качество кости также определяет анатомические требования по оптимизации площади поверхности.
Корни естественных зубов могут служить в качестве индикатора требований к поверхности имплантата при протезных нагрузках. Наименьший диаметр и площадь поверхности корней имеют резцы нижней челюсти. Передние зубы верхней челюсти сходны по площади поверхности своих корней с клыками и премолярами нижней челюсти и премолярами верхней челюсти. Зубами с наибольшим диаметром и площадью поверхности корней являются моляры обеих челюстей. Соответственно на место резцов нижней челюсти могут быть установлены имплантаты диаметром 3,5 мм, на место передних зубов и премоляров верхней челюсти, передних зубов и премоляров нижней челюсти, клыков и премоляров нижней челюсти – имплантаты диаметром 4 мм, а моляров – имплантаты диаметром 5 мм на обеих дугах.
На верхней и нижней челюстях кость может иметь 4 разных категории плотности с различной степенью биомеханической прочности (способностью выдерживать физиологические нагрузки). Во всем мире часто регистрируются случаи клинической несостоятельности имплантатов в пористой кости плохого качества в отличие от более плотной кости. В кости 1)4 этот уровень может достигать 35%, часто это вызывается ранней несостоятельностью имплантатов в связи с перенагрузкой. Чтобы снизить стресс, имплантолог может увеличить число имплантатов или использовать дизайн с большей площадью поверхности. Общепринятые положения имплантационной стоматологии обязывают клинициста использовать планы лечения для таких типов кости без учета преимуществ имплантатов, специально спроектированных для улучшения качества кости в полости рта. Оптимизация площади поверхности с учетом качества кости требует понимания различия между общей и функциональной площадью поверхности.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии