Лечение дефекта межжелудочковой перегородки
При небольших дефектах естественное течение благоприятное. Эти дети не нуждаются в специфическом лечении, за исключением профилактики бактериального эндокардита антибиотиками при подозрении на бактериемию и при различных хирургических вмешательствах.
Если у младенца имеет место дефект средних размеров, может развиться сердечная недостаточность. Эффективное медикаментозное лечение позволяет не прибегать к раннему хирургическому вмешательству. Начальная терапия заключается в назначении дигоксина в насыщающей дозе 0,05 мг/кг в таблетках или 0,04 мг/кг внутривенно. Вначале назначают половину этой суточной дозы и дают с интервалом 6-8 ч. Поддерживающие дозы варьируют от 0,008 до 0,01 мг/кг/день при двукратном пероральном приеме. Фуросемид назначают в дозе 1-2 мг/кг внутривенно ребенку с тяжелой симптоматикой в течение нескольких дней, если необходимо. При продолжительном использовании следует контролировать электролиты и азот мочевины в крови. Пациентам, которые требуют хронического приема диуретиков, назначают в сочетании гидрохлортиазид и альдактон по 1-2 мг/кг/день каждого препарата. Альтернативным в трудных случаях является прием фуросемида 2-3 мг/кг/день в сочетании с альдактоном. При этом потеря калия происходит редко и в его восполнении нет необходимости. Восполнение калия у большинства младенцев является трудной задачей из-за его плохого вкуса. Хронический прием фуросемида может привести к гиперкальциемии, повреждению почек и электролитному дисбалансу. При лечении сердечной недостаточности полезно снижать системную постнагрузку каптоприлом в дозе 0,1-0,3 мг/кг в день.
Медикаментозное лечение следует рассматривать как мост к хирургической коррекции порока. В настоящее время ни возраст, ни масса тела не являются препятствием для хирургического вмешательства. Суживание легочной артерии не имеет преимуществ перед первичной ранней коррекцией, за исключением критических состояний вследствие множественных ДМЖП. Госпитальная летальность в большинстве центров, в том числе и в нашем, не превышает 3-5%.
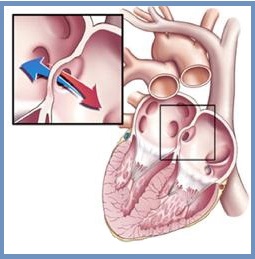
Хирургическое лечение
История
Первое хирургическое вмешательство по поводу ДМЖП было предпринято в 1952 г., когда Muller и Dammann сузили тесьмой легочную артерию, чтобы ограничить легочный кровоток у пациента с большим ДМЖП. Первую внутрисердечную коррекцию ДМЖП выполнил Lillehei в 1954 г. Он применил контролируемое перекрестное кровообращение, при котором один из родителей был в качестве насоса-оксигенатора. Kirklin c соавторами сообщили об успешной чрезжелудочковой коррекции ДМЖП с использованием механического насоса-оксигенатора в 1955 г., и в 1957 г. он впервые применил чреспредсердный доступ к дефекту. В 1961 г. Kirklin осуществил успешное закрытие ДМЖП в младенческом возрасте, доказав отсутствие необходимости суживания легочной артерии. В 1969 г. Okamoto первым сообщил о рутинном закрытии ДМЖП у младенцев в условиях глубокой гипотермии и остановки кровообращения. В том же году аналогичную серию операций выполнил Barratt-Boyes из Новой Зеландии. В феврале 1972 г. в Green Lane Hospital в Окленде состоялся исторический Второй международный симпозиум, труды которого были опубликованы через год. С этого времени началась эра первичной коррекции врожденных пороков у новорожденных. К середине 1980-х годов использование двухмерной ЭхоКГ и позже цветной допплер-ЭхоКГ устранило необходимость выполнения ангиографии для диагностики ДМЖП и других более сложных аномалий. Внутриоперационная эпикардиальная и чреспищеводная ЭхоКГ явились более информатиными методами, позволившими идентифицироваить резидуальные межжелудочковые дефекты и значительно уменьшить необходимость повторных операций.
Попытка коррекции ДМЖП, осложненного аортальной недостаточностью, впервые была предпринята еще в 1956 г. Claypool и сотрудниками. Больной умер от сердечной недостаточности на операционном столе. Через два года Denton и Pappas добились успеха – они ушили надгребешковый дефект у больного с сопутствующей аортальной недостаточностью. В 1958 г. Caramella и соавторы показали в эксперименте на собаках возможность пластической реконструкции аортального клапана при изолированном пролабировании некоронарной створки, используя технический прием "бикуспидализации". Первая успешная операция в клинике выполнена этими же авторами по оригинальной методике в 1960 г.. В последующие годы был разработан целый ряд способов хирургической коррекции ДМЖП с аортальной недостаточностью, в том числе с замещением аортального клапана гомотрансплантатами и первыми шаровыми протезами Starr-Edwards.
В 1973 г. Trusler и соавторы сообщили об успешном применении собственной методики аортальной вальвулопластики, которая получила всеобщее признание.
Показания к операциям
По мере улучшения результатов закрытия ДМЖП благодаря совершенствованию техники искусственного кровообращения, защиты миокарда и раннего послеоперационного ведения показания к операциям расширились и возраст пациентов на момент вмешательства постепенно снизился. Показания к закрытию ДМЖП основаны на сравнении естественного течения с результатами хирургического лечения. Операция показана при наличии:
-
нерестриктивного ДМЖП с застойной сердечной недостаточностью и легочной гипертензией;
-
небольшого ДМЖП с Qл/Qс >1,5:1,0;
-
пролапса аортального клапана или недостаточности аортального клапана;
-
всех обоюдосвязанных субартериальных дефектов;
-
предшествующих эпизодов бактериального эндокардита.
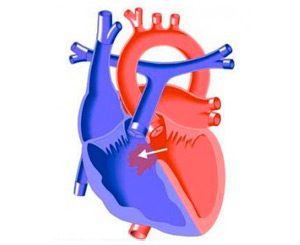
У младенцев с сердечной недостаточностью операция должна быть выполнена до 6-месячного возраста в случаях устойчивости к медикаментозной терапии. После года операция показана всем больным с объемом легочного кровотока, превышающим системный в 2 и более раз, хотя вмешательства предпринимаются не только по гемодинамическим и клиническим показаниям. Учитывая низкую степень хирургического риска, имеется тенденция к расширению показаний у больных с небольшими ДМЖП в целях профилактики бактериального эндокардита и аортальной недостаточности. Дети с легочной гипертензией должны быть прооперированы в период младенчества, но не ранее достижения 2-месячного возраста из-за повышенной степени риска. Операции не показаны при соотношении легочного и системного кровотока менее 1,5:1 и противопоказана при коэффициенте соотношения легочного и системного сосудистых сопротивлений 0,5 или с преимущественным право-левым сбросом. При принятии решений в пограничных случаях полезна комплексная оценка множества клинических и лабораторных показателей. Аргументами в пользу операции могут служить:
-
наличие средней интенсивности систолического шума;
-
увеличение размеров сердечной тени;
-
признаки гипертрофии обоих желудочков на ЭКГ;
-
конечно-диастолический объем левого желудочка, значительно превышающий норму;
-
насыщение артериальной крови в аорте по данным катетеризации сердца выше 90%, которое при пульсоксиметрии с нагрузкой не падает ниже нормального;
-
отсутствие признаков преходящего цианоза;
-
содержание гемоглобина в крови не превышает норму.
Расчеты ЛСС по данным катетеризации сердца имеют важное, но не решающее значение из-за весьма относительной точности метода. Исследование дооперационных биоптатов легких также ненадежно из-за мозаичности изменений в различных сегментах легких.
У детей с множественными ДМЖП типа швейцарского сыра и легочной гипертензией показано суживание легочной артерии с последующей полной коррекцией порока в более старшем возрасте, если дефекты не закрылись спонтанно. Коррекция данного типа ДМЖП сопровождается повышенным риском, несмотря на множество предложенных хирургических и интервенционных кардиологических методик. Диагностика множественных дефектов как до, так и во время операции ненадежна, особенно при наличии основного нерестриктивного дефекта. Трудность закрытия их обусловлена тем, что мелкие множественные дефекты маскируются трабекулярностью правой стороны перегородки. Для улучшения экспозиции прибегают к правой или левой вентрикулотомии и к пересечению трабекул – слишком дорогой цене дисфункции миокарда и перегородки. В последнее время было показано, что короткие разрезы в апикальной части левого желудочка существенно не нарушают его функции, как в ближайшем, так и отдаленном периоде. Улучшению экспозиции трабекулярной перегородки способствует пересечение модераторного пучка. Трудности поиска отдельных дефектов побудили использовать большие двухслойные заплаты, покрывающие всю трабекулярную часть перегородки. Недостатком больших заплат является их выбухание в полость правого желудочка с опасностью перекрытия тракта оттока и возникновения эффекта аневризмы левого желудочка. Для предупреждения этих осложнений предложено фиксировать центр заплаты отдельными швами к трабекулам перегородки, которые, кроме того, уменьшают нагрузку на линию швов по окружности заплаты. Однако заплата ограничивает рост и движение межжелудочковой перегородки. Гипокинезия перегородки снижает фракцию выброса левого желудочка, поэтому большинство хирургов предпочитают отсроченную коррекцию. Суживание легочной артерии как первый этап хирургического лечения дает время для спонтанного или интервенционного закрытия мелких дефектов и облегчения последующей окончательной операции.
При сочетании ДМЖП с большим ОАП проток должен быть закрыт в первые 6-8 нед без закрытия ДМЖП, если он рестриктивный. При больших дефектах оба порока устраняют в пределах одной операции в подходящее время после медикаментозного лечения.
Дефект межжелудочковой перегородки с коарктацией аорты преимущественно оперируют в два этапа: сначала устраняют коарктацию аорты, при необходимости с одновременным суживанием легочной артерии, затем, по показаниям, закрывают ДМЖП. У маленьких детей в связи с небольшой глубиной раны возможна одномоментная коррекция обоих пороков из срединного доступа в условиях искусственного кровообращения. Отечественные хирурги обладают небольшим опытом проведения пяти таких операций, у которых коарктация аорты сочеталась с гипоплазией дуги аорты. Это обусловило необходимость выполнения расширенной пластики дуги.
Аортальная недостаточность с сопутствующим наджелудочковым ДМЖП является прогрессирующей приобретенной аномалией. В целях предупреждения регургитации показана как можно более ранняя операция даже в случаях, когда соотношение легочного и системного кровотока составляет менее 2:1. Закрытие дефекта не всегда может предупредить возникновение и прогрессирование недостаточности клапана. Тем не менее, при закрытии ДМЖП небольшую недостаточность клапана обычно не корригируют из-за отсутствия надежных методов пластической реконструкции. Согласно различным публикациям, 14-16% больных необходимо протезирование клапана.
Опыт показывает, что эффект операции зависит не столько от избранного метода коррекции, сколько от исходной выраженности недостаточности клапана и индивидуальной анатомии порока. Большое значение имеет глубина провисающего синуса Вальвальвы. Некоторые авторы полагают, что прямое ушивание дефекта доступом через легочную артерию с подъемом перегородки к тубулярной части аорты способствует лучшей коаптации аортальных створок. Однако этот метод эффективен только при небольших дефектах перегородки. Метод, предложенный Yacoub и соавторами, предусматривает нормализацию глубины синуса, что увеличивает продолжительность хорошего гемодинамического эффекта операции.
Перимембранозный ДМЖП иногда сочетается с дискретным фиброзным или фиброзно-мышечным субаортальным стенозом. Он также обнаруживается у больных с коарктацией аорты и ДМЖП, а также после суживания легочной артерии или закрытия ДМЖП. Сужение носит прогрессирующий характер и может нарушить функцию клапана. Если градиент давления превышает 30 мм рт. ст., производят резекцию диафрагмы. Необходимо динамическое наблюдение в отдаленном периоде из-за возможности рецидива.
Дебандаж легочного ствола производят путем удаления тесьмы, пластики его аутоперикардом и иссечением места сужения с анастомозом "конец в конец". Сейчас отдают предпочтение последнему варианту операции, так как она практически исключает возможность деформации.
Техника закрытия ДМЖП
Детям в возрасте 2-3 мес. с массой тела менее 3,5 кг операцию обычно выполняют в условиях гипотермической остановки кровообращения. Эту технику применяют также при сопутствующем перерыве дуги аорты. Канюлируют ушко правого предсердия одной изогнутой 16F венозной канюлей и восходящую аорту 8F или 10F канюлей. Искусственное кровообращение начинают с объемной скоростью 150 мл/кг/мин и перевязывают артериальный проток. Проток должен быть перевязан до остановки кровообращения для предупреждения попадания воздуха из открытых правых отделов сердца через открытый проток в аорту. При достижении заданной температуры пережимают аорту и вводят через иглу единственную дозу кадиоплегического раствора в восходящую аорту. Затем останавливают кровообращение, удаляют венозную канюлю после дренирования крови в аппарат.
Большинство дефектов может быть успешно закрыто без остановки кровообращения. Канюляция обеих полых вен позволяет закрыть дефект в условиях постоянной перфузии. Кардиоплегия и активное дренирование левых отделов сердца через прокол межпредсердной перегородки или верхнюю правую легочную вену создают бескровное операционное поле.
Оперативный доступ выбирают в зависимости от типа ДМЖП.
Перимембранозные и приточные дефекты обычно закрывают доступом через правое предсердие. Подартериальные, связанные с аортой и легочной артерией, дефекты достигают через легочный ствол или аорту и правый желудочек. Мышечные дефекты обычно экспонируют через правое предсердие или через небольшие разрезы верхушки правого или левого желудочков. Некоторые перимембранозные и субартериальные дефекты, особенно сочетающиеся с аортальной недостаточностью, лучше доступны через аорту и аортальный клапан.
-
Перимембранозный дефект.
Чреспредсердный доступ обеспечивает оптимальную экспозицию отверстия трехстворчатого клапана и ДМЖП, который простирается в сторону перегородки конуса. Разрез предсердия начинают у основания ушка и проводят параллельно правой коронарной артерии на расстоянии не мене 1 см от нее. Далее линия разреза следует между правой коронарной створкой и канюлей нижней полой вены, заканчиваясь недалеко от коронарного синуса. Накладывают швы-держалки на края разреза, чтобы предсердие удерживать открытым. Небольшим крючком оттягивают переднюю створку трехстворчатого клапана, вторым крючком экспонируют верхний край дефекта, располагая его вблизи переднесептальной комиссуры. Нижний край дефекта оттягивают книзу введенным в дефект отсосным наконечником или изогнутым зажимом. Это позволяет экспонировать верхний и передний края дефекта. Передневерхний треугольник, где встречаются аортальный клапан, кольцо трехстворчатого клапана и вентрикулоинфундибулярная складка, является наиболее труднодоступным и самым частым местом остаточных дефектов. Экспозицию можно улучшить, если первый ассистент указательным пальцем правой руки вдавит основание корня аорты между аортой и правым предсердием. На этом этапе важно определить взаимоотношения дефекта и аортального клапана. Створки аортального клапана могут провисать в дефект. Серьезной ошибкой с тяжелыми последствиями является наложение швов на створки, а не на край дефекта.
Во многих случаях края дефекта очень трудно полностью идентифицировать, поскольку дефект покрыт тканью трехстворчатого клапана. Эту особенность анатомии называют мешочком трехстворчатого клапана. Дефект становится видимым после радиального рассечения септальной створки от свободного края в сторону кольца клапана. На свободные углы разреза накладывают швы-держалки, которые после закрытия дефекта помогают восстановить исходную конфигурацию перегородочной створки.
Дефект перегородки обычно закрывают заплатой из аутоперикарда, обработанного глютаровым альдегидом непрерывным проленовым 5/0 или 4/0 швом. Стежки с малым шагом позволяют избегать просачивания между швами. Многие предпочитают заплату из дакронового войлока, который лучше уплотняет линию шва.
Линию шва начинают от места крепления мышцы Lancisi и продолжают против часовой стрелки. Первые несколько стежков проводят через заплату, фиксированную зажимом к операционному белью на расстоянии от сердца. Затем заплату осаживаят на место и, подтягиваят ее книзу, экспонируют участок для проведения следующего витка. После прохождения верхнего края дефекта линия шва подходит к месту, где дефект примыкает к кольцу трехстворчатого клапана. Здесь непрерывный шов продолжают несколькими параллельными матрацными стежками, проводимыми через заплату с выколом в правое предсердие по кольцу. Конец нити оставляют на зажиме с резиновыми трубочками. Далее вторым концом нити продолжают линию шва по часовой стрелке Для предупреждения повреждения проводящей системы швы книзу и кзади от папиллярной мышцы Lancisi проводят поверхностно по правой стороне перегородки, отступая от нижнего и заднего краев дефекта на 2-3 мм. В этой тесной области необходимо аккуратно работать под хордами, пересекающими дефект, чтобы не захватить в шов подклапанный аппарат перегородочной створки. После завершения линии шва конец нити выводят через кольцо клапана в предсердие, где связывают ее с первым концом на синтетической или перикардиальной прокладке. Если шов у маленького ребенка связывать со стороны желудочка, пирамида узлов будет травмировать перегородочную створку и нарушать ее функцию.
Если перегородочную створку не рассекать, доступ к заднему краю дефекта можно улучшить укрепленными прокладками П-образными швами, проведенными по основанию перегородочной створки со стороны правого предсердия в желудочек. При подтягивании этих швов кзади створка отворачивается, открывая доступ ко всем краям дефекта. В последующем эти швы используют для фиксации заплаты в области кольца трехстворчатого клапана.
Целостность септальной створки восстанавливают отдельными узловыми швами 6/0 проленом. Проверяют компетентность трехстворчатого клапана введением холодного солевого раствора в правый желудочек. Герметичность заплаты на дефекте проверят с помощью гидропробы – введения окрашенного кровью солевого раствора в левый желудочек через отверстие в межпредсердной перегородке. Левые отделы сердца заполняются бронхиальной коллатеральной кровью. После ушивания предсердия двойным швом снимают тесемки с полых вен и заполняют кровью правый желудочек, что является частью процедуры удаления воздуха. Обычно прокалывают стенку правого желудочка толстой иглой с множеством боковых отверстий и, как правило, эвакуируют из него достаточно большое количество воздуха. Инвагинируя ушко левого предсердия и слегка массируя левый желудочек, снимают зажим с аорты и оставляют открытым отверстие, использованное для кардиоплегии. Активный отсос крови из аорты у маленьких детей не применяют из-за возможного обкрадывания коронарного кровообращения. Чаще всего синусовый ритм восстанавливается спонтанно. Если сердце долго фибриллирует, производят деполяризацию мощностью 1 Дж/кг.
Иногда перимембранозный дефект закрывают доступом через правый желудочек, когда необходимо выполнить дополнительную процедуру через вентрикулотомию, например, резекцию инфундибулярного сужения. Выполняют косой разрез конусного отдела желудочка параллельно конусной ветви правой коронарной артерии. Обычно 2-4 горизонтальных матрацных шва с прокладками проводят через основание трехстворчатого клапана со стороны правого предсердия, затем швы проводят через заплату, опускают ее в желудочек и завязывают. Отдельными и непрерывными швами фиксируют заплату к краям дефекта сначала против часовой стрелки, затем по часовой стрелке. Концы нитей связывают в верхней точке. В области, где хорды пересекают плоскость дефекта, шов проводят под хорду, затем – через край дефекта и в обратном направлении под хорду к заплате. Если используют отдельные матрацные швы, их следует накладывать первыми, проводить под хордами, опускать заплату и завязывать швы, вначале фиксируя заплату в неудобном месте. Наиболее уязвимой областью является промежуток между септальной створкой и папиллярной мышцей Lancisi, где швы следует проводить, отступя 3-4 мм от края дефекта.
-
Субартериальный дефект.
При этой редкой локализации дефект закрывают доступом через вертикальный разрез легочного ствола. Переднюю створку полулунного клапана крючком оттягивают книзу. Заплату к нижнему и боковым краям дефекта пришивают непрерывным швом. Верхний край дефекта не имеет мышечной перегородки, разделяющей аортальный и легочный клапаны, поэтому отдельные П-образные швы с прокладками проводят по основанию створок легочного клапана изнутри ствола и затем через заплату. Проводящие пути проходят вдали от краев дефекта.
-
Приточный дефект.
Этот тип дефектов закрывают доступом через правое предсердие. Поскольку дефект почти полностью покрыт септальной створкой трехстворчатого клапана, удобного доступа, по предложению Hudspeth и соавторов, можно достичь путем отсечения септальной и части передней створки на расстоянии 1-2 мм от кольца. Заплата не должна быть слишком широкой, поскольку выбухающая избыточная заплата будет ограничивать подвижность перегородочной створки. Важно дифференцировать приточный дефект от мышечного дефекта в приточной части перегородки, так как курс пучков проводящей системы сердца при этих дефектах различный. Атриовентрикулярный узел прободает правый треугольник центрального фиброзного тела у переднесептальной комиссуры трехстворчатого клапана. После пластики дефекта отсеченные створки пришивают к кольцу клапана непрерывным обвивным швом.
-
Мышечные дефекты.
Мышечные дефекты чаще закрывают доступом через правое предсердие, используя отдельные матрацные швы с прокладками. В случаях, когда дефект, расположенный в средней части мышечной перегородки, примыкает близко к перимембранозному дефекту, проводящие пути часто проходят в мышечном мостике между дефектами, поэтому их закрывают одной большой заплатой вдали от пучка проводящей ткани.
Передние мышечные дефекты закрывают через короткий вертикальный разрез выводного тракта правого желудочка или через трехстворчатый клапан. Дефекты обычно имеют множественные мелкие отверстия со стороны правого желудочка, скрытые под трабекулами и сплетающие перегородочно-краевую трабекулу со свободной стенкой правого желудочка. При закрытии этих дефектов существует опасность травмирования передней межжелудочковой артерии и/или ее септальных ветвей. Дефекты облитерируют между двумя полосками из фетра или перикарда, располагая одну из них внутри, а другую снаружи правого желудочка параллельно левой передней нисходящей артерии. Этот метод описан Breckenridge и соавторами, которые назвали свою технику внешней подпоркой.
Kitagawa и соавторы рассекали мышечные трабекулы, септальный и модераторный пучки для лучшей экспозиции среднетрабекулярных и передних мышечных дефектов. Этот прием является достаточно травматичным.
Заслуживает внимания альтернативная техника этих же авторов, применивших методику использования заплаты большего размера. Для создания доступа к левой стороне межжелудочковой перегородки пересекают лишь минимальное количество трабекул. Заплату из синтетического материала вырезают заведомо большего, чем дефект, размера. Предварительно накладывают швы на заплату, затем ее вводят через дефект в левый желудочек и укрепляют швами, проведенными через перегородку с левой стороны на правую. При этом достигается лучшая герметизация дефектов, так как заплата прижимается к краям дефекта благодаря разнице давления в левом и правом желудочках.
-
Верхушечные дефекты.
Верхушечные дефекты и множественные мышечные дефекты типа швейцарского сыра наиболее трудны для коррекции. К счастью, многие из них закрываются спонтанно после суживания легочной артерии. Если сохраняется сердечная недостаточность и есть необходимость закрыть дефекты, применяют чреспредсердный доступ или короткий разрез в бессосудистой зоне верхушки левого желудочка на безопасном расстоянии между передней и задней нисходящими коронарными артериями. Особое внимание уделяют предупреждению повреждения передней сосочковой мышцы митрального клапана. Поверхность межжелудочковой перегородки со стороны левого желудочка относительно гладкая, обычно имеется один дефект, который удобно закрыть заплатой. Укрепление шва разреза желудочка полоской перикарда помогает герметизировать рану. Использование левой вентрикулотомии для закрытия апикальных дефектов представлено во многих работах, однако в них приводятся данные о возникновении акинезии миокарда в зоне разреза левого желудочка, умеренной дисфункции и более длительном периоде восстановления насосной функции желудочка. В отдаленном периоде возможно возникновение левожелудочковых аневризм в месте разреза.
Mace с соавторами опубликовали свой метод закрытия множественных ДМЖП типа швейцарского сыра. Доступом через правое предсердие трабекулярную перегородку закрывают единой заплатой, которую фиксируют отдельными П-образными швами. Во время систолы такая заплата выбухает в полость правого желудочка, вызывая частичную обструкцию выводного тракта. В связи с этим авторы предложили накладывать дополнительные фиксирующие швы в центре заплаты для предупреждения эффекта аневризмы.
Williams и соавторы применили технику чреспредсердной реэндокардиализации, или пакетирования, согласно которой трабекулы над множественными ДМЖП последовательно сшивали двуслойными полипропиленовыми швами. Большие дефекты закрывали синтетическими заплатами. Частота резидуальных дефектов была высокой, однако выраженность остаточного шунтирования была несущественной и не требовала повторного вмешательства.
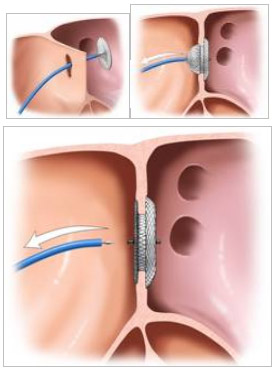
Как показывает опыт, небольшой дефект можно закрыть во время операции двумя пуговицами из плотного велюра. Через разрез аорты или открытое овальное окно вводят изогнутый зажим в левый желудочек, кончиком которого нащупывают отверстие со стороны левого желудочка и захватывают нить с иглой в правом желудочке. Нить вытягивают наружу и П-образным швом прошивают центр пуговицы, затем оба конца нити таким же образом проводят в правый желудочек, нанизывают на два конца нити вторую пуговицу и связывают нити, облитерируя дефект между двумя пуговицами.
Имеются сообщения, что дефекты в верхушечной части желудочка можно закрыть до, во время или после операции с помощью катетерной технологии специальными зонтичными устройствами и спиралями с "трехмерной памятью". В последнее время все чаще появляются сообщения о применении так называемых гибридных методик, или сочетания хирургических и малоинвазивных методов интервенционной кардиологии. Разработано несколько видов устройств для чрескожного закрытия ДМЖП:
-
двойной зонтик Rashkind;
-
устройство Lock;
-
пуговичные устройства.
Применение этих технологий ограничено у новорожденных и грудничков, так как они предусматривают использование жесткого проводника, который может вызвать перфорацию сердца.
Одновременная коррекция субаортального стеноза, несоосного ДМЖП и обструкции дуги аорты в неонатальном возрасте
У новорожденных с ДМЖП и обструкцией дуги часто встречается субаортальный стеноз, обусловленный отклонением инфундибулярной перегородки кзади в выводной тракт левого желудочка. Поскольку аортальное кольцо часто гипоплазировано, резекция инфундибулярной перегородки через стандартный аортальный доступ трудновыполнима. Воуе и соавторы предложили метод устранения субаортального стеноза путем резекции верхнего края ДМЖП до аортального кольца, используя доступ через правое предсердие. Увеличенный таким образом ДМЖП затем закрывали заплатой для расширения субаортального пространства.
Операцию выполняют в условиях глубокой гипотермии и одного периода остановки кровообращения. У пациентов с перерывом дуги аорты используют две аортальные канюли, соединенные Y-образным коннектором для осуществления одновременной перфузии восходящей и нисходящей аорты во время охлаждения пациентов. После остановки кровообращения вводят единственную дозу кардиоплегического раствора и перекрывают турникетами сосуды дуги. Дугу аорты восстанавливают прямым анастомозированием, используя непрерывный рассасывающийся шов. Затем открывают правое предсердие и экспонируют ДМЖП через трехстворчатый клапан. На верхний край дефекта накладывают шов-держалку для улучшения экспозиции правой коронарной створки аортального клапана и выворачивания инфундибулярной перегородки из выводного тракта левого желудочка в просвет дефекта. Оттянутую швом инфундибулярную перегородку иссекают до кольца аортального клапана. Расширенный дефект закрывают заплатой соответствующей конфигурации с правой стороны перегородки. Возобновляют искусственное кровообращение и начинают согревание. Аппарат отключают при температуре в прямой кишке 35-37 0С.
Остаточные ДМЖП
Для диагностики остаточных шунтов еще на этапе кардиоплегии проводят гидропробу. Шприцем с надетой на него трубкой вводят в левые отделы сердца через отверстие в межпредсердной перегородке окрашенный кровью солевой раствор. Появление его в правом желудочке позволяет найти остаточный дефект. После отлучения от искусственного кровообращения дефект можно заподозрить по дрожанию на передней поверхности правого желудочка или по цветной струе при чреспищеводном ЭхоКГ-исследовании. При умеренных или больших остаточных дефектах хирург должен возобновить искусственное кровообращение и ревизовать межжелудочковую перегородку. При недоступности операционной ЭхоКГ решение о ревизии принимают на основе интраоперационного исследования объема внутрисердечного шунта по кислородному "скачку". Двумя шприцами аспирируют кровь из правого предсердия и легочной артерии для определения насыщения крови кислородом. Сатурация крови в аорте известна. Соотношение объемов кровотока по малому и большому кругам кровообращения.
Пролапс аортальной створки устраняют путем укорочения свободного края. Центральную часть створки собирают в складку с помошью П-образного шва, укрепленного прокладками из аутоперикарда.
Некоторые хирурги считают недостатком медиальной пликации то, что гофрированный сегмент створки оказывается в зоне интенсивной гемодинамической нагрузки. Поэтому Spencer и соавторы накладывали плицирующие швы с обоих краев пораженной створки. Дальнейшее усовершенствование этого метода состояло в том, что плицируемую часть створки стали фиксировать к аортальной стенке в области комиссуры. Frater применил способ аппроксимации аранциевых бугорков всех трех створок на одной лигатуре-держалке. С этих пор держалка по Frater стала обязательной деталью техники аортальной вальвулопластики. Trusler и соавторами для иммобилизации гофрированного сегмента створки предложили выводить швы на внешнюю сторону аортальной стенки как при односторонней, так и при двусторонней пликации. Это обеспечило дополнительную надежность аортальной вальвулопластики. Для уменьшения нагрузки на гофрирующие швы отечественные, как и другие хирурги, сшивают один или оба конца пораженной створки с соседней нормальной створкой матрацными швами на прокладках.
Если створка очень тонкая, можно применить прием, предусматривающий укрепление ее свободного края двумя тонкими полосками из аутоперикарда. Степень укорочения длины свободного края измененной створки зависит от длины краев других створок.
Murphy и Poirier предложили достаточно агрессивный способ аортопластики при поражении правой коронарной и некоронарной створок. Аорту рассекали вертикально между этими створками и ниже на 1 см. Избыток провисающих створок извлекали через разрез из просвета аорты и затем сшивали вместе с краями аорты. Этот способ может быть использован только при одновременном поражении правой и некоронарной створок. Его нельзя применить при близком к разрезу аорты расположении устьев коронарных артерий.
Использовался также метод подвешивания створки подобно занавеске на непрерывном матрацном шве, при стягивании которого свободный край створки укорачивался. Концы нити фиксировали снаружи аорты на уровне комиссуры. Этот метод ненадежен, так как пораженные створки обычно истончены и шов под нагрузкой может прорезаться.
Метод, предложенный Yacoub и соавторами, предусматривает нормализацию глубины синуса. Авторы исходили из того, что провисающая створка увлекает стенку синуса, в результате чего она лишается среднего слоя. Закрытие ДМЖП и уменьшение глубины синуса выполняют доступом через аорту. На дефект со стороны правого желудочка накладывают П-образные швы, проводят через основание синуса и завязывают на уровне синотубулярного соединения. Эта техника устраняет важный компонент несостоятельности аортального клапана и обеспечивает продолжительный хороший гемодинамический эффект операции.
Результаты хирургического лечения
В настоящее время хирургическая летальность при коррекции изолированных ДМЖП не превышает 1%. Ранняя послеоперационная смертность от легочных гипертонических кризов у пациентов с начальными изменениями легочных сосудов существенно снижена благодаря послеоперационному мониторированию давления в легочной артерии и применению комплекса профилактических и лечебных мероприятий.
Отдаленные результаты хирургического лечения ДМЖП с легочной гипертензией
Отдаленные исходы и возможность регрессии изменений в легочных сосудах у больных с легочной гипертензией зависят от двух факторов – возраста и величины ЛСС на момент коррекции. Регрессия этих изменений возможна в течение первых 6 мес. жизни. Однако, как показало First Joint Study, у некоторых детей с незначительно повышенным ЛСС после операции наблюдалось его существенное повышение до степени, которая квалифицировалась как синдром Eisenmenger.
Большинство кардиологов пришли к мнению о нецелесообразности рекомендовать хирургическое вмешательство пациентам, у которых ожидается прогрессирование обструктивной болезни легочных сосудов после закрытия дефекта. Известный детский кардиолог Somerville отмечала, что прогноз у пациентов с повышенным ЛСС, которые перенесли закрытие дефекта, хуже, чем естественное течение у больных с синдромом Eisenmenger. Трудное решение выбора хирургической тактики принимают на основе комплекса клинико-лабораторных исследований: ангиографии легочного сосудистого русла и легочной биопсии и многих клинических признаков. Тем не менее, многих больных оперируют с надеждой на регрессию легочной гипертензии. Очевидно, что результаты таких операций неоднозначны. У старших пациентов на момент операции ЛСС будет возрастать. Даже у некоторых младенцев и младших детей после закрытия дефекта может быстро прогрессировать склероз легочных сосудов. Как следует из обзора клинического течения болезни у включенных в First Joint Study пациентов с большим межжелудочковым дефектом, повышенным давлением в легочной артерии, но с нормальным ЛСС, после операции ни у одного из них не развился синдром Eisenmenger, хотя у 15% отмечена резидуальная легочная гипертензия. Из 41 оперированного пациента с повышенным ЛСС у одного развился синдром Eisenmenger и у 17,5% была остаточная легочная гипертензия.
Результаты хирургического лечения множественных ДМЖП
Госпитальная летальность после первичной коррекции множественных дефектов, по данным разных авторов, колеблется от 2,7 до 16%. В ближайшем послеоперационном периоде часть летальных исходов связана с наличием больших остаточных дефектов, а также развитием инфарктов миокарда, AV-блокады, остаточной легочной гипертензии.
Несмотря на существование ряда способов интраоперационной диагностики незакрытых дефектов, частота резидуальных дефектов, по данным литературы, варьирует от 6,1 до 75%, а частота повторных операций – от 6 до 28%. Чаще всего остаются незамеченными или незакрытыми трабекулярные дефекты, особенно передние, среднемышечные, задние и апикальные . По другим данным, верхушечные дефекты являются наиболее частой причиной остаточного шунтирования. По материалам, разработанным Сиромахой, из 137 оперированных пациентов с данной патологией у 18,1% отмечен клинически не значимый остаточный шунт.
Показаниями к повторным операциям являются выраженные клинические проявления шунтирования, коэффициент соотношения легочного и системного кровотока более 1,5. Считается, что если коэффициент Qл/Qс, рассчитанный в операционной, не превышает 1,3, нет необходимости возобновлять искусственное кровообращение для закрытия остаточных дефектов.
Результаты хирургического лечения ДМЖП с аортальной недостаточностью
Раннее закрытие субартериальных дефектов до развития выраженной аортальной недостаточности является надежной профилактикой этого осложнения. При данной локализации дефекта вмешательство следует предпринимать безотлагательно. Без операции у 78% из 139 пациентов развилась аортальная недостаточность. Частота пролапса и аортальной недостаточности с возрастом прогрессивно увеличивалась и в 1 год, 5, 10, и 15 лет составила 8, 30, 64, 83% и 3, 24, 45, 64% соответственно.
По данным Тrabier и соавторов, которым принадлежит один из методов коррекции пролапса аортального клапана, через 10 лет после операции в повторном вмешательстве на аортальном клапане нуждались 24% пациентов с исходным перимембранозным ДМЖП и 15% – после закрытия субартериального дефекта. Остаточная регургитация на аортальном клапане требует пожизненного наблюдения за динамикой недостаточности клапана и функционального состояния сердца для своевременного повторного вмешательства, которое, как правило, предусматривает протезирование клапана.
Нарушения проводящей системы после коррекции ДМЖП
Полная блокада правой ножки пучка Гиса является типичным последствием чрезжелудочкового доступа к дефекту перегородки у 78,9% пациентов, при чреспредсердном доступе ее частота снижается до 33,3%. Наиболее благопрятным с этой точки зрения является доступ через легочную артерию.
В раннюю хирургическую эру полная AV-блокада была нередким осложнением. В настоящее время частота хирургически обусловленной блокады при простых дефектах не превышает 1% и несколько выше у больных с множественными дефектами или дефектами типа швейцарского сыра. Даже в раннем послеоперационном периоде часто возникает транзиторная полная блокада, которая проходит в течение 9 дней перед выпиской из стационара. К сожалению, у некоторых пациентов, выписанных после операции с синусовым ритмом, через много лет развивается полная блокада.
Состояние физической работоспособности
Физическая работоспособность по данным тестов с нагрузками у больных с небольшими ДМЖП и у оперированных пациентов снижена в сравнении с контрольной популяцией. Снижение функции связано с хронической объемной перегрузкой левого желудочка и, возможно, с недостаточной защитой миокарда. Первое подтверждается связью между более старшим возрастом на момент операции и неадекватным увеличением сердечного выброса в ответ на нагрузку и снижением максимальной частоты сердечных сокращений в сравнении с таковыми в контрольной популяции. Наихудшие результаты теста с дозированной нагрузкой на велоэргометре получены у оперированных пациентов с остаточными дефектами. В случаях, когда давление в легочной артерии нормализовалось после операции у пациентов в возрасте 3-12 лет с исходно повышенным ЛСС, в отдаленном периоде все пациенты вели нормальный образ жизни и у большинства отсутствовали симптомы. Однако во время тестов с нагрузкой систолическое давление в легочной артерии резко поднималось в сравнении с их собственным базальным уровнем давления в покое. Аналогичные наблюдения приводят многие авторы. Подобная реакция на нагрузку отсутствовала у детей, оперированных в возрасте до 1 года.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания





Комментарии