Торакоскопическая ваготомия: лечение пептических язв
Резекция желудка занимает ведущее место в хирургическом лечении язвенной болезни двенадцатиперстной кишки, особенно ее осложнений. Неизбежное появление постгастрорезекционной патологии, одним из самых частых проявлений которой (5-10%) служит пострезекционная пептическая язва (ППЯ), ухудшает результаты этой операции.
Вследствие малой эффективности консервативной терапии ППЯ и угрозы развития осложнений больным показано оперативное лечение.
Однако не все вопросы хирургического лечения данной патологии решены в настоящее время. Надежное подавление кислотопродукции при резекции, не дополненной ваготомией, возможно только при обширном повторном иссечении кислотопродуцируюшей зоны желудка. Реконструктивные операции вследствие изменений топографо-анатомических взаимоотношений органов брюшной полости, вызванных предшествовавшей операцией, связаны с большими техническими трудностями и сопровождаются высокой летальностью. Отмечается также высокий процент рецидива язв и после реконструктивных операций.
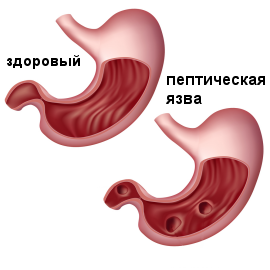
Значительному улучшению результатов лечения ППЯ способствовало внедрение в практику стволовой ваготомии без вмешательств на культе желудка, эффективность которой при ППЯ доказал Dragstedt еще в 40-х годах. Однако до сих пор эти операции выполняются в подавляющем большинстве случаев релапаротомным или торакотомным доступом, который уже сам по себе является существенной травмой для пациента.
С внедрением видеоэндоскопической техники появилась возможность проводить обычные операции с минимальной травмой для больного. Видеоэндоскопические операции расширили и усовершенствовали широкий арсенал оперативных методов в желудочной хирургии.
Исследование эффективности торакоскопической ваготомии
В данной статье проанализирован опыт 31 торакоскопической ваготомии (ТВ), накопленный кафедрой хирургии с курсом эндоскопии и эндоскопической хирургии ФУВ РГМУ.
Большинству больных было от 20 до 50 лет (средний возраст 41,5 года), т.е. это были люди в основном работоспособного возраста. Все пациенты до развития ППЯ были оперированы по поводу язвенной болезни двенадцатиперстной кишки. В 23 случаях ППЯ возникла спустя 2 и 3 года после операции.
У 23 больных была произведена резекция по Бильрот-I, у 8 – применены различные модификации операции по Бильрот-II. Реконструктивным операциям в анамнезе подверглись 7 (25,6%) пациентов, две и более реконструктивные операции перенесли 4 (15,9%).
Для планового лечения поступили 24 (77,4%) больных, в экстренном порядке – 7 (22,6%) с признаками желудочно-кишечного кровотечения. У 27 (87,1%) больных имелся болевой синдром, для 16 (51,6%) были характерны ночные боли. Дефицит массы тела имелся у 29 (93,5%), а 4 (13%) пациента поступили в состоянии значительного истощения. У 14 (41,4%) больных в момент поступления имелись осложнения пострезекционной пептической язвы.
Истинной причиной развития пострезекционной пептической язвы является сохранение интенсивной кислотопродукции непрерывного характера после резекции желудка, что может быть обусловлено:
-
ваготонией (повышенный тонус блуждающих нервов),
-
антрум-синдромом (оставленный над привратником антральный отдел с неудаленной слизистой или дистопия антральных клеток в двенадцатиперстную кишку),
-
синдром Золлингера-Эллисона (реже другая эндокринная патология).
Диагностика
Целью обследования было выявление этиологического фактора развития ППЯ.
При внутрижелудочной рН-метрии у всех пациентов отмечалась выраженная гиперацидность культи желудка (pH 0,5-1,7) с непрерывным кислотообразованием и декомпенсацией ощелачивания в области анастомоза и анастомозированной петли кишки.
Раздельное изучение фаз желудочной секреции показало, что из 5 типов желудочной секреции для испытуемых больных были характерны только астенический и возбудимый, т.е. типы с непрерывной гиперпродукцией кислоты.
При изучении гастрина крови у больных были исключены антрум-синдром и синдром Золлингера-Эллисона как возможные этиологические факторы развития заболевания.
Проведение эзогастродуоденоскопии позволило в 100% случаев выявить пептические язвы, а также провести эндоскопическую рН-метрию и хромогастроскопию, на основании чего можно было более точно судить о кислотопродуцирующей функции культи желудка. Этот метод оказался незаменимым в регистрации сопутствующей патологии слизистой оболочки органов желудочно-кишечного тракта. Дополнительным показанием к ваготомии являлся положительный результат эндоскопической медикаментозной блокады кислотопродуцирующей зоны культи желудка.
Рентгенологическое исследование, проведенное у всех больных, не обнаружило пенетрации ППЯ и фистул. При радиоизотопной сцинтиграфии у больных были исключены нарушения моторно-эвакуаторной функции культи желудка, не определявшиеся клинически и рентгенологически. Использование этого метода обследования в послеоперационном периоде подтвердило полноту ваготомии и позволило прогнозировать течение послеоперационного периода. При лазерной допплеровской флоуметрии было достоверно оценено нарушение микроциркуляторных процессов в слизистой верхних отделов желудочно-кишечного тракта, что дало возможность повысить точность диагностики пептического генеза язвы, оценить адекватность ваготомии и прогнозировать результат лечения.
Показанием к ТВ исследователи считали подтвержденный лабораторными методами исследования вагусный генез ППЯ при отсутствии ее осложнений, требующих хирургической коррекции, а также общих противопоказаний к хирургическому вмешательству и к торакоскопии с применением вентиляции одного или двух легких, при частично коллабированном легком и напряженном пневмотораксе, в частности – функциональные признаки.
Методика операции
ТВ выполняли под эндотрахеальным наркозом с раздельной интубацией легких или с вентиляцией обоих легких при частично коллабированном легком в условиях напряженного пневмоторакса из левостороннего доступа. При наркозе использовались мышечные релаксанты. В желудок вводили толстый зонд для освобождения его от воздуха, жидкости и с целью идентификации стенок пищевода при его скелетировании, но чаще прибегали к интраоперационной эрофагогастроскопии фиброволоконным эндоскопом с выполнением приема трансиллюминации.
Самым удобным при операции является положение больного на правом боку, слегка откинувшись на спину, с отведением левой руки, согнутой под углом 110-120° в локтевом суставе. При этом происходит отведение лопатки и перемещение мышечных групп, утончается их слой в зоне введения троакаров.
Доступ к пищеводу слева предпочтителен ввиду особенностей строения правого (заднего) и левого (переднего) блуждающих нервов с учетом большей частоты рассыпного типа строения левого (переднего) блуждающего нерва, а также лучших условий для манипуляции на нем при достижении наддиафрагмальной части нижней трети пищевода слева.
Оперирующий хирург и видеоассистент находятся со стороны спины больного. Операционная сестра и второй ассистент могут находиться как с той, так и с другой стороны. Однако наиболее удобным можно считать расположение второго ассистента со стороны спины больного, а операционной сестры – лицом к нему в ногах. Видеомонитор должен находиться напротив больного перпендикулярно оптической оси, направленной на зону операции, а центр экрана – на уровне глаз оперирующего хирурга. Операции выполняются при горизонтальном положении операционного стола.
Пневмоторакс накладывали с помощью иглы Вереша. При выборе точек для доступа следует придерживаться определенной схемы введения троакаров.
Первый троакар вводится после создания пневмоторакса в восьмом межреберье по средней подмышечной линии. Через него проводится лапароскоп. Второй троакар вводят в восьмом межреберье по передней подмышечной линии, он используется для инструментов (зажима, диссектора, ирригатора). Третий троакар проводится в шестом межреберье по задней подмышечной линии. Он предназначен для введения в полость перечисленных инструментов, а также клипаппликатора, ножниц, би- или монополярного коагулятора. Четвертый троакар вводят в шестом межреберье по средней подмышечной линии, через него осуществляют тракцию легкого посредством ретрактора или другого пригодного для выполнения этой задачи инструмента.
Торакоскопическая ваготомия является видеоэндоскопическим аналогом классической трансторакальной наддиафрагмальной ваготомии, описанной Ь. Dragstedt и Б. Owens в 1943 г..
После создания пневмоторакса, введения троакаров и ревизии органов грудной клетки выполнялись следующие этапы операции:
-
обнажение пищевода;
-
проведение собственно ваготомии;
-
завершение операции.
Поскольку доступ к пищеводу закрыт легким, его смещают ретрактором вверх и кпереди. Отведение легкого затруднено или невозможно при наличии плевральных сращений, которые пересекают путем электроэксцизии. При тракции легкого происходит натяжение легочно-плевральной связки, которую пересекают на протяжении 2-3 см электрокрючком или ножницами. Прямо под этой связкой находится аорта, поэтому здесь необходимо быть особенно внимательным, чтобы не травмировать ее.
В идентификации пищевода помогает введенный в его просвет толстый зонд, или эзофагоскопия с осуществлением трансиллюминации. После определения проекции пищевода лежащую над ним плевру берут зажимом и рассекают вверх и вниз на 4-5 см – так, чтобы нижняя граница разреза соответствовала уровню пищеводного отверстия диафрагмы.
Края плевральных листков захватывают зажимом и подлежащую клетчатку тупо препарируют для обнажения и мобилизации пищевода. Препаровку производят вокруг пищевода и в сторону пищеводного отверстия диафрагмы. Ткани препарируют предельно осторожно. Зонд или эндоскоп удаляют из просвета пищевода для его большей подвижности, при этом уменьшается угроза вскрытия просвета.
Первым должен быть обработан задний блуждающий нерв. Ввиду особенностей распределения свободной жидкости в плевральной полости при положении больного для левосторонней то ракоскопической операции и манипуляциях на нижней трети пищевода она скапливается как раз в зоне нахождения заднего нерва, в углублении между пищеводом и аортой. Поэтому наличие в этой зоне сукровицы или крови, что всегда наблюдается при обработке левого (переднего) блуждающего нерва, резко затрудняет в дальнейшем обнаружение и обработку правого (заднего).
Для выявления заднего нерва пищевод после препаровки отодвигают вперед и вправо и, как правило, без труда обнаруживают его мощный ствол желтоватого цвета. Его захватывают диссектором или крючком, приподнимают и отпрепаровывают вверх и вниз на протяжении 3-4 см тупо или путем электрокоагуляции. Нерв клипируют во избежание кровотечения и иссекают его сегмент длиной 1,5-2 см для гистологического исследования.
Для обработки переднего нерва передний рассеченный листок медиастинальной плевры приподнимают на зажиме и тупо отпрепаровывают вдоль пищевода. Нерв в виде упругого желтоватого ствола находят между плеврой и пищеводом, приподнимают, выделяют вверх и вниз, клипируют и иссекают между клипсами в пределах 1,5-2 см, как и задний. Сегменты нервов иссекают остро, не прибегая к электрокоагуляции.
После обработки основного ствола нерва внимательно осматривают всю полуокружность пищевода. Крупные дополнительные стволы обрабатывают так же, как основные, более мелкие ветви пересекают электрокаутером. Чтобы убедиться в надежности денервации, необходимо обнажить и обследовать минимум 6-сантиметровый отрезок наддиафрагмальной части пищевода. Тщательная ревизия пищевода на протяжении позволяет не только обнаружить дополнительные нервные ветви, но и исключить повреждение стенок пищевода, оценить гемостаз. При соблюдении технических правил операции угроза развития осложнений минимальна.
Завершение операции
Операция заканчивается дренированием плевральной полости. Для введения дренажа удобнее использовать первый троакар, из которого лапароскоп перемещают в третий или четвертый троакар. Второй и четвертый троакары удаляют. Газ эвакуируют раздуванием легкого. Проводят торакоскопический контроль полноты расправления легкого. Удаляют последний троакар, остатки газа аспирируют через дренаж.
Случаев летального исхода в ходе исследования не было.
Послеоперационное наблюдение
Больных переводили в общие палаты из палаты интенсивной терапии после полного восстановления сознания, дыхательной и двигательной функций. Пациенты могли свободно двигаться уже вечером в день операции, на следующий день начинали принимать воду, пищу и активно двигаться. Обезболивание проводили только в первые сутки. Все пациенты с болевым синдромом до операции отмечали его полную редукцию сразу после операции, их беспокоила лишь незначительная болезненность в области послеоперационных троакарных ран. При проведенном всем пациентам на второй день после операции рентгенологическом обследовании грудной клетки наблюдалось полное расправление легкого на стороне вмешательства, признаки пневмо- и гемоторакса отсутствовали.
Состояние всех пациентов на 2-3-и сутки было таким, что их можно было выписывать из стационара под амбулаторное наблюдение, однако мы оставляли их в клинике до 15-го дня, а некоторых до 30 дней и более.
В задачи послеоперационного обследования пациентов входили сравнительная оценка кислотопродукции, моторно-эвакуаторной функции культи желудка, микроциркуляции с исходными данными, а также контроль язвенного процесса с помощью динамической эзогастродуоденоскопии.
К 15-му дню язвенный дефект зажил у 26 (83,8%), в срок до 4 недель – у всех оперированных. В 26 (83,8%) случаях произошла эпителизация дефекта без образования грубого рубца. Кислотопродукция после ТВ снизилась: БПК с 3,6±0,4 до 0,67±0,12 (на 77,16±1,14%), МПК с 10,95±1,11 до 1,57±0,33 (на 71,66±1,66%).
Эвакуаторная функция после операции у 30 больных незначительно снизилась, что не проявлялось клинически. Лишь у одного больного был выявлен парез культи желудка, вызванный грубейшим нарушением диеты, что потребовало лечения и электростимуляции.
Отмечено снижение микроциркуляции в области тела культи с ее улучшением в области анастомотической камеры и отводящем сегменте тощей кишки.
Отдаленные результаты в сроки от 6 мес. до 3 лет после операции изучены у 13 больных путем обследования и у 5 путем анкетирования. Их оценивали по методике А. Ушк. Отличным результат был у 8 пациентов, хорошим – у 4, удовлетворительным – у 5, плохим – у 1 больного. У одного больного спустя 6 мес. после операции при общем относительно удовлетворительном состоянии, отсутствии жалоб и рецидива язвы сохранилась атония культи желудка. Плохой результат был обусловлен неадекватностью ваготомии – произошел рецидив ППЯ на фоне гиперацидности желудочного сока. Детальный анализ видеозаписи операции выявил причину недостаточного подавления кислотопродукции культей желудка:
-
выделение узкого (не более 2 см) сегмента пищевода;
-
резекция только главных стволов без обработки их коммуникантных ветвей на достаточном протяжении.
Диареи и диспепсических расстройств не отмечено ни у одного из обследованных или опрошенных пациентов.
Оценивая результаты, специалисты обратили внимание на широкие оперативные возможности и радикализм ТВ, позволяющие при конкретизации показаний к этой операции добиваться хороших результатов.
К недостаткам операции относится невозможность интраоперационного контроля состояния органов верхнего этажа брюшной полости, что требует тщательнейшего предоперационного обследования больных. Неудачи, связанные с рецидивами, врачи склонны объяснять не техническими возможностями ТВ, а расширением показаний к их применению, недостатком опыта проведения подобных операций и пренебрежением к интраоперационным методам контроля полноты ваготомии. А угроза интраоперационных осложнений кроется в пренебрежении техническими принципами и приемами, необходимыми при выполнении этой операции.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания







Комментарии