Лечение АВСД (атриовентрикулярного септального дефекта)
Медикаментозное лечение дигоксином и диуретиками назначают при сердечной недостаточности. При выраженной регургитации АV-клапана применяют средства для снижения постнагрузки – периферические вазодилататоры. Хирургическое лечение показано всем больным из-за выраженных нарушений кровообращения. В зависимости от тяжести состояния операцию выполняют между 3 и 8 мес. жизни. Ранние операции особенно важны у детей с синдромом Дауна. Операция состоит в закрытии межжелудочкового и межпредсердного сообщений, формировании двух AV-клапанов и бикуспидализации левого AV-клапана.
Показания к хирургическому лечению
Полный АВСД
Из-за риска развития обструктивной болезни легочных сосудов операция должна быть предпринята в пределах первого года жизни. Необходимо рассмотреть вопрос о целесообразности вмешательства в течении первых 3 мес. жизни. Отечественные хирурги, следуя мировым тенденциям, отдают предпочтение первичным ранним операциям, особенно у детей с болезнью Дауна, и не прибегают к суживанию легочной артерии. Если операция отложена на более позднее время, увеличивается недостаточность AV-клапана вследствие дилатации камер сердца и вторичных изменений тканей клапана, в том числе в области расщепления. Несмотря на отсутствие дефицита ткани клапана, трудно достигнуть хорошей коаптации створок. При сопутствующей коарктации аорты тяжелые симптомы появляются в раннем младенчестве.
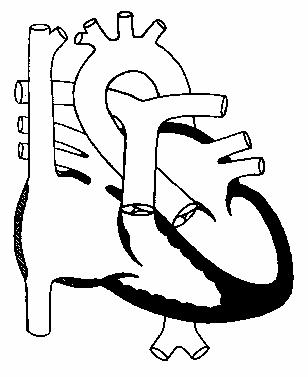
На хирургическую тактику существенное влияние оказывают состояние выводного тракта левого желудочка и его размер. Даже при относительно небольшой степени обструкции выводного тракта левого желудочка осторожное решение об операции Norwood считается предпочтительнее суживания легочной артерии. Если размер желудочка недостаточен для обеспечения системного кровообращения, принимается решение об одножелудочковом типе коррекции гемодинамики. Оценивая адекватность левого желудочка при полном АВСД, следует иметь в виду, что правый желудочек дилатируется больше, чем левый, поэтому размер левого желудочка по отношению к правому не информативен. Необходимо брать в расчет размер желудочка, сопоставленный с нормой.
Если один из желудочков значительно недоразвит, единственным решением является операция типа Fontan. В случаях, когда правый желудочек недоразвит умеренно, возможна бивентрикулярная коррекция с разгрузкой правого желудочка с помощью двунаправленного кавопульмонального анастомоза.
При умеренном недоразвитии левого желудочка бывает трудно сделать выбор между бивентрикулярной и одножелудочковой коррекцией. Считается, что если индекс объема левого желудочка равен или превышает 15 мл/м2, возможна двухжелудочковая коррекция. Однако объем левого желудочка является не единственным критерием выбора типа операции. В пользу гемодинамического паллиатива у новорожденных хирурга склоняют выраженный стеноз или гипоплазия левого АV-клапана и тяжелое сужение выводного тракта левого желудочка. Важным моментом является положение центра общего клапана по отношению к межжелудочковой перегородке, так как хирург должен сориентироваться, как общий АV-клапан следует разделить на левый и правый. Необходимо также оценить длину желудочка. Если левый желудочек не достигает по крайней мере 80% общей длины сердца, это указывает на то, что он не обеспечит системной нагрузки.
Следует заметить, что в литературе мало данных о больных с синдромом Дауна, подвергшихся операции Fontan. Из 533 больных, у которых выполнена операция Fontan в детском госпитале Торонто, только у 4 была трисомия 21. У них имела место несбалансированная форма полного АВСД:
-
у 3 – с гипоплазией правого желудочка;
-
у 1 – с гипоплазией левого желудочка.
Трое больных выжили, один умер от эндокардита. Среднесрочное послеоперационное течение было без осложнений со стороны легочных сосудов.
Частичная и переходная формы АВСД
Операция при неполной форме АВСД не является срочной из-за отсутствия легочной гипертензии. Выбор времени вмешательства определяется двумя факторами. С одной стороны, вторичные прогрессирующие изменения ткани клапана и дилатация желудочков усложняют реконструкцию клапана. С другой стороны, края расщепления сложно сшить, когда ткань створок абсолютно нормальна. Тонкостенные створки легко прорезаются швами, поэтому целесообразно наблюдать за больным в течение младенческого возраста и оперировать к концу первого года жизни, когда створки становятся более прочными. Существенная отсрочка операции может привести к расширению сердца, увеличению регургитации и невозможности адекватной пластики клапана.
Тетрада Фалло с полным АВСД
При сбалансированном легочном и системном кровотоке операцию лучше отложить до конца первого года жизни, учитывая непрочность клапанных структур в младенческом возрасте. При наличии тяжелого цианоза выполняют системно легочный анастомоз в период младенчества с последующей радикальной операцией в 2-4 года, хотя многие хирурги отдают предпочтение первичной полной коррекции.
Больным с несбалансированным типом АВСД и низким давлением в легочной артерии может быть выполнена гемодинамическая коррекция по Fontan в сочетании с операцией Damus-Kaye-Stanel – соединением легочного ствола с восходящей аортой "конец в бок".
Хирургическое лечение
История. Первая успешная коррекция полного АВСД была выполнена у 17-месячной девочки в 1954 г. Lillehei и соавторами с использованием контролированного перекрестного кровообращения. В отдаленном периоде у этой пациентки не было остаточной регургитации и повышения давления в легочной артерии. Впоследствии она родила троих детей. Первые операции при частичном АВСД опубликованы в 1955 г. Успех тех операций тем более поразителен, что в то время хирурги плохо понимали сложную анатомию АВСД. Несмотря на ранний оптимизм, в течение двух десятилетий попытки хирургической коррекции этого сложного порока сопровождались неудовлетворительными результатами, включая операционную летальность, превышающую 25%, остаточные шунты, митральную недостаточность и полную AV-блокаду. Ситуация изменилась после углубленного изучения сложной анатомии порока, проводящей системы, опубликования хирургической классификации. Многочисленные анатомические исследования легли в основу разработки адекватной хирургической техники. В последние десятилетия результаты лечения существенно улучшились, как полагают, за счет более глубокого понимания анатомии, усовершенствования защиты миокарда, операционной техники и улучшения послеоперационного ведения. Среди множества предложенных методик коррекции полной формы АВСД до сегодняшнего дня обсуждаются преимущества использования одной или двух отдельных заплат на ДМЖП и ДМПП.
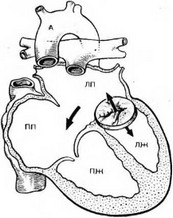
На начальном этапе доминировала методика, предусматривающая использование одной заплаты на оба компонента дефекта – желудочковый и предсердный. И в настоящее время многие хирурги предпочитают эту технику. Использование двух заплат, предложенное Trusler, было поддержано другой группой хирургов, считающих, что эта методика позволяет добиться лучшей функции AV-клапанов. Однако попытки провести сравнительный анализ результатов применения обоих методов не выявили убедительных различий.
В 1978 г. Carpentier предположил, что левый клапан при АВСД следует считать трехстворчатым и что расщепление передней створки митрального клапана не следует ушивать. Однако эта позиция не была поддержана, так как формирование двустворчатого клапана снижает вероятность регургитации.
В 1997 г. Wilcox и соавторы описали технику, возродившую пионерскую методику Lillehei и соавторов, при которой створки AV-клапана фиксируют к гребню межжелудочковой перегородки вместо заплаты для закрытия ДМЖП-компонента. Авторы применяли эту методику селективно, в небольших сериях операций, в зависимости от глубины выемки межжелудочковой перегородки. В 1999 г. Nicholson и Nunn в Сиднее применили подобную методику рутинно для всех случаев полного АВСД, получившую название "австралийская техника".
Таким образом, решающее значение имеют личный опыт хирурга, вне зависимости от его предпочтений, и способность адаптировать технику к конкретной анатомии и другим важным обстоятельствам.
В течение последнего десятилетия летальность в большинстве публикаций варьирует от 3 до 6%. Полная коррекция в младенческом возрасте стала общей тенденцией. Она была впервые применена в 1970-х годах в целях предупреждения послеоперационной легочной гипертензии, снижения частоты возникновения синдрома малого сердечного выброса, значимых остаточных шунтов, полной AV-блокады и обструкции выводного тракта левого желудочка. К сожалению, отсутствует положительная динамика частоты развития послеоперационной недостаточности митрального клапана. Необходимость в повторных операциях по поводу выраженной митральной недостаточности возникает с частотой от 5 до 15%, вне зависимости от того, использованы ли одна или две заплаты. Повторные вмешательства в большинстве случаев успешны и состоят из наложения дополнительных швов на расщепленную створку митрального клапана и анулопластики. При тяжелых деформациях нативного клапана прибегают к протезированию.
Crawford и Stroud считают, что защита миокарда при длительной окклюзии аорты может быть улучшена путем ретроградного введения кардиоплегического раствора, что позволяет избежать попадания воздуха в коронарные артерии при многократных введениях раствора в корень аорты. Кроме того, полезно проводить гидродинамические пробы компетентности клапана сильно охлажденными жидкостями, вводимыми в полости желудочков.
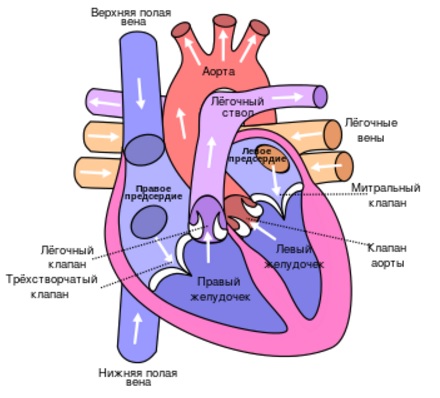
Анестезиологическое обеспечение
Значительную часть контингента пациентов с АВСД составляют больные с трисомией 21. Проведение анестезиологического пособия у этих пациентов имеет свои особенности. Венозный и артериальный доступы у них затруднены из-за меньшего размера сосудов и более толстого слоя подкожной жировой клетчатки. Типичный для синдрома Дауна большой язык может способствовать обструкции дыхательных путей, однако это в большей мере относится к старшим детям, чем к младенцам. По этой причине, а также из-за короткой шеи интубация трахеи может быть затруднена.
Введение в наркоз не должно сопровождаться снижением сопротивления легочных сосудов, так как это приводит к увеличению шунтирования крови слева направо и снижению системной перфузии.
В целях повышения ЛСС и снижения отношения Qл/Qс анестезиолог должен манипулировать вентиляционными параметрами для достижения умеренной гиперкапнии и рН 7,30-7,35. Такой же эффект оказывает снижение содержания кислорода в дыхательной смеси. При этом может снизиться сатурация артериальной крови, несмотря на отсутствие шунта крови справа налево.
Гипотензия в предперфузионном периоде чаще всего является результатом большого сброса крови слева направо. Если манипуляции вентиляцией, направленные на увеличение ЛСС, не эффективны для коррекции гипотензии, необходимо применить инотропные средства. Инфузия жидкостей не приводит к коррекции гипотензии, так как резерв преднагрузки у этих больных уже исчерпан.
После завершения искусственного кровообращения проводят чреспищеводную или эпикардиальную ЭхоКГ и катетеризацию правого и левого предсердий. Поскольку предсердия при АВСД имеют небольшие размеры и малорастяжимы, высота К-волны давления хорошо коррелирует с выраженностью недостаточности клапанов. Важно заметить, что объем регургитации зависит от артериального давления: чем оно выше, тем больше обратный ток. Объемная перегрузка и увеличение постнагрузки могут привести к дилатации желудочков и увеличению регургитации. В этой ситуации показана комбинация инотропной поддержки с системной вазодилатацией.
Хирургическая техника
Частичный АВСД
После исследования структуры клапана проводят гидропробу: в полость левого желудочка вводят охлажденный физиологический раствор через тонкую трубку на канюле шприца. Проба позволяет определить место, степень регургитации и состояние краев расщепленных створок. Края расщепленной створки ушивают 6/0 проленом отдельными узловыми швами до свободного края передней створки. Первый шов мы накладываем у основания расщепления вблизи кольца клапана, второй – с противоположной стороны расщепления, где прикрепляются хорды. Последующие швы накладываем между ними. Это позволяет точно совместить края створок. При истонченных створках можно использовать матрацные швы 7/0 проленом с прокладками из перикарда. Для проверки компетентности клапана проводят повторную гидропробу.

При дилатированном клапанном кольце в центре сомкнувшихся створок может оставаться струя. В этом случае следует уменьшить диаметр кольца клапана путем анулопластики в области одной, предпочтительно латеральной, или двух комиссур. Латеральная комиссура находится вдали от проводящей системы, однако существует риск повреждения огибающей коронарной артерии при глубоких вколах. Используют матрацные швы с прокладками. При необходимости можно дополнительно наложить третий шов посередине между двумя комиссурами. Эффективность анулопластики проверяют окончательной гидропробой.
Дефект межпредсердной перегородки закрывают аутоперикардом. Заплату фиксируют непрерывным 6/0-5/0 проленовым швом, начиная от центра контакта митрального и трехстворчатого клапанов. Стежки в области контакта обоих АV-клапанов следует накладывать поверхностно во избежание повреждения подлежащего пучка Гиса. Хирург принимает решение, в какое предсердие будет дренироваться коронарный синус.
Предпочтительно оставлять коронарный синус в правом предсердии, фиксируя заплату к основанию передней створки митрального клапана параллельными швами. Желательно избегать проведения швов по мышечной ткани. Когда линия фиксации заплаты минует коронарный синус, по заднему краю дефекта нужно перейти на обвивной шов, завершая его в наивысшей точке. Эта методика, сохраняя естественный дренаж коронарного синуса в правое предсердие, абсолютно безопасна с точки зрения возможности возникновения АV-блокады и нарушения функции митрального клапана.
Альтернативный способ состоит в использовании заплаты больших размеров, чтобы покрыть область проводящих путей, двигаясь книзу и затем кзади и вверх в непосредственной близости к коронарному синусу.
Многие хирурги отводят коронарный синус в левое предсердие. Линию шва ведут книзу и кзади вокруг коронарного синуса. Заплата должна быть свободной в этой области, чтобы она не прижимала коронарный синус.
Перед завязыванием шва левое предсердие заполняем кровью или солевым раствором. При пережатой аорте удаляем воздух через отверстие для кардиоплегии в аорте. После ушивания предсердия эвакуируем воздух из правого желудочка с помощью иглы с боковыми отверстиями.
Переходной АВСД
Если ДМЖП-компонент располагается на уровне расщепления, его закрывают одним горизонтальным матрацным швом с прокладками, одновременно захватывая края расщепления над гребнем перегородки. Этот же шов обычно используется для фиксации заплаты к краям дефекта.
Один из вариантов переходной формы АВСД характеризуется рестриктивным ДМЖП-компонентом, расположенным под верхней и нижней общими створками. Небольшие размеры дефекта объясняются наличием множества коротких хорд, фиксирующих свободный край створок к гребню межжелудочковой перегородки. Для коррекции этого типа АВСД применяют австралийскую технику, предусматривающую фиксацию створок непосредственно к межжелудочковой перегородке.
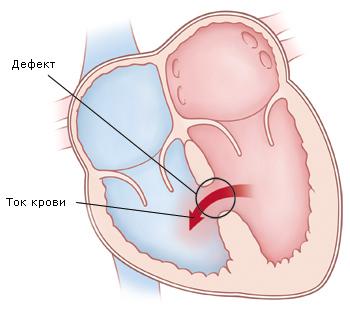
Полный АВСД
Австралийская техника
Австралийская техника существенно проще, чем традиционная коррекция полной формы АВСД. Такой тип операции стандартно применяется при переходной форме, когда глубина выемки в межжелудочковой перегородке невелика. Эффективность этой техники при большом поперечном размере дефекта стала неожиданностью, тем не менее, уже накоплен достаточно большой опыт её применения. При этой технике необходимость рассечения створок отпадает.
Хирурги, исповедующие идею ранних операций, предпочитают выполнять коррекцию в условиях гипотермической остановки кровообращения, так как венозные канюли деформируют AV-клапан, нарушая его нативную анатомию. Используют единственную венозную канюлю. При температуре 18 0С в прямой кишке аорту пережимают, вводят кардиоплегический раствор в корень аорты. Венозную канюлю удаляют. После открытия полости предсердия исследуют анатомию клапана при заполненном кардиоплегическим раствором или ледяным физраствором левом желудочке. Верхнюю и нижнюю общие створки очень аккуратно сближают над гребнем межжелудочковой перегородки с помощью 6/0 проленового шва, который не завязывают. Накладывают несколько отдельных горизонтальных матрацных швов на гребень межжелудочковой перегородки и затем проводят их через верхнюю и нижнюю общие створки. Удобно использовать иглы большей длины, чем при стандартном закрытии ДМЖП. Далее швы проводят через край аутоперикарда, обработанного глютаральдегидом. Когда швы завязывают, перикардиальная заплата прижимает створки клапана к межжелудочковой перегородке, ликвидируя ДМЖП-компонент общего дефекта.
Желательно, чтобы матрацные швы на гребне межжелудочковой перегородки имели больший шаг, чем на перикарде. Таким образом, заплата создает эффект анулопластики. В оригинальном описании Nicholson и соавторы рекомендуют использовать для этой цели короткую полоску из дакрона. Перикардиальную заплату без натяжения подтягивают кпереди, чтобы выполнить гидропробу для оценки компетентности клапана. Ушивают расщепление, точно сопоставляя его края. При необходимости производят дополнительную комиссуропластику.
Межпредсердный компонент полного канала закрывают, как при изолированном первичном ДМЖП. Устье коронарного синуса оставляют слева от заплаты. Перед завершением непрерывного шва на межпредсердном дефекте возобновляют искусственное кровообращение с объемной скоростью 10-20 мл/кг/мин с венозным возвратом через отсос. После ушивания разреза предсердия вводят венозную канюлю и восстанавливают полную перфузию. После удаления воздуха из камер сердца снимают зажим с аорты. Кардиоплегическое отверстие в аорте оставляют открытым для выхождения остатков воздуха. Учитывая вероятность остаточной регургитации на митральном клапане и недостаточность размеров левого желудочка, во время согревания катетеризируют левое предсердие через правую верхнюю легочную вену для мониторирования давления. Катетер для мониторирования давления в легочной артерии проводят через инфундибулум правого желудочка. Подшивают два предсердных и один желудочковый электроды. Останавливают искусственное кровообращение при малой дозе допамина – 5 мкг/кг/мин.
У детей малой массы обычно не исследуют адекватность коррекции с помощью чреспищеводной ЭхоКГ. В пользу удовлетворительной компетентности митрального клапана свидетельствует нормальное давление в левом предсердии и отсутствие высокой волны V. Давление в легочной артерии может варьировать в течение раннего послеоперационного периода. Наличие остаточного лево-правого шунта оценивают по разнице насыщения в правом предсердии и легочной артерии и с помощью ЭхоКГ-исследования.
Традиционная техника с использованием одной или двух заплат
Хорды мостовых створок могут крепиться к гребню межжелудочковой перегородки и в полости своего или противоположного желудочков. Анатомия створок клапана также варьирует по количеству, расположению и степени развития комиссур. Положение заплаты не должно зависеть от морфологии створок и подклапанного аппарата, поэтому может потребоваться пересечение некоторых мостовых хорд и рассечение створок для правильной фиксации заплаты. При проведении гидропробы смыкающиеся створки клапана позволяют определить точку наложения маркировочного шва для идентификации места создания основания "расщепления" левого АV-клапана над гребнем межжелудочковой перегородки или несколько кпереди. Хирург должен оставить достаточно ткани для формирования передней створки будущего митрального клапана. Маркировочный шов принципиально важен, так как он определяет точку разделения общего АV-клапана на левый и правый, а также положение расщепления относительно центра межжелудочковой перегородки. Шов накладывают 6/0 проленом и на этом этапе не завязывают, используя его для сближения верхней и нижней створок.
На этом "исследовательском" этапе операции точно измеряют ширину канала между двумя точками на противоположных сторонах клапанного кольца, где гребень перегородки достигает места крепления основания створок. Этот размер определяет ширину желудочковой части заплаты, которая должна точно ей соответствовать. Если заплата окажется избыточной, она увеличит размер клапанного кольца и станет причиной относительного дефицита площади створок и ухудшения систолического смыкания. Если же имеется исходный дефицит тканей клапана, ширину заплаты можно уменьшить, таким образом, получая эффект анулопластики за счет переднего полукольца. Однако если заплата будет фиксирована с натяжением, возможен её отрыв от нежных тканей перегородки. Следует также оценить расположение комиссур клапана относительно гребня межжелудочковой перегородки. Если верхняя и нижняя комиссуры лежат в одной плоскости с перегородкой, отсутствует необходимость рассечения створок. В случаях, когда створка удерживается хордами, крепящимися к гребню перегородки, ее необходимо рассечь до кольца по линии, параллельной подлежащему гребню. Верхнюю и нижнюю общие створки рассекают чуть правее проекции гребня межжелудочковой перегородки.
После рассечения общих створок исследуют гребень межжелудочковой перегородки. Если имеются адекватные условия для пришивания заплаты, мостовые хорды сохраняют. В случае, когда мостовые хорды затрудняют доступ к правой стороне межжелудочковой перегородки, часть из них пересекают. Последующая фиксация пересеченных створок к заплате компенсирует потерю части, поддерживающей створки хорд. При этом следует помнить, что каждая пересеченная хорда снижает прочность фиксации створки.
Исследуют анатомию подклапанного аппарата левого желудочка, обращают внимание на наличие единственной или двух близко расположенных папиллярных мышц. Сначала закрывают заплатой из аутоперикарда, обработанного глютаровым альдегидом, межжелудочковый компонент дефекта, фиксируя её непрерывным швом к правой стороне перегородки. Шов начинают от середины дефекта на уровне маркировочного шва и продолжают его вдоль гребня перегородки вверх и вниз до клапанного кольца. Линия шва не должна смещаться далеко от края перегородки, так как это может ухудшить смыкание створок. Только в нижнем конце межжелудочковой перегородки линию шва следует сместить в правую сторону, чтобы избежать вовлечения в шов пучка Гиса. Последний входит в межжелудочковую перегородку вблизи от АV-узла и может быть поврежден, особенно в нижнем конце шва, проходящего по межжелудочковой перегородке. Концы нити не завязывают и оставляют под небольшим натяжением, пока створки не будут подвешены к заплате. Линию непрерывного шва рекомендуют укрепить отдельными матрацными швами с прокладками. Если створки не пересекались, заплату вклинивают в естественные комиссуры. Края створок по обе стороны от заплаты подвешивают к ней непрерывным матрацным горизонтальным проленовым швом 6/0 и укрепляют отдельными матрацными швами с прокладками со стороны митрального клапана. Прокладки не должны вовлекать значительную часть ткани митрального клапана, что может ухудшить центральное смыкание. Если мостовые створки были рассечены, заплату располагают в разрезе и створки таким же способом фиксируют к ней на соответствующем уровне. Это важно для обеспечения компетентности клапана.
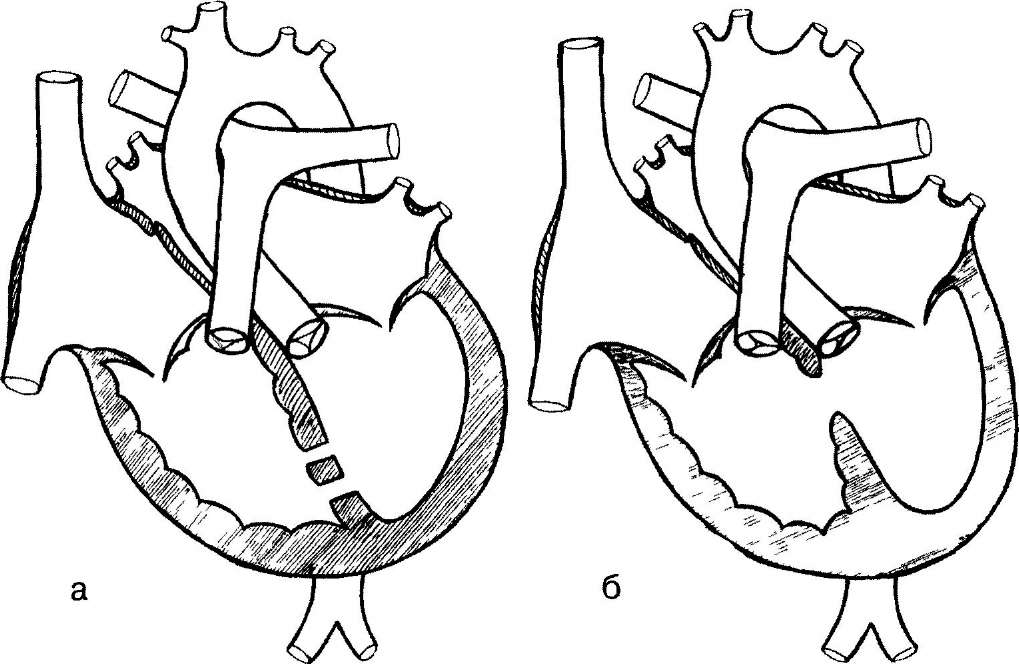
Расщепление, образовавшееся при реконструкции клапана, ушивают описанным выше способом. При наличии единственной или двух тесно расположенных папиллярных мышц левого желудочка следует оценить возможность возникновения митрального стеноза после ушивания расщепления.
Межпредсердный компонент дефекта закрывают перикардиальной заплатой, пришивая её концами нити, ранее использованной для фиксации заплаты к межжелудочковой перегородке. Коронарный синус оставляют слева от заплаты.
Отечественные специалисты, предпочитают использование двух заплат – синтетической на межжелудочковый и перикардиальной на межпредсердный компонент АВСД. Межжелудочковую заплату часто можно пришить без рассечения общих створок, сохраняя нативную анатомическую конфигурацию створок и поддерживающего аппарата. Перикардиальная заплата на межпредсердном дефекте не создает угрозы гемолиза.
После пластики ДМЖП межпредсердный компонент закрывают перикардиальной заплатой, как
при первичном дефекте, оставляя коронарный синус в левом предсердии. Перед этим проверяют компетентность клапана и при необходимости накладывают дополнительные швы на расщепление или выполняют анулопластику в зависимости от места регургитации.
Недостаточность клапана может быть обусловлена редко встречающимся дефицитом ткани створок. Между выраженностью исходной недостаточности клапана и остаточной регургитацией связи нет. В большинстве случаев регургитация на митральном клапане после коррекции отмечается у больных с исходно компетентным общим клапаном. Она обычно обусловлена чрезмерным или недостаточным смещением заплаты в сторону правого желудочка и избыточной шириной заплаты.
При истинном дефиците ткани клапана единственным выбором является имплантация клапанного протеза.

Сопутствующие пороки
Обструкция выводного тракта левого желудочка
Операция при субаортальном стенозе должна включать устранение всех анатомических элементов сужения. Дискретные субаортальные мембраны и наросты ткани эндокардиальных подушечек можно легко резецировать. Более сложную проблему представляют функционально важные клапанные структуры и туннелеподобный стеноз. Фундаментальным механизмом образования обструкции является смещение верхнего компонента септальной створки в сторону тракта оттока левого желудочка. В связи сэтим основным принципом коррекции является конверсия частичного АВСД в полный на уровне передней части канала путем устранения вогнутости межжелудочковой перегородки за счет восполнения дефицита перегородки подклапанной заплатой из перикарда или дакрона. Эта заплата поднимает передний сегмент митрального клапана и расширяет субаортальное пространство. Передневерхнюю половину расщепленной митральной створки отсекают от гребня межжелудочковой перегородки, оставляя интактным трехстворчатый клапан. Треугольную заплату из аутоперикарда, обработанного глютаровым альдегидом, пришивают к перегородке. Затем свободный край отсеченной створки пришивают к заплате 6/0 нитью. Ушивают расщепление. Первичный дефект закрывают общепринятым способом.
Тот же прием может быть применен при типе А полного АВСД с короткими хордами. Хорды, крепящие митральную створку к гребню перегородки, пересекают. Створку прикрепляют к перегородке с помощью заплаты на более высоком уровне. Хотя данная техника была описана Lappen и соавторами в 1983 г. и Deleon и соавторами в 1991 г., она не завоевала популярности из-за неудовлетворительных результатов. В 1994 г. был опубликован случай успешной реализации этой идеи с отличным отдаленным результатом. Авторы обращают внимание на коварную природу субаортального стеноза при первичном ДМПП и АВСД типа А, который может не привлечь внимания из-за присущей пороку доброкачественной деформации в виде гусиной шеи. До операции наличие градиента давления может быть не диагностированным из-за малого выброса в системный круг, обусловленного большим лево-правым сбросом. Этим можно объяснить, почему субаортальный стеноз иногда обнаруживается после коррекции порока.
Если субаортальный стеноз заподозрен, во время операции должны быть тщательно обследованы гребень межжелудочковой перегородки, характер прикрепления митрального клапана и субаортальное пространство и определены показания для процедуры освобождения митрального клапана. Эта агрессивная тактика может предупредить реоперации, которые значительно более сложны.
Альтернативой методу перемещения митрального клапана является аортовентрикулопластика с сохранением аортального клапана, если возможно. При её выполнении отсутствует риск повреждения проводящей системы. В самых тяжелых случаях остается рассмотреть вопрос об одножелудочковой коррекции – в качестве первого этапа операции Damus-Kaye-Stansel с системно-легочным анастомозом или с имплантацией сосудистого протеза между правым желудочком и легочной артерией.
Дополнительное отверстие в левом AV-клaпaне
Данная аномалия встречается в различных вариантах. Отверстие может быть небольшим и не значимым с гемодинамической точки зрения, поэтому не требует коррекции. Более значительное дополнительное отверстие может быть связано с той же папиллярной мышцей, что и основное АV- отверстие, создавая эффект парашюта первичного отверстия. Мостик тканей между двумя отверстиями нельзя пересекать, так как это лишит часть створок поддерживающего аппарата и вызовет регургитацию. Если единственная папиллярная мышца поддерживает створки первичного отверстия, полное ушивание расщепления может вызвать стеноз клапана.
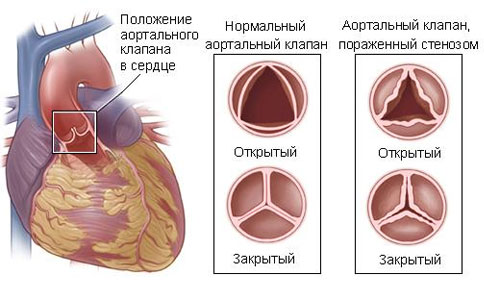
Тетрада Фалло с полным АВСД
При коррекции данного сочетания форма единственной перикардиальной заплаты должна быть несколько модифицирована. Передневерхнюю часть заплаты увеличивают соответственно распространению межжелудочкового дефекта кпереди до конусной перегородки. Первичный дефект может быть небольшим, что затрудняет экспозицию левой стороны АV-клапана. В этих случаях целесообразно рассечь межпредсердную перегородку кзади для улучшения экспозиции левосторонних структур.
Желудочковую часть заплаты формируют таким образом, чтобы был обеспечен свободный отток крови из левого желудочка в аорту. Чаще встречается АВСД типа А, когда верхняя створка прикреплена к гребню перегородки мостовыми хордами. Створка должна быть рассечена на трикуспидальной стороне из-за смещения кпереди конусной перегородки. Этот приём позволяет исключить обструкцию выхода из левого желудочка после фиксации заплаты. Край дефекта у конусной перегородки труднодостижим со стороны правого предсердия. Эту часть шва удобнее наложить через разрез правого желудочка. Нижний край межжелудочкового сообщения бывает тесно связанным с нижней створкой АV-клапана, поэтому в этой части швы следует накладывать поверхностно. Реконструкцию выводного тракта правого желудочка производят так же, как при изолированной тетраде Фалло. Однако следует максимально стремиться к сохранению функции клапана легочной артерии, так как трехстворчатый клапан при АВСД патологически изменен. В связи с этим недостаточность клапана легочной артерии не так хорошо переносится, как при изолированной тетраде Фалло. Это относится и к остаточному сужению выводного тракта правого желудочка. Хирург должен оценить необходимость имплантации клапанного кондуита.
Транспозиция магистральных артерий
Хирургическое лечение ТМА, изредка сочетающейся со сбалансированным АВСД, производится так же, как при изолированной ТМА. Если имеются анатомические условия, применяется операция артериального переключения с одновременной коррекцией АВСД.
Отхождение магистральных сосудов от правого желудочка
При сочетании ДВПЖ со сбалансированным АВСД принятие технических решений зависит от анатомической формы ДВПЖ. Следует отметить, что в большинстве случаев ДВПЖ и ТМА сочетаются с несбалансированным АV-каналом. Отхождение магистральных сосудов от правого желудочка с подаортальным ДМЖП корригируют так же, как и тетраду Фалло. Если же диагностирован транспозиционный тип ДВПЖ, выполняют операцию артериального переключения. При промежуточной форме ДВПЖ хирургическую методику выбирают индивидуально. Еще на дооперационном этапе в ходе детального обследования и во время вмешательства оценивают возможность создания свободного выхода из левого желудочка в аорту после реконструкции АВСД. Если это достижимо, выполняют двухжелудочковую операцию в одном из возможных вариантов:
-
техника, аналогичная таковой при тетраде Фалло, отличающаяся лишь особой конфигурацией заплаты для обеспечения беспрепятственного пути оттока из левого желудочка в аорту;
-
артериальное переключение с отведением заплатой устья легочной артерии в левый желудочек;
-
анастомоз легочного ствола с восходящей аортой с отведением устья легочной артерии или обоих полулунных клапанов в левый желудочек и имплантацией клапанного кондуита между правым желудочком и дистальным концом пересеченного легочного ствола.
В случаях, когда межжелудочковое сообщение не связано с обоими полулунными клапанами или когда оттоку препятствуют важные хорды, операция Fontan становится единственно возможным выбором.
Внутриоперационная ЭхоКГ
Внутриоперационная ЭхоКГ особенно полезна для оценки качества реконструкции АВСД – наличия и выраженности обратного тока на АV-клапанах и остаточного шунта крови. У детей первых месяцев жизни используют стерильный эпикардиальный датчик для допплер-ЭхоКГ, у детей более старшего возраста применяют чреспищеводное исследование. Как показывает опыт различных авторов, в 11-31% случаев после внутриоперационного исследования принимаются решения о дополнительной коррекции остаточной патологии до завершения операции. Это позволяет предупредить развитие послеоперационной сердечной недостаточности и повторные вмешательства.
Результаты хирургического лечения
Суживание легочной артерии
В связи с улучшением результатов первичной коррекции порока большинство хирургов отказались от суживания легочной артерии из-за высокой операционной летальности и возникающей в 40-60% случаев необходимости реконструкции легочной артерии во время окончательной операции. В настоящее время суживание легочной артерии применяется у пациентов высокого риска с легочной гипертензией, хотя суммарная летальность колеблется, по разным данным, от 11 до 60%.
Первичный ДМПП
Согласно сводным данным из различных центров, охватывающим 612 детей с частичной формой АВСД, хирургическая летальность составила 2,6%. Из них 112 пациентов были младенческого возраста. Летальность в этой подгруппе составила 8,9%, в возрасте старше 1 года она равнялась 1,2%. Летальность не зависела от наличия синдрома Дауна. Семь из 16 смертей произошли у младенцев, масса которых не превышала 5 кг. Летальность среди детей годовалого возраста зависела от хирургической эры: в 1984-1988 гг. она составляла 2,2%, в 1989-1993 гг. снизилась до 0,5%. Такая же динамика отмечается и в других центрах, не охваченных приведенной статистикой. Однако эта положительная тенденция не касается детей до 1 года с комплексной патологией левых отделов сердца, коарктацией аорты, гипоплазией левых отделов сердца, в том числе с малым диаметром митрального клапана, сужением выводного тракта левого желудочка.
Отдаленные результаты 334 операций, выполненных в клинике Mayo за 40 лет – с 1955 по 1995 гг. – представлена El-Najdawi. Средний возраст пациентов был 8 лет. В раннем периоде умерли 10 больных и в отдаленном периоде – 31. Выживаемость в течение 30 дней, 5, 10, 20 и 40 лет составила 98, 94, 93, 87 и 76% соответственно. У 38 пациентов потребовались реоперации по поводу регургитации или стеноза. У 36 больных было обнаружено сужение выводного тракта левого желудочка: у 32 из них после первичной операции и у 4 – после повторной. Повторным операциям подвергнуты 10 пациентов, 7 из них перенесли реконструкцию выводного тракта левого желудочка. Она заключалась в резекции субаортальной мембраны и перегородочной миотомии. Одному больному выполнена модифицированная операция Коnnо для устранения обструкции выводного тракта левого желудочка. У 14% больных имели место суправентрикулярная аритмия, включая трепетание, фибрилляция предсердий, пароксизмальная суправентрикулярная тахикардия. Показательно, что частота суправентрикулярных аритмий у оперированных пациентов на 1, 2, 3, 4 и 5-й декаде жизни составляла 9, 16, 20, 26 и 47% соответственно. Частота аритмий была ниже в группе больных, у которых ушивали расщепление клапана. Полная AV-блокада возникла у 2,7% больных. У 2% пациентов отдаленный период осложнился бактериальным эндокардитом.
Специфическим для АВСД осложнением является гемолитическая анемия. Она встречается в 1-2% случаев после коррекции как частичной, так и полной формы порока. Деструкция эритроцитов происходит вследствие удара струи регургитации на митральном клапане в синтетическую заплату в предсердии. Гораздо реже этот синдром наблюдается при отсутствии синтетического материала. При невыраженном гемолизе может произойти спонтанное улучшение после эндотелизации синтетической заплаты.
Редким ятрогенным осложнением после коррекции первичного ДМПП является возникновение недостаточности аортального клапана вследствие перфорации некоронарной створки аортального клапана.
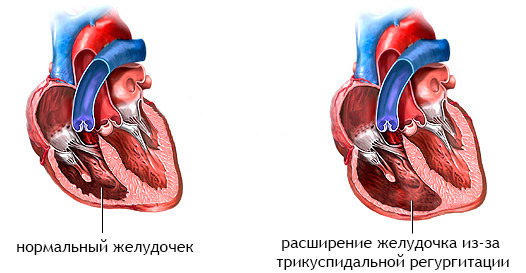
Полный АВСД
Традиционная коррекция полного АВСД
Ранние вмешательства при полной форме АВСД стали производить в 1970-1980-х годах. Постепенное улучшение результатов позволило выполнять успешные операции у очень маленьких детей массой менее 2,5 кг. Эти достижения стали возможными частично за счет накопления знаний о специфических факторах риска у больных с АВСД, таких, как:
-
гипоплазия желудочков;
-
сужение выводного тракта левого желудочка;
-
двойное отверстие левого АУ-канала;
-
парашютообразная деформация АУ-клапана;
-
сочетание с другими ВПС.
Эволюция хирургического лечения – от двухэтапного до первичной полной коррекции в раннем младенчестве – сопровождалась использованием ЭхоКГ в пред-, интра- и послеоперационном периоде.
По сводным данным, охватывающим 768 пациентов с полной формой АВСД, оперированных с 1984 по 1993 гг., общая летальность составила 13,9%, в том числе среди детей младенческого возраста — 16,6%. У 75% детей был синдром Дауна. У младенцев без синдрома Дауна, оперированных в течение первых 3 мес. жизни, отмечена более высокая госпитальная летальность, чем у детей с синдромом Дауна. Современные публикации приводят более низкие показатели летальности – 3,6-9%. Десятилетняя выживаемость, включая госпитальную летальность, составляет, по данным Ваийо и соавторов, 91,3%.
Отечественные хирурги закрыли расщепление митрального клапана у 93% больных. Как и большинство хирургов, они подчеркивают необходимость ушивания расщепления, за исключением случаев, когда это может привести к стенозированию митрального клапана. Многие хирурги отмечают, что выраженность недостаточности клапана не является фактором риска летальности и остаточной регургитации. Тем не менее, она еще недавно являлась причиной реопераций у 15-18% больных. В настоящее время частота повторных операций снизилась до 4-7%. Обычно после операции сохраняется небольшая степень недостаточности клапана, однако в 40% случаев она прогрессирует в течение 1-2 лет. В дальнейшем это ухудшение, как правило, приостанавливается.
Особенно сложной проблемой до- и послеоперационного периода является сужение выводного тракта левого желудочка, которое наблюдается при всех формах АВСД.
К сожалению, хирургическое решение этой проблемы сложное и паллиативное. Стандартная фибромиэктомия не исключает необходимости повторных вмешательств. Оптимистический метод коррекции описан выше.
Австралийский метод коррекции
Группа австралийских хирургов, использовавших методику, ранее описанную Wilcox и соавторами, представила сведения о 47 последовательных пациентах, оперированных в 1995-1999 гг. Умерли 2 больных. Ни у одного из пациентов не возникли полная AV-блокада или значимый остаточный дефект, и, что наиболее важно, ни в одном случае не развилось сужение выводного тракта левого желудочка в раннем и отдаленном послеоперационном периоде. У 28% больных митральная регургитация отсутствовала, у 40% она была минимальной, у 26% – небольшой и у 6% – умеренной. Авторы обращают внимание на использование ими дакроновой полоски для уменьшения размера кольца на уровне межжелудочковой перегородки. Целесообразность этого приема требует проверки временем, не будет ли он ограничивать рост клапанного кольца.
Детский госпиталь Бостона недавно представил опыт использования этой техники у 34 последовательных больных с полным АВСД, оперированных в период между 1997 и 2002 гг.. Средний возраст детей составил 3 года, средняя масса тела – 5,6 кг. У 5 пациентов была единственная папиллярная мышца. Дефект межжелудочковой перегородки у 6 больных был небольшим, у 9 – средних размеров и у 19 – крупным. Расщепление митрального клапана было ушито у 31 из 34 пациентов. У одного больного во время операции осталась умеренная регургитация, потребовавшая конверсии данного типа коррекции в классический метод с одной заплатой. Летальных исходов не было. Ни у одного из оперированных не развилось сужение выводного тракта левого желудочка и не возникла необходимость в реоперации из-за регургитации. Эхокардиография в раннем и отдаленном периодах не обнаружила ни одного больного с выраженной недостаточностью клапана.
Отечественные хирурги пришли к выводу, что модифицированная техника с использованием одной заплаты сохраняет целостность створок АV-клапана без стенозирования выводного тракта левого желудочка и ухудшения качества коррекции клапана даже при большом ДМЖП и несбалансированном АВСД с единственной папиллярной мышцей. Одним из важнейших преимуществ этой техники является то, что она может быть применена даже в неонатальном периоде, поскольку нет необходимости ушивать нежные створки, за исключением закрытия расщепления. Последнее требует чрезвычайно деликатного наложения узловатых швов, так как у новорожденного края створок могут быть особенно непрочными.
Стоит подчеркнуть, что австралийская техника позволяет сократить время перфузии и окклюзии аорты. Отдаленные результаты эквивалентны тем, которые получены при стандартной коррекции.
Полная форма АВСД с тетрадой Фалло
Хирургическая тактика в прошлом предусматривала этапное лечение: вначале – наложение системно-легочного анастомоза, затем – полная коррекция. В настоящее время предпочтения сместились в сторону первичной радикальной коррекции. Высокая летальность, предшествующая современному подходу, в настоящее время снизилась. Коррекция порока включает, как правило, реконструкцию выводного тракта правого желудочка. Суммарная летальность при этапном лечении оказалась выше, чем при первичной полной коррекции. В 35% случаев потребовалось повторное вмешательство. Интересно, что при одноэтапном лечении необходимость в реоперациях возникала значительно реже. Через 10 лет 93% пациентов после первичной полной коррекции были живы и 82% – перенесли этапное лечение. Преимущества агрессивной тактики продемонстрировали большинство хирургов, имеющих опыт лечения этого сочетания.
Кратко подводя итоги, перечислим возможные осложнения отдаленного периода после коррекции АВСД:
-
недостаточность митрального клапана;
-
гемолиз;
-
стеноз митрального клапана;
-
сужение выводного тракта левого желудочка;
-
позднее возникновение AV-блокады;
-
остаточная легочная гипертензия;
-
недостаточность трехстворчатого клапана;
-
недостаточность аортального клапана;
-
предсердные и желудочковые аритмии;
-
естественное течение синдрома Дауна;
-
хроническая обструкция верхних дыхательных путей;
-
предрасположенность к инфекциям.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии