Стеноз аортального клапана: лечение, операция
Деформированный аортальный клапан является потенциальным местом бактериальной инфекции, поэтому необходимо уделять постоянное внимание профилактике инфекции вне зависимости от тяжести сужения. Рекомендуется ограничение тяжелой физической активности у пациентов с выраженным стенозом, а также участия в спортивных соревнованиях даже при небольшой степени стеноза.
Пациентам с симптомами сниженных резервов сердца и гипертрофией левого желудочка даже при отсутствии сердечной недостаточности показано лечение дигоксином.
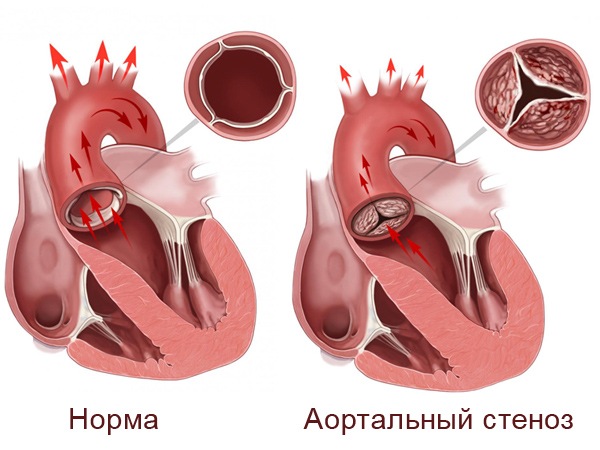
История хирургического лечения
В 1910 г. Carrel для создания тока крови в обход сужения аорты в эксперименте наложил анастомоз между верхушкой левого желудочка и аортой. В 1912 г. Tuffier впервые произвел успешную пальцевую дилатацию аортального клапана путем инвагинации стенки аорты у молодого мужчины с аортальным стенозом. Спустя 40 лет, в 1953 г. Larzelere и Bailey выполнили закрытую аортальную комиссуротомию, а в 1955 г. Marquis и Logan устранили стеноз аортального клапана доступом через верхушку левого желудочка, используя расширитель Bakes. Один из вариантов аналогичной операции предложен в 1985 г. Brown, но вместо расширителя был использован катетер Gruntzig.
В 1956 г. Lewis, Swann и соавторы для устранения аортального стеноза применили временное пережатие артериальных и венозных сосудов. После периода гипервентиляции отключали механическую вентиляцию, затягивали турникеты на полых венах и выполняли вальвулотомию под контролем зрения в относительно сухом операционном поле.
В 1956 г. Lillehei впервые выполнил аортальную вальвулотомию в условиях искусственного кровообращения.
В 1960 г. Coran и Bernhard из детского госпиталя в Бостоне впервые устранили критический аортальный стеноз у детей в периоде новорожденности и в грудном возрасте. Развитие искусственного кровообращения и усовершенствование защиты миокарда позволили выполнять аортальную вальвулотомию в удобных условиях открытого сухого сердца.
Успешное замещение аортального клапана механическим протезом впервые было выполнено Harken в Бостоне в 1960 г.. Ross в 1962 г. в Лондоне и Barratt-Boyes в Новой Зеландии описали имплантацию аортального аллографта. Позднее Ross внедрил аутотрансплантацию легочного клапана. Первоначально легочный клапан имплантировался в выводной тракт левого желудочка в субкоронарную позицию. Впоследствии эту операцию стали выполнять в виде протезирования корня аорты легочным стволом с реимплантацией коронарных артерий.
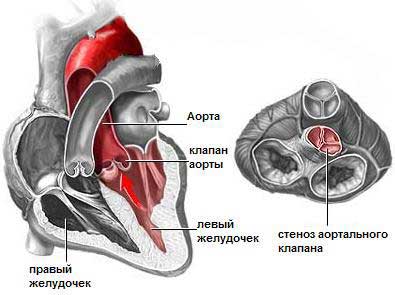
Проблему расширения гипоплазированного кольца аорты решали различными методами. Первый из них — «задний» метод — опубликовали в 1970 г. Nicks и соавторы из Сиднея. Похожую, но более агрессивную технику предложил в 1979 г. Manougian. Расширение гипоплазированного кольца кпереди описал Konno из Токио в 1975 г.. В последующем эту технику стали выполнять в комбинации с операцией Ross у больных с гипоплазией клапанного кольца и особенно у пациентов с туннелевидным субаортальным стенозом.
Первая чрескожная баллонная аортальная вальвулотомия у взрослых была описана Lababidi в 1984 г.. Rupprath и Neuhaus, а также Sanchez и соавторы применили эту технику у младенцев в 1985 г. Вскоре после этого Lababidi и Weinhaus опубликовали применение этого метода у новорожденных с критическим аортальным стенозом. При изучении эффективности хирургической и баллонной аортальной вальвулопластики получены сравнимые непосредственные и среднесрочные результаты.
Выбор типа хирургического вмешательства
Методы хирургического лечения адаптированы к состоянию больных, возрасту и форме порока.
-
У младенцев, находящихся в тяжелом состоянии, методом выбора является чрескожная баллонная вальвулопластика.
-
У старших детей выполняют аортальную вальвулотомию под контролем зрения на открытом сердце.
-
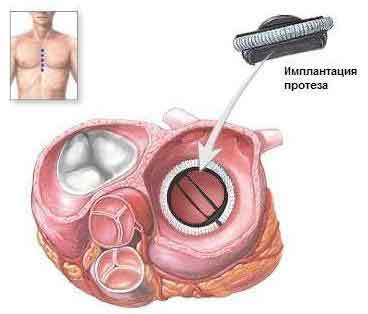
Протезирование аортального клапана может оказаться неизбежным при одностворчатом или дисплазированном двустворчатом клапане, а также у старших детей и взрослых после предшествующей вальвулотомии в связи с прогрессирующими дегенеративными изменениями и кальцификацией. Необходимость протезирования клапана возникает примерно у 35% пациентов через 15-20 лет после первого вмешательства. Протезирование клапана выполняют с использованием механического протеза, свиного биопротеза, аортального аллографта или легочного клапанного аутографта. Механический протез предусматривает пожизненное применение антикоагулянтов; свиной или аортальный аллографт не представляют угрозу тромбообразования, однако имеют ограниченную продолжительность функционирования.
-
Аутотрансплантация собственного легочного ствола с клапаном в аортальную позицию и восстановлением выводного тракта правого желудочка гомографтом является более сложным вмешательстовом, чем простое протезирование, из-за необходимости реимплантации коронарных артерий и использования кондуита. Легочный аутографт отличается долговечностью, не требует антикоагулянтов, сохраняет способность к росту, поэтому операция Ross особенно привлекательна у детей.
-
Больные с тяжелым сужением клапанного кольца или туннелевидной обструкцией нуждаются в расширении корня аорты в сочетании с протезированием клапана или операцией Ross.
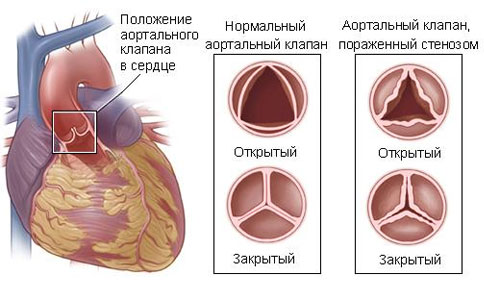
Предоперационное лечение критического аортального стеноза
В качестве подготовки к хирургическому вмешательству новорожденным с сердечной недостаточностью, находящимся в критическом состоянии, проводят лечение инотропными средствами и диуретиками, инфузию простогландина E1 и кислородотерапию. Простогландин обеспечивает двухжелудочковое кровоснабжение системного круга. При тяжелой сердечной недостаточности могут потребоваться эндотрахеальная интубация и механическая вентиляция для снижения сопутствующей легочной гипертензии. Больные должны быть седированы для минимизации потребления кислорода организмом. Контролируют газы артериальной крови, проводят коррекцию ацидоза.
Аортальная баллонная вальвулопластика
Операция является ургентным паллиативным вмешательством у новорожденных и младенцев, позволяющим отсрочить открытую вальвулотомию или протезирование клапана. Однако может развиться недостаточность клапана, изменяющая тактику последующего хирургического лечения.
Ожидание значительной ятрогенной недостаточности аортального клапана было причиной того, что на протяжении многих лет эта процедура использовалась редко. В 1984 г. Lababidi и соавторы впервые использовали АБВ и показали, что она является эффективным и безопасным методом устранения клапанного стеноза. Признание преимуществ этого метода интервенционной кардиологии пришло не сразу. Тем не менее, после анализа результатов большого количества вмешательств целый ряд детских кардиологических центров убедились в эффективности баллонной дилатации. Она оказалась приблизительно равной результатам хирургической вальвулотомии. В настоящее время во многих центрах этот метод является первым шагом в лечении клапанного стеноза аорты.
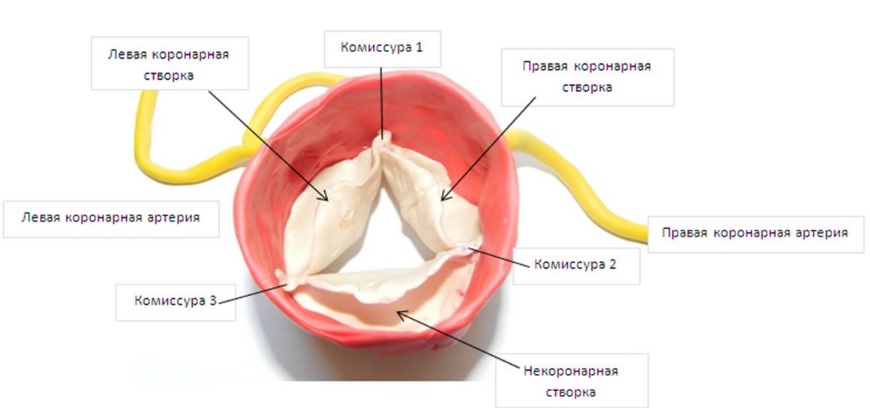
-
Показания к вмешательству.
У новорожденных показания к неотложной операции не так однозначны, как у старших детей. Градиент давления не является абсолютно надежным показателем размера отверстия из-за неизвестного объема кровотока через клапан. Он зависит от функции левого желудочка, наличия недостаточности митрального клапана, шунтирования слева направо через овальное окно, шунтирования справа налево через ОАП с участием правого желудочка в обеспечении системного кровообращения. Баллонная дилатация показана у новорожденных с критическим аортальным стенозом, определяемым как дуктусзависимое системное кровообращение, а также при градиенте давления более 60 мм рт. ст. и в случаях прогрессирующего снижения фракции выброса при частом эхокардиографическом контроле.
-
Техника.
Условием выполнения баллонной вальвулопластики является отсутствие недостаточности клапана и других аномалий сердца, кроме коарктации аорты. Размер баллона не должен превышать диаметра аорты, во всяком случае, он должен быть на 1 мм меньше клапанного кольца. Обычно АБВ выполняют доступом через бедренную артерию. Катетер проводят через аорту и суженный аортальный клапан в полость левого желудочка. Проведение проводника и катетера через стенозированное устье аорты является наиболее трудной частью процедуры. Используют различные катетеры:
-
правый или левый коронарные;
-
многоцелевой;
-
катетер по типу внутренней грудной артерии.
Среди используемых проводников лучшие имеют гидрофильное покрытие.
После зондирования левого желудочка в его полость вводят длинный проводник со скрученным наконечником. Благодаря этому можно избежать потенциального травмирования верхушки сердца концом баллон-катетера. У пациентов старшего возраста лучше использовать жесткий проводник, это позволяет правильно фиксировать баллон. При растянутом клапанном кольце можно использовать методику с двумя баллонами. В этом случае диаметр двух баллонов должен составлять 1,2 диаметра клапанного кольца аорты. При АБВ применяют длинные баллоны: длиной 3 см у детей в возрасте 1—3 года, 4 см — у детей в возрасте 4-12 лет и 5 см — у взрослых пациентов. Это позволяет правильно позиционировать баллон и препятствовать его смещению во избежание повреждения аортального клапана.
После установки баллон резко наполняют рентгеноконтрастным веществом, разведенным физиологическим раствором, а затем так же резко опорожняют. Во время раздувания баллона обычно отмечается короткий эпизод преходящей брадикардии и снижения артериального давления.
Наиболее частым осложнением АБВ является травма бедренной артерии. В настоящее время данное осложнение отмечается редко. Это связано с применением новых низкопрофильных баллонкатетеров. Необходимо отметить, что помимо доступа через бедренную артерию можно использовать доступ через бедренную вену. В этом случае катетер проводят через правое и левое предсердия в левый желудочек и аорту. Однако при использовании этого метода высока частота неудач правильного позиционирования баллон-катетера и риск повреждения аппарата митрального клапана. В последнее время все чаще используется доступ через правую сонную артерию, в основном у новорожденных с критическим аортальным стенозом. При осуществлении этого доступа хирургическим путем выделяют общую сонную артерию и под контролем зрения вводят интродъюсер. Доступ значительно облегчает канюляцию аортального клапана благодаря прямому пути проведения катетеров и проводников и сокращает длительность процедуры. При выполнении этой операции необходимо соблюдать меры профилактики воздушной эмболии. После проведения дилатации интродъюсер из сонной артерии удаляют, и место пункции ушивают сосудистым швом.
Об эффективности дилатации свидетельствует снижение градиента давления на 60-70 % либо снижение давления до 30-40 мм рт. ст. при отсутствии существенной аортальной недостаточности. Баллонная дилатация, как и хирургическая аортальная вальвулотомия, является паллиативным вмешательством. Однако она позволяет избежать торакотомии и искусственного кровообращения, что весьма существенно ввиду необходимости в дальнейшем замены аортального клапана на протез.
Жизнеспасающий характер баллонной дилатации у новорожденных с критическим аортальным стенозом оправдывает некоторые осложнения, изредка сопровождающие эту операцию. Наиболее частым из них является аортальная недостаточность, которая в подавляющем большинстве случаев не выражена. Значительная недостаточность возникает вследствие пролапса створок из-за разрыва и отрыва от клапанного кольца. Серьезная недостаточность требует хирургического вмешательства. Среди других осложнений встречаются:
-
кровотечение;
-
аритмии;
-
инсульты мозга;
-
подвздошнобедренные сосудистые осложнения;
-
повреждение митрального клапана.
Не исключены летальные исходы.
Открытая аортальная вальвулотомия
В настоящее время редко выполняется у младенцев с критическим аортальным стенозом. Существует несколько методов открытой аортальной вальвулотомии.
Некоторые центры до настоящего времени предпочитали выполнять открытую вальвулотомию в условиях кратковременной окклюзии полых вен. После нескольких сокращений сердце опустевает. Пережимают аорту, производят продольную аортотомию, скальпелем надрезают сращение передней комиссуры. При сильно выраженной дисплазии створок часто невозможно локализовать расположение комиссур. В данном случае производят небольшие разрезы центральной части створок, соблюдая осторожность, так как чрезмерное рассечение приведет к несмыканию створок и развитию аортальной недостаточности, которая крайне тяжело переносится ребенком. На разрез аорты накладывают боковой зажим, аорту открывают и освобождают тесемки на полых венах. Пока аорта реперфузируется, аортотомию ушивают. При использовании данной методики безопасное время пережатия магистральных сосудов составляет порядка 3 мин. До 90-х годов в большинстве кардиохирургических центров успешно использовалась эта методика. Недостатками операции являются вынужденная поспешность и дополнительный стресс для скомпроментированного сердца.
Искусственное кровообращение дает достаточно времени для расчетливой и точной комиссуротомии и изменения тактики в пользу одного из видов замены клапана. Канюлируют дистальный отдел восходящей аорты и правое предсердие одной канюлей. Сразу после начала искусственного кровообращения временно пережимают ОАП турникетом. Больного охлаждают до 32-34ОС. Пережимают аорту, сердце останавливают антеградной холодовой кардиоплегией. Выполняют поперечную аортотомию. Сращенные комиссуры рассекают скальпелем №11 в направлении кольца аортального клапана, не переходя на него. При эксцентрическом расположении отверстия сохраняют двустворчатую структуру клапана, так как соблазн увеличить полезное сечение клапана путем воссоздания трехстворчатой анатомии чреват значительной аортальной недостаточностью. Ушивают разрез аорты. Восстанавливают коронарный кровоток. Останавливают искусственное кровообращение. Если состояние ребенка стабильное, перевязывают боталлов проток. Однако при наличии левожелудочковой недостаточности проток оставляют открытым и поддерживают его проходимость инфузией простагландина Е1 в течение раннего послеоперационного периода. Это обеспечивает дополнительный приток крови в аорту из правого желудочка.
В течение нескольких дней дети могут оставаться в тяжелом состоянии и нуждаться в инотропной поддержке. Снижение сердечного выброса обусловлено диастолической дисфункцией, снижением наполнения желудочка. Состояние детей, имеющих адекватный размер левого желудочка, улучшается в течение нескольких дней. Частота сердечных сокращений уменьшается по мере улучшения комплайнса левого желудочка и увеличения ударного объема. Эхокардиография регистрирует увеличение кровотока через аортальный клапан. По этой причине градиент давления на клапане может оказаться выше дооперационного. Даже при адекватной вальвулотомии нередко отмечается небольшая регургитация. Если состояние больного не улучшается, следует исключить сопутствующие пороки, например ДМЖП. Суживание легочного ствола или закрытие дефекта могут оказаться необходимыми. Коарктация аорты также может быть не замеченной до операции, хотя при функционирующем артериальном протоке она может не проявляться. При недостаточной вальвулотомии необходимо произвести баллонную дилатацию.
Аутотрансплантация легочного ствола в аортальную позицию
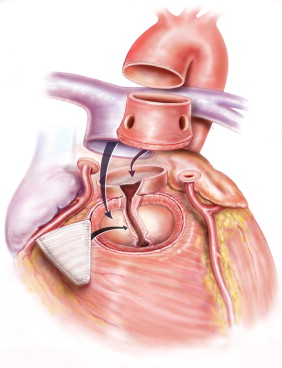
Использование легочного аутографта для протезирования аортального клапана у детей является привлекательным методом, так как клапан может расти. Операцию выполняют в условиях гипотермической перфузии. По выбору хирурга используют одну или две венозные канюли. Дренируют левый желудочек. Используют ретроградное введение кардиоплегического раствора. После пережатия аорты выполняют аортотомию на уровне синотубулярного соединения. Обследуют клапан и, если убеждаются, что он не подлежит реконструкции, приступают к подготовке легочного ствола для трансплантации. Пересекают легочный ствол проксимальнее бифуркации легочных артерий и исследуют анатомию клапана. Подтягивая легочный ствол кпереди, выделяют заднюю поверхность клапана. Очень важно выделить левую главную коронарную артерию и ее бифуркацию. С помощью изогнутого зажима намечают точку на передней стенке правого желудочка чуть ниже вершины одного из синусов и прокалывают скальпелем. Разрез продлевают в обе стороны, оставляя небольшой венчик мышцы правого желудочка вокруг створок. Рассекают эндокард вдоль заднего края клапана и осторожно углубляются кзади, навстречу месту ранее выполненной наружной препаровки. На этом этапе важно не внедряться глубоко в межжелудочковую перегородку и не повредить первую септальную ветвь передней нисходящей коронарной артерии. Если это произошло, ее необходимо восстановить или, по крайней мере, перевязать. Через поврежденную ветвь происходит утечка крови из системы левой коронарной артерии. Это может стать причиной более тяжелого ишемического повреждения, чем от перевязки септальной артерии. Подготовленный легочный клапан до момента его имплантации в аортальную позицию сохраняют в полости перикарда, заполненного охлажденным солевым раствором.
Далее иссекают устья коронарных артерий с большим участком стенки синуса. Удаляют створки аортального клапана и излишки стенки аорты. Легочный клапан пришивают к отверстию выводного тракта левого желудочка непрерывным или отдельными швами. Ориентация клапана должна соответствовать двум условиям:
-
клапан целесообразно развернуть на 180 градусов, так как передняя стенка содержит больше мышечной ткани и линия шва по плохо доступной впоследствии задней полуокружности будет более герметичной;
-
«пуговица» левой коронарной артерии должна совпадать с синусом аутографта, чтобы ее можно было пришить без натяжения и перегиба.
После завершения проксимальной линии шва левую коронарную артерию анастомозируют с задней стенкой аутографта. Следующим этапом является выполнение анастомоза аутографта с дистальной аортой непрерывным швом. Для определения оптимального места имплантации пуговицы правой коронарной артерии просвет неоаорты расправляют кардиоплегическим раствором. Еще до фиксации легочного ствола накладывают наружные направляющие швы на уровне комиссур для предупреждения повреждения створки клапана при имплантации правой коронарной артерии.
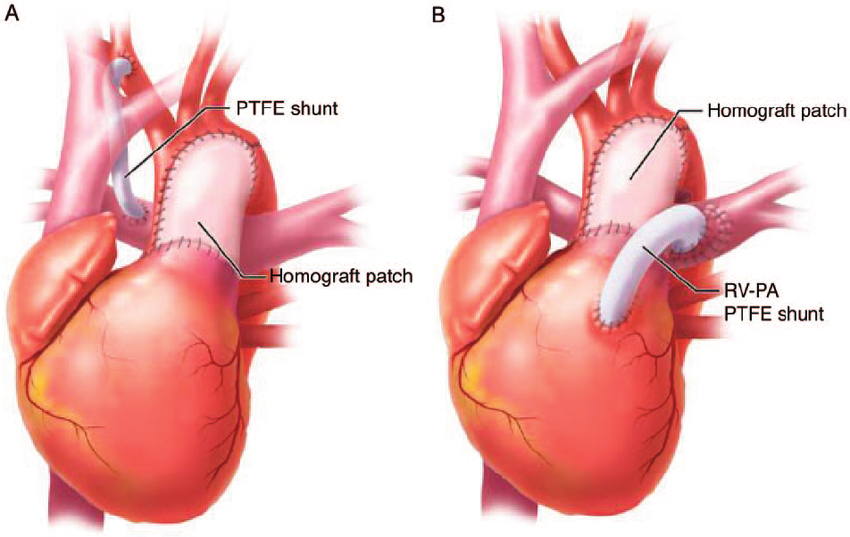
Удаленный легочный ствол возмещают гомолегочным кондуитом. Вначале выполняют дистальный анастомоз непрерывным швом, затем — проксимальный анастомоз. Перед наложением последнего стежка эвакуируют воздух из правых отделов сердца. Связь правого желудочка с легочной артерией может быть восстановлена с помощью трубки из аутоперикарда или GoreТex с моностворкой из листового GoreTex. Возможно также прямое соединение бифуркации хорошо мобилизованных легочных артерий с правым желудочком. При необходимости переднюю стенку соединения «правый желудочек—легочная артерия» можно закрыть лоскутом перикарда с моностворкой.
Аутотрансплантация легочного ствола в сочетании с аортовентрикулопластикой
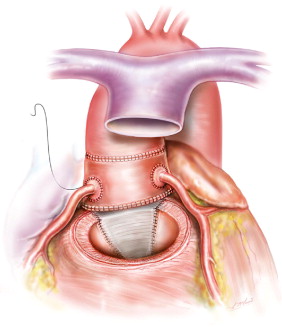
При обструкции выводного тракта левого желудочка, вызванной гипоплазией клапанного кольца или подклапанным сужением, показана аортовентрикулопластика в сочетании с замещением клапана легочным аутографтом, аортальным гомографтом или механическим протезом. Аортовентрикулопластика была предложена для имплантации механического клапана необходимого размера. У детей эта операция обладает недостатками, связанными с необходимостью применения антикоагулянтов, риском развития параклапанной недостаточности с сопутствующим гемолизом, а также выбухания ригидного механического клапана в выводной тракт правого желудочка. Поэтому у детей лучшей альтернативой считается операция Ross-Konno. Она также не лишена недостатков. К ним относятся ограниченная продолжительность функционирования кондуита в выводном тракте правого желудочка, недостаточность моностворчатого клапана в суррогатных кондуитах, возможность дилатации неоаорты с развитием недостаточности клапана и образование аневризмы субаортальной заплаты. Таким образом, проблема одного клапана со временем становится проблемой двух клапанов.
Операцию выполняют в условиях умеренной гипотермии. Дренаж левых отделов сердца осуществляют через прокол овальной ямки или через правую верхнюю легочную вену. Многократные инфузии кардиоплегического раствора проводят ретроградно через коронарный синус. После пережатия аорты и остановки сердца восходящую аорту пересекают на уровне синотубулярного соединения. Иссекают коронарные артерии с большим венчиком аортальной стенки. Для операции Ross-Konno легочный аутографт должен включать часть передней стенки правого желудочка, которая используется для закрытия ДМЖП, образовавшегося при выполнении аортовентрикулопластики.
Поперечный разрез аорты продолжают под прямым углом влево вниз в сторону комиссуры между левой и правой коронарными створками.
Рассекают межжелудочковую перегородку влево, а не к верхушке, поэтому проводящая система остается ниже. Разрез не следует продлевать далеко на переднюю трабекулярную часть перегородки, чтобы не осложнить закрытие этого угла дефекта.
Легочный аутографт пришивают к основанию аортального кольца непрерывным швом. Его ориентируют таким образом, чтобы ткань стенки правого желудочка закрыла дефект перегородки. При необходимости для закрытия ДМЖП можно использовать треугольную заплату из GorеTex. Обычно легочное кольцо больше аортального, и с небольшим дополнительным участком мышцы инфундибулярного отдела этих тканей достаточно для создания выходного тракта левого желудочка без заплаты. Важно, чтобы аутографт фиксировался к краям разреза межжелудочковой перегородки отдельными швами с прокладками и вторым непрерывным швом для исключения остаточных дефектов.
Далее продолжают по методике операции Ross. Имплантируют левую коронарную артерию, дистальный конец легочного гомографта анастомозируют с бифуркацией легочной артерии. Анастомозируют дистальную аорту с неоаортой, затем имплантируют правую коронарную артерию. Легочный гомографт анастомозируют с правым желудочком 4/0 проленом. Поскольку линия шва проходит в непосредственной близости от левой главной коронарной артерии и передней нисходящей ветви, этот анастомоз лучше выполнять при зажатой аорте. Дефект передней стенки правого желудочка при необходимости можно закрыть заплатой из GorеТex, хотя потребность в этом возникает редко.
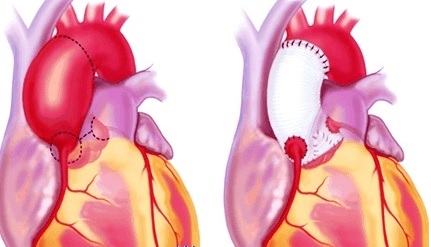
Протезирование аортального клапана с расширением кольца
Протезирование аортального клапана при стенозе с нормальным диаметром кольца почти никогда не выполняется у детей. У подростков и взрослых с сужением клапанного кольца протезирование аортального клапана механическим или биологическим протезом может потребовать применения технических приемов, позволяющих имплантировать клапан адекватных размеров.
Самым простым методом является расположение протеза в супраанулярной позиции, используя выбухающие синусы Вальсальвы. Супраанулярная позиция позволяет вшить клапан на один размер больше аортального кольца. Протез пришивают только вдоль левого и правого коронарных синусов. Далее его фиксируют с наклоном в супраанулярное положение вдоль некоронарного синуса. В этой области матрацные швы проводят снаружи аорты и завязывают на манжете протеза. Когда этот прием недостаточен, а также в случаях выраженного сужения корня аорты применяют одну из методик расширения аорты.
Метод Nicks
Разрез аорты в виде хоккейной клюшки продлевают книзу к комиссуре между левой и некоронарной створками. Идентифицируют мембранозную перегородку. Она находится под передней половиной некоронарного синуса. Разрез не продлевают на переднюю створку митрального клапана, он заканчивается в пределах фиброзной ткани, соединяющей митральный и аортальный клапаны в месте сращения их со стенкой левого предсердия. Левое предсердие отпрепаровывают, оно может вскрыться. Выкраивают каплеобразной формы заплату из перикарда или дакрона низкой порозности шириной до 4 см. Укладывают узкую полоску из фетра или перикарда вдоль разреза снаружи стенки аорты. Начиная с нижнего угла разреза, проводят матрацные швы 3/0 проленом через велюр, стенку аорты и заплату. Следует действовать аккуратно, так как эта область крайне плохо доступна после снятия зажима с аорты. Клапан фиксируют к заплате отдельными матрацными швами, которые проводят снаружи внутрь. Линию шва по заплате следует проводить дистальнее, чем в правом и левом коронарных синусах, наклоняя клапан под небольшим углом к анулярной плоскости.
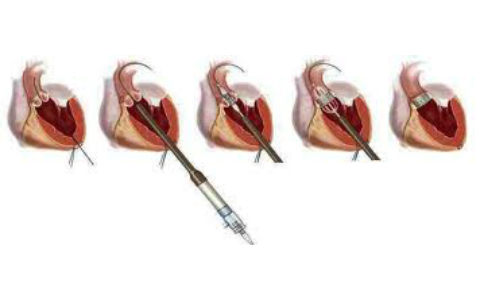
Метод Manougian
Данный метод более радикален, чем метод Nicks. Разрез имеет такое же направление, но его продлевают через митрально-аортальную фиброзную ткань на переднюю створку митрального клапана, поэтому вскрывают крышу левого предсердия. Однако она легко захватывается в шов при фиксации заплаты и фактически его укрепляет. Прием Manougian можно применить при имплантации не только механического протеза, но и гомографта. Митральный компонент аортального гомографта может быть использован для увеличения длины окружности клапанного кольца и закрытия дефекта передней створки митрального клапана. Линия шва в пределах створки митрального клапана должна быть укреплена полоской перикарда. При использовании механического протеза для восполнения дефекта в передней створке митрального клапана, расширения клапанного кольца и аорты предпочтительным материалом является перикард, обработанный глютаральдегидом. Восходящую аорту закрывают тем же лоскутом перикарда.
Вертикальную аортотомию направляют несколько правее комиссуры между левой и правой коронарными створками аортального клапана. Находят устье правой коронарной артерии и разрез продолжают левее устья. Правый желудочек открывают косым разрезом, находят клапан легочной артерии и соединяют два разреза. Перед или после иссечения аортального клапана производят разрез основания правой коронарной створки левее ее нижней точки и продолжают его по межжелудочковой перегородке по направлению к верхушке левого желудочка. Разрез оказывается слева от проводящей системы. Протез клапана, как обычно, пришивают к основанию нативных створок отдельными швами с прокладками, за исключением сегмента окружности, предназначенного для расширяющей кольцо заплаты. Заплату треугольной формы из низкопористого полиэстера пришивают к краям разреза перегородки непрерывным швом и к синтетическому ободку протеза отдельными швами. Выкраивают вторую заплату овальной формы для закрытия отверстий в выводном тракте правого желудочка и в восходящей аорте. Сгиб свернутой пополам овальной заплаты пришивают к кольцу протеза. Далее одним непрерывным швом заплату пришивают к краям разреза аорты и желудочка, закрывая их просвет. Линию шва на межжелудочковой перегородке и передней стенке правого желудочка желательно усилить дополнительными швами.
В настоящее время разработаны биологические клапаны с синтетическими манжетами. Они превосходят механические клапаны по гемодинамическим характеристикам и простоте техники имплантации у грудных детей. В дальнейшем их можно заменить клапанами взрослых размеров. Эта тактика позволяет сохранить легочный клапан. Механические клапаны у детей имеют ограниченное применение из-за осложнений антикоагулянтной терапии и ухудшения качества жизни.

Открытая вальвулотомия
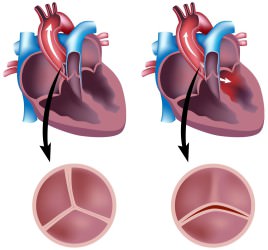
Среди множества публикаций, посвященных результатам открытой вальвулотомии, наиболее исчерпывающим и показательным является исследование, проведенное Detter и коллегами из Мюнхена. Авторы сообщили о лечении 116 пациентов, которым в период между 1960 и 1977 гг. выполнена аортальная вальвулотомия. Отдаленные результаты изучены у 96% пациентов в сроки от 0,1 года до 37 лет за 2761 человеко-лет. Средний возраст пациентов на момент операции составлял 13 лет. Хирургическими показаниями были градиент давления более 50 мм рт. ст. или наличие симптомов заболевания. Двустворчатый клапан был у 72% больных и трехстворчатый — у остальных. Кальцификация створок имела место у 13% больных. Большинству из них произведено удаление кальция одновременно с вальвулотомией. После операции градиент давления в среднем снизился с 78 до 20 мм рт. ст. Только в одном случае он превышал 60 мм рт. ст. Не была отмечена разница в до- и послеоперационных градиентах у больных с двустворчатым и трехстворчатым клапанами. Кальциноз клапана не оказывал влияния на послеоперационный градиент и степень недостаточности. Невыраженная недостаточность клапана развилась у 18% оперированных. Хирургическая летальность составила 2,6%, а отдаленная — 22%, что соответствовало расчетной величине летальности 0,94% на человеко-лет. Актуарная выживаемость к 10, 20, 30 и 37 годам составляла 95, 80, 76 и 72% соответственно. В отдаленном периоде у 32% пациентов произведены повторные вмешательства с интервалом 19 лет. Показаниями к реоперациям были рестеноз у 25 и недостаточность у 12 больных, что отражало прогрессирование порока. У 34 пациентов выполнено протезирование клапана, у 2 — повторная вальвулотомия и у 1 — баллонная вальвулопластика. Отсутствие необходимости в повторных операциях к 10, 20, 30 и 35 годам составила соответственно 94, 80, 57 и 45%. Актуарная кривая свободы от повторных операций имела две отличающиеся фазы:
-
в первые 15 лет необходимость реопераций составляла 0,73% в год;
-
после переломного 15-го года она увеличилась до 2,31% в год.
Приведенные данные в целом соответствуют другим, не упомянутым здесь исследованиям и свидетельствуют о том, что аортальная вальвулотомия является эффективным паллиативным методом лечения клапанного аортального стеноза, результатом которого является низкая летальность, хорошее качество жизни и невысокая частота повторных операций в первые 15 лет после первичного вмешательства. Вальвулотомия обеспечивает пациентам период времени без назначения антикоагулянтов, благополучный для соматического роста и последующего протезирования клапана взрослого размера, если оно понадобится.
Однако детей не стоит подвергать ненужному риску, если показатели гемодинамики не превышают стандартных критериев.
Вальвулотомия у детей первого года жизни сопровождалась высокой госпитальной и отдаленной летальностью, превышающей 30-80%, вне зависимости от метода операции — чрезжелудочковой баллонной дилатации, краткосрочной окклюзии притока крови в сердце, гипербарической оксигенации, искусственного кровообращения. Результаты в значительной степени зависели от наличия критического стеноза, фиброэластоза эндокарда, сопутствующих пороков, размера левого желудочка и его функционального состояния. Среди выживших фракция выброса левого желудочка была 60±17% против 36±2% в группе умерших. Величина градиента достоверно не влияет на выживаемость. Одним из важных эхокардиографических критериев является площадь поперечного сечения левого желудочка. В норме этот показатель у 5-дневного ребенка массой 3 кг варьирует в пределах 1,8-3,5 см2, составляя в среднем 2,65 ± 2 см2. Поперечное сечение менее 2 см2 предсказывает индекс конечно-диастолического объема левого желудочка, измеренного по данным ангиографии, менее 20 мл/м2. Среди выживших объем левого желудочка был 50 ± 8 мл/м2, в группе умерших — 20 ± 4 мл/м2.
Rhodes и соавторы выделили 11 морфологических показателей, влияющих на исходы вальвулотомии при критическом аортальном стенозе.
К ним относятся индексы диаметров клапанного кольца, аорты на уровне синусов Вальсальвы, дуги, перешейка аорты. Кроме этого, следующие параметры были ниже у умерших:
-
индекс размера длинной оси левого желудочка;
-
отношение длинной оси левого желудочка к длинной оси сердца;
-
конечно-систолический и конечно-диастолический объемы;
-
индекс массы левого желудочка;
-
индекс площади митрального клапана;
-
отношение площади митрального клапана к площади трехстворчатого клапана.
Из этих кардиометрических показателей наибольшее влияние на неблагоприятный исход оказывали 4 фактора:
-
отношение длинной оси левого желудочка к длинной оси сердца < 0,8;
-
индекс размера аорты на уровне синусов Вальсальвы < 3,5 см/м2;
-
индекс площади митрального клапана <4,74 см2/м2;
-
индекс массы левого желудочка < 35 г/м2.
При наличии двух и более факторов летальность достигала 100%, при наличии одного фактора или при их отсутствии летальность составляла 8%. Предложенный ключ к возможности проведения у больных бивентрикулярной коррекции не учитывает того факта, что продолжительная выживаемость в пограничных случаях после вальвулотомии влечет за собой серию последующих вмешательств или чрескожных процедур на аортальном, митральном клапанах и дуге аорты, совокупный риск которых может оказаться выше риска одножелудочковой коррекции. Не учтены также среднесрочная летальность и качество жизни. Таким образом, у пациентов с пограничными характеристиками левого желудочка, корня аорты и дуги нет смысла возлагать надежду на бивентрикулярную коррекцию, так как можно упустить оптимальные сроки для операции Norwood. С другой стороны, противоречивость проблемы и сложность принятия решений демонстрируют факты выживаемости больных с критическим стенозом и неблагоприятным прогнозом по критериям Rhodes и роста левосторонних структур при умеренных формах синдрома гипоплазии левого сердца у дуктусзависимых больных, подвергнутых бивентрикулярной коррекции.
Лучшим методом получения ответа на непростые вопросы выбора тактики при критических стенозах являются многоцентровые исследования, которые провело Общество хирургов, занимающихся лечением ВПС. В исследование включены 320 новорожденных с критическим аортальным стенозом и дуктусзависимым кровотоком, оперированных с 1994 по 2000 гг. в 24 клиниках. Сравнивались два метода коррекции — двухжелудочковая и одножелудочковая. Исключены из исследования 25 больных: 19 детей, умерших до вмешательства, и 6 пациентов, подвергнутых первичной трансплантации сердца. Из оставшихся 295 больных у 179 выполнена одножелудочковая коррекция по Norwood и у 116 — бивентрикулярная коррекция. Общая летальность после операции Norwood составила 36%. Выживаемость по Kaplan-Meier составила 80% к 1 мес, 71% к 3 мес, 64% к 1 году, 62% к 2 годам и 60% к 5 годам. В группе бивентрикулярной коррекции летальность составила 28%, выживаемость — 82% к 1 мес, 77% к 3 мес, 72% к 1 году, 71% к 2 годам и 70% к 5 годам. Факторами риска смерти в первой группе были меньший диаметр восходящей аорты и недостаточность трехстворчатого клапана. Факторами риска в группе бивентрикулярной коррекции были меньший возраст, более узкая аорта на уровне синусов Вальсальвы и большая выраженность фиброэластоза по данным ЭхоКГ. Исходя из факторов риска, авторы рассчитали ожидаемую 5-летнюю выживаемость для каждого пациента дважды — по критериям операции Norwood и бивентрикулярной коррекции. Анализ показал, что у 52% пациентов из тех, кому выполнена аортальная вальвулотомия, более высокая 5-летняя выживаемость была бы после операции Norwood и что у 17% больных, подвергнутых одножелудочковой коррекции, более высокая 5-летняя выживаемость была бы при аортальной вальвулотомии.
Следует принять во внимание, что отдаленная перспектива у больных после одножелудочковой коррекции хуже желаемой. Поэтому перспективы лечения пациентов с адекватной полостью левого желудочка и нормальным размером митрального клапана связаны с неонатальной операцией Ross или Ross-Konno.
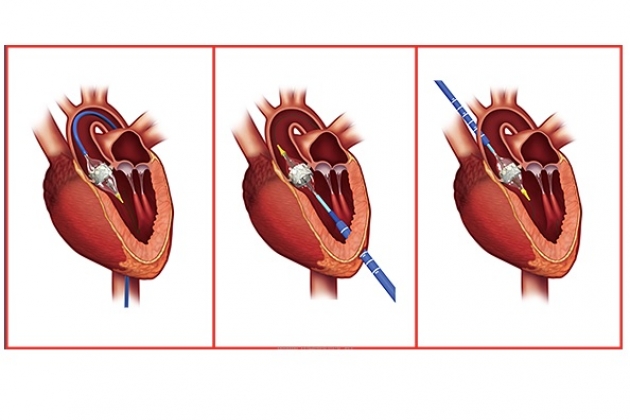
Чрескожная баллонная вальвулопластика
Благодаря малоинвазивному характеру баллонная дилатация стала методом выбора паллиативного лечения у новорожденных, младенцев, детей и молодых взрослых пациентов без кальциноза. Баллонная дилатация приводит к существенному снижению градиента давления и к немедленному улучшению функции левого желудочка, если она была снижена. Градиент давления обычно снижается с 60-70 до 20-30 мм рт. ст. Летальность за период широкого применения этого метода постепенно уменьшалась, и в настоящее время она не превышает 10%. У пациентов с дуктусзависимым кровообращением летальность выше, чем у больных с нормальным кровообращением.
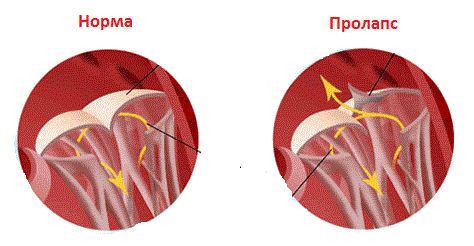
Наиболее частым осложнением при доступе через бедренную артерию является исчезновение пульса, который обычно восстанавливается при лечении гепарином или тромболитическими средствами. Возникновение или увеличение степени аортальной недостаточности наблюдается достаточно часто, однако она обычно хорошо переносится, редко требуя ургентного вмешательства. Это не относится к отрыву одной из створок. Выраженная недостаточность возникает в 5-10% случаев. Факторами риска возникновения значимой недостаточности являются исходная регургитация, диаметр клапана менее 8 мм, дисплазия створок и размер баллона, превышающий диаметр клапана. Причиной возникновения недостаточности может быть перфорация створки проводником при попытках провести его в левый желудочек с последующим разрывом ее баллоном.
Описаны такие тяжелые осложнения, как разрыв бедренной или подвздошной артерии, тампонада перикарда, перфорация аорты или левого желудочка, требующие трансфузии кровотечения, аритмии, повреждение подклапанного аппарата митрального клапана, сепсис, инсульт, остановка сердца. У детей в возрасте менее 3 мес осложнения встречаются чаще.
В центре, обладающем большим опытом, к 8-му году выживаемость составила 88% и отсутствие необходимости в повторном вмешательстве — 64%. Градиент давления был ниже 50 мм рт. ст. у 65% пациентов и значительная аортальная недостаточность — у 14% больных. Согласно данным многоцентровых исследований результатов баллонной дилатации у 95 младенцев доступом через сонную артерию, актуарная выживаемости и отсутствие необходимости повторных вмешательств к 3-му году наблюдений составили 76% и 67% соответственно. Отдаленные результаты были худшими в группе больных с дуктусзависимым кровообращением на момент выполнения процедуры. Средний градиент давления был равен 34 мм рт.ст. Умеренная и тяжелая регургитация была у 15% пациентов.
В другом многоцентровом исследовании сравнивали результаты баллонной вальвулопластики и хирургической вальвулотомии. Выживаемость и отсутствие необходимости в реоперациях были сравнимыми. Однако остаточный градиент был выше в хирургической группе, а частота аортальной недостаточности была выше после баллонной дилатации.
Показания к баллонной дилатации в более старшем младенческом возрасте, а также у детей и подростков те же, что и к хирургической коррекции: градиент давления более 60-70 мм рт. ст. вне зависимости от наличия симптомов заболевания и более 50 мм рт. ст с симптомами заболевания или изменениями волны ST-T на ЭКГ в покое или после нагрузки. Летальность у этой категории больных менее 1%. Градиент давления в среднем снижается с 70 до 30 мм рт. ст., т.е. на 50-60%. Отсутствие значительного снижения давления наблюдается у больных с гипоплазией клапанного кольца. Недостаточность аортального клапана умеренной и выраженной степени возникает в 5-13% случаев. Увеличению недостаточности способствуют исходная регургитация и применение слишком больших баллонов. У старших пациентов более выражены дегенеративные изменения клапана, что предрасполагает к возникновению недостаточности. В этой возрастной группе при нормальной функции желудочка труднее стабилизировать баллон на уровне клапана, поэтому повышается риск его повреждения.
В отдаленном периоде после баллонной дилатации старшие дети умирают редко. Выживаемость к 5-му году составляет 97% и к 8-му году — 95%. 25% пациентов нуждаются в повторном вмешательстве: 17% — по поводу рестеноза и 8% — в связи с аортальной недостаточностью. По некоторым данным, регургитация после баллонной вальвулопластики возникает чаще, чем после хирургической вальвулотомии. Однако данные, полученные в детском госпитале Торонто, это не подтверждают. Проведены сравнительные исследования результатов выполнения баллонной дилатации у 110 детей и хирургической вальвулотомии у 103 пациентов. Частота и тяжесть аортальной недостаточности, скорость ее прогрессирования с течением времени и динамика свободы от повторных операций статистически не отличались. Прогрессирование аортальной недостаточности неизбежно и является следствием аномального строения аортального клапана и модифицированного вмешательства в естественное течение. Иными словами, не имеет значения выбранный способ уменьшения обструкции, а аортальная недостаточность — это цена, которую приходится платить.
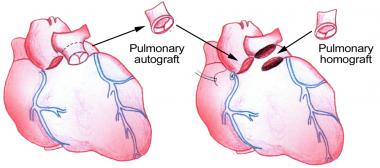
Операции Ross и Ross-Konno
Теоретическими преимуществами легочного аутографта являются потенциальная возможность роста неоаортального клапана, отсутствие иммунологической реакции, продлевающей функционирование клапана, идеальные гемодинамические характеристики и исключение антикоагулянтной терапии. Отличный ближайший результат аутотрансплантации легочного клапана привел некоторых ведущих западных хирургов к радикальной мысли о целесообразности выполнять у детей эту операцию вместо вальвулотомии. Однако известно, что младенцы с критическим аортальным стенозом могут благополучно дожить до протезирования клапана, если оно потребуется. Более мудрое решение — ограничить замену клапана случаями, при которых для пациентов это единственный или определенно лучший выбор для выживания.
Потенциальными недостатками аутотрансплантации легочного ствола являются:
-
ухудшение функции клапана с течением времени;
-
необходимость периодической замены кондуита в выводном тракте правого желудочка.
Операция аутотрансплантации противопоказана у больных с коллагенозами, ревмокардитом и аномалиями легочного клапана. Она невыполнима при аномальном отхождении передней нисходящей коронарной артерии от правой коронарной артерии, пересекающей выводной тракт правого желудочка близко к кольцу клапана легочной артерии. У пациентов с подлегочным ДМЖП и аортальной недостаточностью может отсутствовать мышечная ткань под легочным клапаном, что препятствует безопасному выделению легочного клапана. В этих случаях безопаснее протезировать аортальный клапан гомографтом.
Одной из наиболее значительных проблем является вероятность быстрого расширения неоаорты, приводящая к развитию аортальной недостаточности. Предполагается, что риск дилатации неоарты выше у больных, оперированных по поводу двустворчатого аортального клапана, что связано с гистологическими изменениями в виде дегенерации среднего слоя стенки как аорты, так и легочной артерии, обнаруженными в биоптатах, взятых во время операции. Однако эта версия оспаривается. Некоторые авторы связывают дилатацию аорты с хирургической методикой ввиду того, что дилатация корня неоаорты чаще наблюдалась у больных с неукрепленной стенкой легочного ствола. Предлагалась фиксация исходного диаметра неоаорты в области синотубулярного соединения с помощью дакро- нового протеза, однако эта методика неприменима у растущих детей, так как это разрушило бы одно из преимуществ живой ткани — способность роста.
Несмотря на потенциальные недостатки, большинство хирургических серий демонстрируют приемлемые результаты. В 1997 г. Ross опубликовал 20-летние результаты 131 операции, выполненной им с 1964 по 1984 гг. Трое пациентов умерли в течение первого года: один — от тяжелой регургитации, один — от эндокардита гомографта в легочной позиции и один умер внезапно. В отдаленном периоде умерли 38 больных, из них 13 — от хронической сердечной недостаточности, 6 — от инфаркта и 8 умерли внезапно; 14 смертей были связаны с недостаточностью клапана. Выживаемость к 10 и 20 годам жизни составила 85% и 61% соответственно. Повторно оперированы 46 пациентов, 7 из них — в течение первого года. К 10 годам сохранились 89% первичных гомографтов и к 20 годам — 80%.
Oswalt и соавторы получили аналогичные результаты к 10-му году после операции. Выживаемость составила 90,2%, первичный гомографт в легочной позиции сохранился у 93,2 % пациентов. В педиатрической группе 10-летняя выживаемость составила 94%, неосложненное течение наблюдалось у 93% пациентов.
Результаты операции Ross-Konno опубликованы в 2002 г. детским госпиталем Филадельфии. С 1995 по 1998 гг. были прооперированы 17 пациентов, с одним летальным исходом. Средний возраст больных составил 7 лет. Наиболее частым осложнением была аритмия. Однако ни в одном случае не развилась полная блокада. Другие авторы получили сопоставимые результаты.
Мы считаем, что расширение показаний к операции Ross у взрослых не оправдано, учитывая присутствие на рынке отличных механических и биологических клапанов и проверенных временем приемов для расширения узкого корня аорты.
Наибольший опыт классической операции Konno представлен женским медицинским колледжем из Токио, где эта операция была разработана. В период между 1984 и 2000 гг. были прооперированы 60 пациентов с использованием аортовентрикулопластики и механического протеза. Средний возраст больных — 12 лет. В госпитальном периоде летальных исходов не было, в отдаленные сроки умерли 5 больных. В повторных операциях к 10 годам не нуждались 80% и к 15 годам — 52% пациентов.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии