Периферический стеноз легочной артерии. Причины. Последствия.
Изолированный периферический стеноз легочной артерии впервые был описан Mangars и Schwalbe. С внедрением катетеризации сердца, особенно ангиографии, количество публикаций об этой аномалии резко увеличилось. В двух третях случаях она сочетается с другими пороками. Стеноз периферических легочных артерий сочетается с синдромом Noonan, синдромом Alagille, cutis laxa и синдромом Ehlers-Danlos.
Эмбриология
Легочная артерия и её ветви развиваются из трех отдельных сосудистых компонентов. Проксимальная часть легочного ствола непосредственно над полулунным клапаном развивается из луковицы сердца. Остальная часть легочного ствола происходит от общего артериального ствола. Проксимальные сегменты правой и левой ветвей легочной артерии развиваются из VI жаберной дуги с каждой стороны. Дистальная часть правой VI дуги полностью исчезает, в то время как левая дуга персистирует в качестве артериального протока, впоследствии облитерируясь с образованием артериальной связки. Периферические отделы ветвей легочной артерии берут начало из "постжаберного легочного сосудистого сплетения", которое тесно связано с растущими зачатками легких.
Патогенез периферических стенозов легочных артерий неизвестен. Очевидно, что множество факторов и типов патологических изменений могут приводить к одному результату – сужению просвета ветвей легочной артерии. Большая частота сопутствующих внутрисердечных аномалий свидетельствует, что патогенез этих поражений связан с нарушением механизмов развития. Любое тератогенное воздействие на первичные зачатки легочных артерий может привести к атрезии, гипоплазии или стенозу. На примере синдрома врожденной краснухи видно, что воздействие вируса на процесс формирования эластической ткани, возможно, является принципиальным механизмом развития этой патологии.
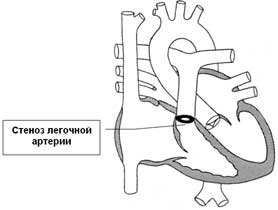
Анатомия и классификация
Различные варианты сужений легочных артерий классифицировали Gay и соавторы в 1963 г., которые разделили всё многообразие стенозов на 4 типа. При типе I стеноза имеется различной длины локальное сужение легочного ствола, правой или левой ветви. Стеноз может быть в виде диафрагмы внутри сосуда или удлиненного уменьшения наружного размера артерии. Тип II представлен гипоплазией бифуркации с вовлечением дистальной части легочного ствола и устьев обеих ветвей. Протяженность сужения варьирует от короткого локального стеноза до длинного сегмента обструкции. Тип III характеризуется множественными сужениями устьев сегментарных легочных артерий с постстенотическими расширениями. Легочный ствол и центральные ветви не изменены. При типе IV сужены центральные и периферические легочные артерии. Легочный ствол обычно не дилатирован, даже при резком сужении его дистальной части, бифуркации и ветвей. Только изредка встречается нерезкая престенотическая дилатация, которая никогда не достигает степени, наблюдаемой при легочной гипертензии.
Встречаемость
Периферические стенозы легочной артерии могут быть изолированными, как компонент соматического синдрома, могут быть элементом различных ВПС или приобретенными. Они зачастую являются наиболее уязвимой частью комплексных врожденных аномалий сердца. Изолированные стенозы отмечаются в 40% случаев. При ВПС периферические стенозы легочных артерий встречаются с частотой 2-3%. В частности, они могут сопровождать:
-
клапанный стеноз легочной артерии;
-
ДМПП;
-
ДМЖП;
-
тетраду Фалло;
-
ОАП.
Периферические стенозы легочной артерии при врожденных соматических синдромах
Периферические стенозы легочной артерии достаточно часто встречаются при различных врожденных соматических синдромах, являясь одним из ожидаемых признаков. Наиболее типичными являются синдромы Williams-Beuren и Alagille, а также синдромы CATCH-22, Di George, Keutel, Noonan, врожденная тотальная липодистрофия, врожденная краснуха, синдром Ehlers-Danlos, cutis laxa.
Обструктивные аномалии правых отделов сердца часто ассоциируются с такими синдромами, как Di George синдром, синдром "мягкое нёбо-сердце-лицо" и синдром conotruncalface anomaly. Сочетание признаков дисморфизма, аномалии мягкого нёба, гипоплазии тимуса, паращитовидной железы и порока сердца получило название синдрома Di George. Velocardiofacial syndrome и conotruncal face anomaly синдром имеют схожие с Di George синдромом признаки и сгруппированы как CATCH-22 синдромы. Среди пороков конотрункуса наиболее частым является общий артериальный ствол. К порокам, входящим в общий синдром, относятся перерыв дуги аорты тип В и правосторонняя дуга аорты, тетрада Фалло, отхождение обоих магистральных сосудов от правого желудочка, транспозиция крупных сосудов и отсутствие легочного клапана. Обструктивные изменения легочных сосудов могут сочетаться с любым из перечисленных пороков сердца.
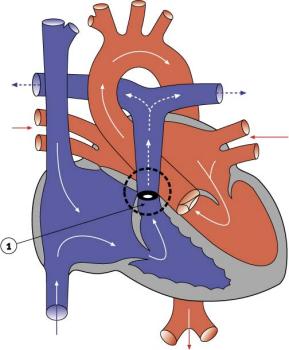
Синдром Williams-Beuren впервые описан Williams и Beuren как сочетание надклапанного стеноза аорты, сужения легочных артерий, характерной внешности и отставания в умственном и физическом развитии. Сосудистые пороки являются следствием дефицита гена эластина и нарушения генной продукции тропэластина, который принимает участие в формировании архитектуры эластических волокон сосудов.
Сужения легочной артерии при этом синдроме встречаются у 39-83% пациентов. Они могут быть локальными или диффузными, вовлекать центральные и/или периферические ветви, включая множественные двусторонние долевые и сегментарные артерии в их устьях.
Синдром Alagille является генетическим заболеванием, при котором наследуются аутосомальные доминантные черты с вариабельной экспрессией. Фенотип состоит из 5 главных признаков, включая внутрипеченочный холестаз, диффузную гипоплазию легочных артерий, глазную патологию, врожденное отсутствие или недоразвитие половины позвонков и характерную внешность. Стенозы легочной артерии встречаются при этом синдроме в 70-85% случаев. Поражения легочных артерий при синдроме Alagille обычно двусторонние и распространяются к периферии на сегментарные ветви, могут быть диффузными или локальными. Синдром слабой кожи является резко выраженным наследственным заболеванием, которое характеризуется дефицитом эластических волокон кожи в сочетании с эмфиземой легких, дивертикулами кишечника, грыжами и сужением периферических легочных артерий.
Синдром врожденной краснухи
Тератогенный эффект вируса краснухи в первом триместре беременности впервые описан в 1941 г.. Наиболее частым проявлением врожденной краснухи является сочетание ВПС, катаракты и глухоты. После успешного культивирования вируса краснухи в 1962 г. и всесторонних исследований, проведенных во время эпидемии краснухи в Соединенных Штатах в 1964 г., получены сведения о естественном течении инфекционного процесса, патогенеза, эпидемиологии и профилактических мерах. Установлено, что кроме приведенной выше триады врожденных аномалий, в клинической картине присутствуют микрофтальмия, ретинопатия, тромбоцитопеническая пурпура, гепатоспленомегалия, малая масса ребенка при рождении, патология костей и другая, более редкая, патология.
Установлено, что вирус краснухи поступает через матку и персистирует в течение всей беременности и в родах. Вирус можно выделить из тканей плода, полученных при терапевтическом аборте, через недели или месяцы после инфицирования матери. После рождения вирус может быть выделен из мочи, спинномозговой жидкости и других тканей и жидкостей. Содержание вируса после рождения постепенно уменьшается, но с возрастом этот процесс замедляется. У младенцев титр антител против вируса краснухи сравним с материнским и сохраняется в течение многих лет. Персистирование бессимптомной врожденной краснухи у детей, которые выглядят нормальными в течение первых месяцев жизни, может привести к развитию легких психотропных нарушений. Эти младенцы являются контагиозными и должны быть изолированы для предупреждения распространения инфекции на чувствительных женщин в ранних стадиях беременности.
Использование живой ослабленной вакцины вируса краснухи эффективно снижает частоту врожденной краснухи, однако остается нерешенной проблема уничтожения этой инфекции в общей популяции.
Перечень сердечно-сосудистой патологии, связанной с синдромом краснухи, обширен. Ранние сообщения показывали, что наиболее частым пороком был ОАП. О причастности материнской краснухи как возможной причины к возникновению стеноза легочной артерии впервые сообщили Arvidsson и соавторы. В 1963 г. Rowe обратил внимание на частое появление стеноза легочной артерии у детей матерей, заразившихся краснухой во время эпидемии в Новой Зеландии. Другие авторы подтвердили это наблюдение. Стенозы легочных артерий локализовались во всех сегментах легочного артериального бассейна. Поражения легочных артериальных сосудов были изолированными или сочетались с ОАП, клапанным стенозом легочной артерии, ДМПП. Изолированные периферические легочные артериальные стенозы при краснухе встречались с той же частотой, что и ОАП. С синдромом краснухи также ассоциируются:
-
ДМЖП;
-
клапанный или надклапанный стеноз аорты;
-
тетрада Фалло;
-
коарктация аорты;
-
АТК;
-
ТМА.
Описаны генерализованные поражения системных артерий – аорты, коронарных, мозговых, мезентериальных и почечных – и диффузная гипоплазия брюшной аорты. Гистологические изменения в аорте и больших сосудах проявляются фокальным утолщением интимы, потерей фиброэластической ткани, фрагментацией эластических волокон, вакуолизацией медии. В мелких сосудах в патологический процесс вовлекается также внутренняя эластическая пластина.
Клиническая картина у новорожденных и младенцев с сердечно-сосудистой патологией при синдроме краснухи зависит от тяжести пороков и сопутствующих аномалий других органов и систем. Рано проявляются признаки сердечной недостаточности. Прогноз зависит от вида порока и его тяжести. Умеренные периферические сужения не прогрессируют и даже исчезают с возрастом. Тяжелые стенозы имеют тенденцию к ухудшению.
Стеноз легочной артерии у новорожденных
У новорожденных часто наблюдается физиологическое сужение легочной артерии, обусловленное относительной гипоплазией ее ветвей. В большинстве случаев оно уменьшается с ростом ребенка и к 6-месячному возрасту исчезает. Сужение клинически проявляется преходящим систолическим шумом. Эхокардиографические исследования показали, что при наличии шума размеры легочного ствола и ветвей меньше, чем у детей без шума, и в среднем составляют 60% от ожидаемой нормы. Допплер-ЭхоКГ обнаруживает турбулентный характер тока и значительно большую скорость кровотока в ветвях. К 3-месячному возрасту у 70% детей исчезает шум, увеличивается размер ветвей и снижается скорость кровотока.
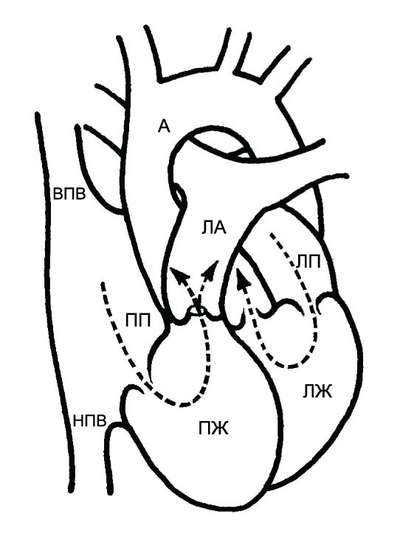
Стеноз левой легочной артерии и артериальный проток
При закрытии артериального протока у здорового ребенка может развиться сужение левой легочной артерии, но особенно часто – у больных с клапанным стенозом или атрезией легочной артерии. Механизмы развития сужения левой легочной артерии и коарктации аорты идентичены и связаны с боталловым протоком, поэтому термин «коарктация легочной артерии» отвечал бы сути этой аномалии. При посмертных гистологических исследованиях стеноза легочной артерии обнаруживалась ткань протока в стенке легочной артерии со стороны протока. Описан случай локального сужения обеих ветвей легочной артерии в месте впадения билатерального боталлова протока. Роль боталлова протока в механизме сужения левой ветви показана при допплер-исследованиях недоношенных детей до и после закрытия протока. У каждого третьего ребенка возникал значимый преходящий стеноз левой легочной артерии. В правой легочной артерии градиент давления не выявлялся. Наблюдались также асимметрия кровотока и переходные изменения от фетального до зрелого состояния в правом и левом легочных сосудистых бассейнах.
Учитывая доказанный факт роли протока в развитии коарктации легочной артерии, рекомендовано полное иссечение ткани протока из стенки легочной артерии для предупреждения односторонней гипоплазии легочного артериального дерева.
Приобретенные сужения легочных артерий
Приобретенные сужения легочных артерий наблюдаются после паллиативных и восстановительных хирургических вмешательствах:
-
системно-легочных анастомозах;
-
суживании легочной артерии;
-
унифокализации при атрезии легочной артерии с ДМЖП;
-
операции артериального переключения при транспозиции магистральных артерий и отхождении обоих крупных сосудов от правого желудочка с подлегочным ДМЖП;
-
при этапной одножелудочковой коррекции.
Сужения артерий изредка возникают при фиброзирующих медиастинитах или при опухолях средостения вследствие наружного сдавления.
Модифицированный анастомоз по Blalock-Taussig часто осложняется гипоплазией, дискретным стенозом или перегибом легочной артерии. Ангиографические исследования, предшествующие полной коррекции тетрады Фалло, показали, что у трети пациентов дистальные отделы правой легочной артерии менее развиты, чем у больных, не перенесших паллиативного вмешательства. Особенно выраженные деформации и гипоплазия наблюдаются у детей после анастомозов, выполненных в неонатальном возрасте. Они требуют дополнительных катетерных или хирургических вмешательств.
После операций артериального переключения вследствие применения маневра Le Compte и вызванного им натяжения и сплющивания легочный ствол имеет овальную форму, поперечное сечение его меньше нормы, а ветви легочной артерии недоразвиты и сужены у каждого четвертого больного.
Гемодинамика
Гемодинамика при периферическом стенозе легочной артерии в основном идентична таковой при изолированном клапанном стенозе. В соответствии с выраженностью обструкции систолическое давление в правом желудочке и проксимальных по отношению к стенозу участках легочной артерии повышено. Вместимость легочного артериального русла проксимальнее сужений снижена. При выраженной обструкции продолжительность выброса из правого желудочка удлинена и легочной ствол проксимальнее сужения ведет себя как продолжение выводного тракта правого желудочка. Давление в легочной артерии периферийнее сужения равно таковому в правом желудочке и легочной клапан остается открытым, пока имеется систолический градиент давления между правым желудочком и дистальной легочной артерией. Этим объясняется более позднее закрытие клапана легочной артерии, несмотря на очень высокое систолическое давление в легочном сосудистом русле. Кривая давления проксимально стенозу напоминает форму её в правом желудочке с высоким систолическим и низким диастолическим давлением. При тяжелых множественных сужениях периферических легочных артерий, включая мелкие ветви, клапан легочной артерии закрывается рано, приблизительно одновременно с закрытием аортального клапана.
Клиника
У пациентов со слабым или умеренным двусторонним или с односторонним стенозом симптомы обычно отсутствуют. Одышка при нагрузке, быстрая утомляемость и признаки застойной сердечной недостаточности отмечаются лишь при тяжелой обструкции. Тонкие различия в аускультативной картине позволяют дифференцировать клапанный стеноз от периферического. Первый тон обычно нормальный, без щелчка выброса. Второй тон обычно расщеплен, и интенсивность легочного компонента нормальна или несколько увеличена. Можно уловить отчетливую разницу между периферическим и клапанным стенозом. Ширина расщепления зависит от тяжести сужения, как при клапанном стенозе, она варьирует в зависимости от фаз дыхания, за исключением случаев очень тяжелой обструкции. Отмечается шум систолического выброса по верхнему левому краю грудины, который проводится под мышку и кзади, но не на шею. У больных с множественными периферическими стенозами II тон над легочной артерией бывает настолько громким, что можно заподозрить легочную гипертензию. Однако, в отличие от легочной гипертензии, при множественных периферических сужениях можно услышать мягкие дующие систолические или непрерывные шумы над обоими легкими и на спине – четкое отличие от легочной гипертензии, при которой шум отсутствует или имеется очень короткий шум систолического выброса по верхнему левому краю грудины. Иногда слышен непрерывный шум при стенозе центральных или дистальных ветвей, особенно при увеличенном легочном кровотоке.
Электрокардиография
ЭКГ не отличается от таковой при клапанном стенозе. Высокая частота отклонения электрической оси влево наблюдается у больных с синдромом врожденной краснухи. Это связано с поражением миокарда вирусом краснухи. Отклонение оси влево отмечается также у многих пациентов с подклапанным легочным стенозом и синдромом Noonan.
Рентгенологические исследования
У пациентов с невыраженным или умеренным стенозом размеры сердечной тени и легочный рисунок нормальные. В отличие от клапанного стеноза дуга легочной артерии не выбухает. Легочный сосудистый рисунок нормальный с двух сторон, даже в случаях одностороннего сужения легочной артерии. Только при выраженном одностороннем стенозе и увеличенном легочном кровотоке обнаруживается различие в выраженности сосудистого рисунка обоих легочных полей. При двустороннем тяжелом сужении легочных артерий размеры сердечной тени увеличены за счет правого желудочка и предсердия.
Эхокардиография
На ЭхоКГ можно обнаружить гипертрофию передней стенки правого желудочка и предположить повышенное давление в его полости. Двухмерная ЭхоКГ позволяет увидеть легочный ствол и проксимальные участки ветвей, а также полость правого желудочка и легочный клапан. Бифуркация и начальные участки ветвей доступны для исследования, в отличие от дистальных. Допплер-ЭхоКГ позволяет измерить градиент давления на сужениях, локализующихся в легочном стволе и его ветвях.
Зондирование сердца
Катетеризация сердца является принципиально важным методом для подтверждения клинического диагноза периферического легочного стеноза. Извлечение катетера из дистальных ветвей позволяет измерить градиент систолического давления на суженном сегменте артерии. Малые значения градиента могут оказаться недостоверными, так как они могут быть следствием несоответствия размеров сосуда и катетера. У младенцев, и особенно у недоношенных, может регистрироваться небольшой – до умеренного – систолический градиент между ветвями легочной артерии и легочным стволом. Этот нормальный физиологический феномен исчезает с ростом ребенка. Он обусловлен несоразмерностью просвета легочного ствола и ветвей легочной артерии. Градиент систолического давления более 10 мм/рт. ст. считается не нормальным при отсутствии увеличенного легочного кровотока. При одностороннем сужении обнаруживается градиент давления на соответствующем сегменте, причем давление в проксимальном участке находится в пределах нормы. Однако при физической нагрузке или при наличии лево-правого шунта градиент может проявиться с одновременным повышением давления в проксимальной легочной артерии.
При периферическом стенозе давление дистальнее сужения обычно низкое, с медленным подъемом и падением и широкой волной. Кривая давления в проксимальном по отношению к сужению сегменте имеет характерный вид, важный для диагностики.
Форма кривой идентична таковой в правом желудочке по высоте и времени до дикротической волны. Дикротическая волна низкая, за которой следует низкое диастолическое давление, по величине равное диастолическому давлению дистальнее обструкции. Ширина пульсовой волны в проксимальной легочной артерии увеличивается соответственно тяжести обструкции.
Характер кривой давления проксимальнее стеноза определяется нарушением функции легочного ствола, стенка которого очень утолщена и фиброзирована, с ограниченной эластичностью. Как подчеркивалось выше, престенотическая часть легочного ствола становится продолжением выводного тракта правого желудочка, и поскольку его функция определяется степенью обструкции, давление в легочной артерии отражает скорее изменения в правом желудочке, чем в дистальном легочном кровообращении. Так как давление в дистальных отделах легочной артерии ниже, чем в желудочке, легочной клапан остается открытым. Смыкание створок происходит во время ранней фазы изометрического расслабления желудочка. В результате возникает резкое увеличение емкости легочного ствола с соответствующим падением давления и образованием дикротической волны. Медленное снижение диастолического давления отражает медленную утечку крови из легочного ствола в дистальные ветви. Замедление диастолического оттока крови происходит вследствие обструкции и нарушенной эластической отдачи утолщенной фиброзированной стенки легочного ствола.
Периферический легочный стеноз часто сочетается с клапанным сужением. Если давление в легочном стволе умеренно повышено, это означает, что периферическое сужение является доминирующим. Если преобладает клапанный стеноз, давление в правом желудочке повышено при нормальном или слегка повышенном давлении в легочном стволе. Тяжесть периферического сужения трудно оценить при надклапанном стенозе, так как выраженность клапанного сужения маскируется. При комбинации сужений на разных уровнях ангиография является решающим методом оценки тяжести надклапанного стеноза.
Ангиокардиография
Селективная ангиокардиография является наиболее ценным методом диагностики периферического сужения легочной артерии. Она позволяет увидеть точную локализацию, протяженность и распределение поражений. При тяжелой односторонней обструкции можно наблюдать замедленное заполнение контрастным веществом соответствующих легочных вен.
Дифференциальный диагноз
Изолированный стеноз периферических легочных артерий может быть заподозрен по характерному систолическому шуму, который широко проводится в подмышку и спину, отсутствию щелчка выброса, широко расщепленному II тону с нормальными дыхательными изменениями и нормальной или слегка увеличенной интенсивностью легочного компонента. ЭКГ и ЭхоКГ полезны для оценки тяжести обструкции.
Поскольку периферический стеноз легочной артерии часто сопровождается другими внутрисердечными и экстракардиальными аномалиями, диагноз доминирующей патологии можно установить по клинической картине.
Анамнез материнской краснухи, семейных ВПС, продолжительная желтуха новорожденных, характерная внешность и другие признаки синдромов Williams или Noonan дают основание предположить, что причиной систолического шума может быть стеноз периферических артерий.
Течение и прогноз
Пациентам с периферическим легочным стенозом рекомендуется обычная профилактика эндокардита. При естественном течении прогноз зависит от выраженности обструкции и в основном такой же, как при клапанном стенозе. Однако при множественных тяжелых периферических стенозах он сравним с первичной легочной гипертензией, когда дилатация и стентирование неэффективны. Возможно прогрессирование обструкции. С другой стороны, во многих случаях градиент давления, зарегистрированный в младенчестве, может исчезнуть с возрастом. Постстенотическое аневризматическое расширение мелких эластических артерий осложняется артериитом, тромбозом или легочным кровотечением. Тяжелый периферический стеноз может привести к смерти, как в раннем младенческом возрасте, так и в последующей жизни. Тяжелые периферические стенозы очень редко встречаются у взрослых.
При синдроме Williams-Beuren в большинстве случаев со временем калибр сосудов увеличивается с одновременным снижением давления в правом желудочке. Положительная динамика отмечается даже при тяжелых стенозах и давлении в правом желудочке, равном системному. Наиболее впечатляющее улучшение происходит в случаях крайне высокого исходного давления в правом желудочке с поразительным улучшением ангиографической картины легочных артерий. Снижение давления в правом желудочке обусловлено увеличением систолической растяжимости, а не истинным ростом просвета артерий.
Синдрому Alagille присуща полиорганная патология. Продолжительность жизни этих больных зависит от наличия ВПС, при котором выживаемость к 20-му году составляет 40%, при отсутствии порока – 80%. Десятилетняя выживаемость пациентов с сопутствующей тетрадой Фалло или с легочной атрезией и ДМЖП составляет соответственно 66% и 25%, при отсутствии синдрома Alagille – 89% и 58%.
Лечение
Умеренный изолированный одно- или двусторонний стеноз не требует лечения. Однако выраженный периферический стеноз может вызвать необходимость устранения с помощью одного из известных методов. До 1981 г. применялось хирургическое устранение обструкции у ограниченного контингента больных с доступными сужениями легочного ствола и центральных ветвей. Однако результаты не были однозначно удовлетворительными при наличии неустранимых в то время множественных дистальных сужений.
-
Баллонная ангиопластика.
В 1980 г. Martin и соавторы описали первую попытку чрескожной внутрисосудистой ангиопластики периферических легочных стенозов. Затем Lock и соавторы в эксперименте на новорожденных ягнятах применили чрезвенозную ангиопластику при искусственно созданном стенозе ветвей легочной артерии. Авторам удалось расширить сужения с помощью усовершенствованного баллона для дилатации Gruntzig. При гистологических исследованиях у 4 больных было показано, что расширение происходило за счет разрыва интимы и растяжения медиального слоя стенки легочной артерии. Полное заживление интимы наступало ко 2-му месяцу после дилатации. При повторном исследовании через 4-14 мес. после дилатации достигнутый диаметр просвета сохранился. Гистологические исследования показали, что разрыв интимы и медии заполнился рубцовой тканью. В одной из артерий дилатированный сегмент дистальнее остаточного сужения был с признаками выраженной пролиферации интимы. Гистологические исследования сосудов, которые не удалось расширить, были заполнены реактивной фиброзной тканью. Эти исследования стимулировали широкое клиническое применение баллонной ангиопластики стенозов периферических легочных сосудов.
Стандартно применяется следующая техника. Баллон-катетер располагают в области стеноза. Используют баллон длиной 2-4 см и диаметром 6-20 мм. После ангиографии выбирают подходящий размер. Он должен быть в 3-4 раза толще суженого сегмента. Баллон раздувают под низким давлением разведенным пополам контрастным раствором. "Талия" баллона должна быть в центре. Затем под постоянным флюороскопическим мониторированием баллон раздувают под высоким давлением в течение 10-60 с, пока не исчезнет талия, и затем быстро сдувают. После дилатации выполняют контрольную ангиографию. Эффективность дилатации подтверждается увеличением диаметра суженного участка артерии и снижением систолического градиента между проксимальным и дистальным участками легочной артерии. Причинами неудач являются неадекватная техника и физические свойства сужения. Устойчивые к дилатации сосуды чаще встречаются у детей старше 2 лет и у пациентов при дискретном стенозе. Как правило, не поддаются дилатации сужения в области системно-легочного анастомоза и сужения, связанные с операцией артериального переключения при полной ТМА. Описаны случаи, когда баллон-катетер не удавалось провести через стенозированный участок артерии во время катетеризации, однако внутриоперационная баллонная ангиопластика оказалась успешной.
Значительными осложнениями чрескожной баллонной дилатации стенозов периферических легочных артерий являются:
-
кровотечение из разорванной легочной артерии;
-
кровохарканье;
-
преходящий отек легких;
-
тромбоз подвздошной вены;
-
аневризма легочной артерии;
-
преходящие аритмии;
-
цианоз и гипотензия;
-
смерть от остановки сердца, парадоксальной эмболии и низкого сердечного выброса.
Для остановки фатального кровотечения из травмированной легочной артерии успешно применяют окклюзирующие пружинки.
-
Внутрисосудистое стентирование.
Расширяемые баллоном стенты разработаны Palmaz и соавторами. Mullins и соавторы, Benson и соавторы, Rocchini и соавторы на экспериментальной модели стеноза легочной артерии показали техническую возможность установки стентов в нормальных и суженных сосудах. На основе этих экспериментальных исследований метод постановки расширяемых баллоном внутрисосудистых стентов был внедрен в клиническую практику.
Техника постановки стентов хорошо разработана. Вначале вводится проводник диаметром 10-12 Fr дистальнее места сужения. Размеры стента в исходном нерасправленном состоянии: диаметр 3,7 мм, длина 3 мм, толщина 0,076 мм. Стент, укрепленный на баллонном ангиографическом катетере, проводят в дистальную легочную артерию. После ангиопластики катетер устанавливают над стенозом, проводник подтягивают в легочный ствол или правый желудочек. Затем баллон раздувают под давлением 6-14 атм. После размещения стента катетер, с помощью которого выполнена ангиопластика, заменяют ангиографическим. Выполняют контрольную ангиографию и изменяют гемодинамические показатели. Положительные результаты внутрисосудистого стентирования у пациентов с устойчивыми к дилатации сужениями ветвей легочной артерии улучшают прогноз при этой патологии.
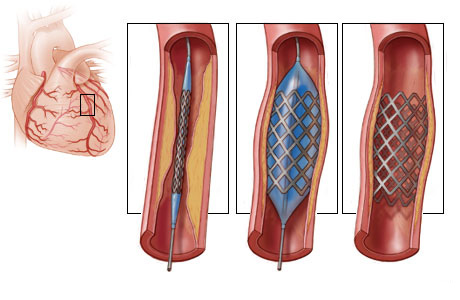
-
Сужение легочной артерии и одножелудочковая коррекция пороков по Fontan.
Нормальные размеры легочных артерий являются принципиальным условием физиологически успешной операции Fontan. Искривление, гипоплазия или сужение легочных артерий являются причиной послеоперационной венозной гипертензии и малого сердечного выброса. Патология легочных артерий у этих больных может быть врожденного происхождения и приобретенного.
Коррекцию этих сужений производят хирургическим путем или чрескожной баллонной дилатацией и стентированием.
Количественная оценка адекватности легочных артерий предложена Mc Goon и Nakata. Наиболее широко используется индекс Nakata – суммарное сечение обеих легочных артерий в мм2, отнесенное к поверхности тела. Этот показатель изучался автором у 40 здоровых людей, 46 больных с тетрадой Фалло, 26 пациентов после операции Rastelli и 15 пациентов после операции Fontan. Размеры легочных артерий измерялись по ангиограммам. У здоровых лиц индекс Nakata равен 330+30 мм2/м2 поверхности тела и не зависит от величины поверхности тела во всех возрастных группах, от младенческой до взрослой. После операций частота синдрома малого сердечного выброса была тем выше, чем меньше значение индекса, особенно если он был < 150 мм2/м2. Зависимость летальности от величины индекса особенно проявилась в группе пациентов после операции Fontan. Двое больных с индексом < 250 мм2/м2 умерли, в то время как 12 из 13 больных с индексом > 250 выжили. Таким образом, пациентам с индексом Nakata > 250 мм2/м2 показана операция Fontan.
Результаты баллонной дилатации
Периферические стенозы легочной артерии остаются нерешенной проблемой. Хирургические методы коррекции, как показал ранний опыт вмешательств, технически трудны, малоэффективны и могут привести к деформации сосудов.
Баллонная дилатация дает неполный эффект и может рассматриваться лишь как паллиативное вмешательство, облегчающее состояние у половины больных. Некоторые авторы приводят данные об увеличении диаметра суженных артерий более чем на 75%, снижении пикового системного давления на 50% и увеличении перфузии легких на 40%.
Регистр врожденных аномалий, подвергшихся лечению путем вальвулопластики и ангиопластики, представил результаты 182 процедур баллонной ангиопластики у 156 пациентов из 27 учреждений. Диаметр сосуда в месте сужения в среднем увеличился с 5 до 7 мм, пик систолического давления снизился в среднем с 49 до 26 мм рт. ст., давление в проксимальном сегменте снизилось с 69 до 63 мм рт. ст. Использование баллонов высокого давления увеличивало частоту успешной дилатации с 50 до 81%. Осложнения возникли у 13% пациентов. Такой же вывод сделали Gentles и соавторы, выполнившие ангиопластику у 52 пациентов с тетрадой Фалло, атрезией легочной артерии с ДМЖП, одножелудочковым сердцем и изолированным периферическим стенозом легочной артерии. Дилатация высоким давлением увеличивала диаметр сосуда более чем в 2 раза, давление в правом желудочке снижалось в среднем на 20%. Таким образом, баллонная ангиопластика легочных артерий обеспечивает значительный непосредственный гемодинамический эффект в случаях, когда оперативное лечение неуспешное.
Многие исследователи не могли предсказать факторы, определяющие успех. В отдаленном периоде описаны рестенозы, однако сведения об их частоте, характере и сроках возникновения изучены недостаточно. Bush и соавторы сообщили о рестенозировании успешно дилатированных артерий у 35% пациентов, Hosking и соавторы – у 17%.
Результаты стентирования легочных артерий
Стентирование легочных артерий обеспечивает более эффективное первичное расширение и возможность повторной дилатации, необходимость в которой возникает с увеличением массы тела и пролиферацией интимы. Стентирование позволяет производить многократные повторные дилатации, тем самым избегая реоперации при различных пороках. Расширяемые баллонном стенты Palmatz вводят не только чрескожным методом, но и во время операций по поводу внутрисердечных пороков в случаях, когда ограничен сосудистый доступ. Стентирование применяется при различной патологии – периферических стенозах легочных артерий, после операции Fontan, при сужении легочных вен, кондуитах.
Имплантация стентов более безопасна, чем дилатация, сопровождается меньшим числом осложнений, в частности, как правило, отсутствуют разрывы сосудов, кровотечения и эмболии.
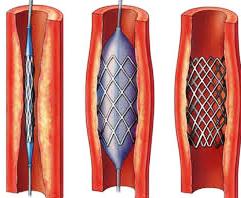
Ing и соавторы сообщили о низкой частоте рестенозов через 3 года после имплантации и высокой эффективности повторных дилатаций в 94% случаев, без осложнений. Отдаленные результаты, основанные на обширных данных, сообщили McMahon и соавторы. Были имплантированы 664 стента у 330 пациентов после коррекции тетрады Фалло, атрезии легочной артерии с ДМЖП, после операции артериального переключения при транспозиции и операции Fontan. Средний градиент систолического давления после стентирования снизился с 41 до 9 мм рт. ст., средний диаметр артерий увеличился с 5 до 11 мм. В средние сроки через 5 лет средний градиент давления составил 20 мм рт. ст., соотношение давления ПЖ/ЛЖ – 0,5 и средний диаметр просвета – 9 мм. Специалисты связывают улучшение результатов с применением методики консервативной серии дилатаций с исключением чрезмерного расширения, использование более коротких стентов, улучшенной формы баллона и расширение с начала центральной части стента.
У младенцев и маленьких детей применение этого метода ограничено из-за недостаточной гибкости стентов, узости сосудов и развития фиксированной обструкции после постановки стентов малого диаметра у растущих пациентов. Малые стенты с максимально достижимым диаметром 9-10 мм в будущем подвергают больного необходимости операции в целях расширения стентированной области. Несмотря на это, имплантации таких стентов являются жизнеспасающими в ближайшем послеоперационном периоде. Стенты большего размера можно имплантировать в операционной, для уменьшения времени легочной артериопластики и предотвращения наружного сдавления. Стенты большего диаметра, которые можно дилатировать до взрослых размеров, способствуют упрощению техники коррекции в сложных случаях.
Результаты лечения синдромов
Высокая вероятность обратимости легочной артериопатии при синдроме Williams-Beuren требует критического отношения к определению показаний для хирургического или катетерного вмешательства. В настоящее время показаниями для таких вмешательств являются системное или супрасистемное давление в правом желудочке, выраженная бивентрикулярная обструкция или наличие симптоматики при менее выраженной обструкции. Вмешательство на легочных артериях при субсистемной правожелудочковой гипертензии целесообразно как дохирургический этап лечения перед коррекцией надклапанного стеноза аорты.
При тяжелой генерализованной артериопатии, включающей периферические и центральные легочные артерии, показана дохирургическая катетерная дилатация дистальных легочных артерий с последующим хирургическим вмешательством на проксимальных легочных артериях и аорте. В отличие от дистальных сужений, которые поддаются баллонной дилатации, центральные стенозы резистентны к дилатации из-за их эластичности. У пациентов с тяжелой бивентрикулярной системной перегрузкой и генерализованной артериопатией повышен риск ишемии миокарда во время искусственного кровообращения. После устранения надклапанного стеноза аорты часто развивается недостаточность правого желудочка, поэтому рациональный подход предусматривает комбинацию дооперационного катетерного вмешательства с последующей операцией.
Результаты транскатетерных вмешательств при синдроме Williams-Beuren опубликовал и Geggel и соавторы. Успешная баллонная дилатация получена в 51% случаев. У 25 пациентов были произведены 124 дилатации во время 39 процедур. Диаметр суженых сосудов в успешных случаях увеличился на 112 ± 65%. Дилатация в артериях паренхимы легкого была более эффективной, чем в медиастинальных и в более мелких сосудах, при условии, что размер баллона превышал диаметр суженного участка в 3 и более раз. Специалисты рекомендуют серию дилатаций дистальных легочных стенозов и последующую хирургическую коррекцию проксимальных участков. У пациентов высокого риска целесообразно создать межпредсердное сообщение.
При синдроме Alagile наличие стенозов периферических легочных артерий не повлияло на исходы трансплантации печени. Смерть 5 из 17 оперированных пациентов не была связана с проблемами сердца. У 12 пациентов, выживших в сроки 6 лет после трансплантации, периферические стенозы легочных артерий клинически себя не проявляли. Во время операции трансплантации печени не были обнаружены гемодинамические нарушения даже при тяжелой форме стеноза. Поэтому трансплантация не противопоказана при высокой правожелудочковой гипертензии. Хирургическое расширение легочных артерий неосуществимо из-за диффузных дистальных сужений, а баллонная дилатация неэффективна. Опыт имплантации стентов невелик.
Несмотря на несердечные причины летальности после трансплантации печени, при синдроме Alagille госпитальная летальность все-таки выше, чем у пациентов без синдрома. По мнению Razavi и соавторов, при давлении в правом желудочке более 50% системного целесообразно произвести катетерную имплантацию стента для снижения риска недостаточности трансплантата.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии