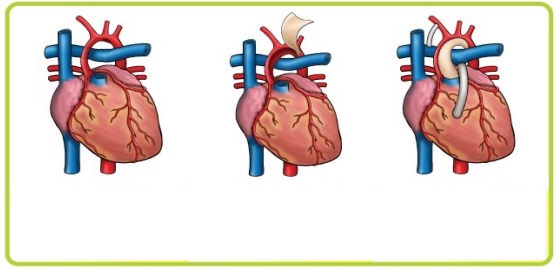
Операция Норвуда: показания, ход операции, последствия, восстановление
Ранняя выживаемость после первой стадии реконструкции СГЛОС ниже у младенцев с массой менее 2,5 кг по сравнению с детьми с нормальной массой. В настоящее время недоношенность сама по себе редко является препятствием для хирургического вмешательства. Попытки отсрочить вмешательство до тех пор, пока ребенок не наберет приемлемую массу тела, чреваты развитием обструктивных изменений в легочных сосудах, некротического энтероколита, инфекции и других осложнений скоротечного естественного течения порока. В ведущих мировых клиниках к операциям прибегают, когда масса тела ребенка превышает 1-1,2 кг.
Одной из проблем у детей малого гестационного возраста с ВПС являются большая частота кровоизлияния в желудочки мозга, чем у нормальных новорожденных. С помощью МРТ у стабильных пациентов после коррекции СГЛОС в 71% случаев обнаружили внутрижелудочковые кровоизлияния и в 45% — субдуральные. Отдаленные последствия этих находок в настоящее время не известны. При обнаружении кровоизлияний на дооперационном этапе выжидают 2 сут перед операцией в условиях искусственного кровообращения.
История хирургического лечения
Термин «гипоплазия левых отделов сердца» был введен в 1958 г. Noonan и Nadas для обозначения порока, характеризующегося недоразвитием или атрезией структур левых отделов сердца, хотя первое описание патофизиологии, появившееся еще в 1851 г., принадлежит доктору Bardeleben из Гессена. Схожесть порока с аналогичной патологией правых отделов сердца, включающей атрезию трехстворчатого и легочного клапанов, и разработка Glenn, Fontan и Kreutzer физиологической коррекции стимулировали применение этого принципа для лечения СГЛОС. Однако трудности создания беспрепятственного тока крови в аорту, обеспечения адекватного легочного и коронарного кровотока сделали вмешательства при СГЛОС гораздо более сложными.
Первая попытка лечения СГЛОС была предпринята Redo и соавторами в 1961 г. В условиях окклюзии притока через правостороннюю торакотомию была выполнена атриосептостомия. При посмертном исследовании была обнаружена атрезия аортального клапана с широким ОАП. Важный шаг сделали Sinha и соавторы, которые проанализировали аутопсии 30 случаев СГЛОС и сформулировали принципы первого этапа реконструкции. Авторы предположили, что первоочередной целью вмешательства является создание межпредсердного сообщения для свободного оттока легочной венозной крови в правые отделы сердца, обеспечение право-левого шунта на уровне магистральных артерий и суживание легочной артерии для ограничения легочного кровотока. Cayler и соавторы в Сакраменто впервые успешно применили эти принципы в клинике. Операция заключалась в суживании обеих ветвей легочной артерии, создании межпредсердного дефекта и обеспечение антеградного кровотока в аорте путем анастомозирования правой легочной артерии с восходящей аортой. В комментарии авторы предположили необходимость аортопластики для создания адекватного канала между местом легочно-аортального анастомоза и устьями коронарных артерий при выраженной гипоплазии аорты и прогнозировали существенный прогресс в этой области.
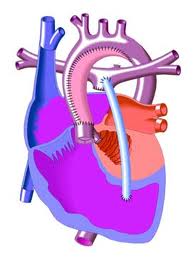
Очередной вехой на пути к современному методу лечения СГЛОС была операция, описанная Litwin, van Praagh и Bernard в 1972 г. У пациентов с перерывом дуги аорты был имплантирован сосудистый протез между легочным стволом и нисходящей аортой, а дистальные легочные артерии были сужены. Эта операция впоследствии была повторена двумя группами хирургов, однако без положительного эффекта.
Несмотря на ранние неудачные попытки паллиативной реконструкции, Doty и Knott в 1977 г. возлагали надежды на одноэтапную операцию Fontan при СГЛОС. Они описали пять закончившихся неудачей операций. В условиях гипотермической остановки кровообращения перевязывали ОАП, иссекали межпредсердную перегородку и предсердие перегораживали заплатой из аутоперикарда таким образом, чтобы легочный венозный возврат направить в трехстворчатый клапан и правый желудочек. Легочный ствол соединяли с дугой аорты с помощью дакронового сосудистого протеза, а легочные артерии анастомозировали с правым предсердием. Все больные умерли от правожелудочковой слабости и недостаточности коронарного кровотока. Стало ясно, что создание кровообращения по Fontan в неонатальном периоде не может быть успешным из-за повышенного сопротивления легочных сосудов и сложности операции. Смелые надежды и упорство авторов были вознаграждены формированием представления о безальтернативности этапного лечения этого порока.
Развитие успешного этапного лечения СГЛОС связано с именем доктора Norwood. В своем первом сообщении в 1980 г. Norwood описывал три случая начального этапа реконструкции. У первого больного был выполнен кавопульмональный анастомоз по Glenn, однако этот пациент умер через 7 дней из-за прогрессирующего ацидоза. Двое последующих новорожденных подвергнуты модифицированной операции Litwin c использованием клапанного кондуита между правым желудочком и нисходящей аортой и суживанием дистальных легочных артерий. Оба пациента выжили и были выписаны из госпиталя в удовлетворительном состоянии. В этой статье Norwood предложил конфигурацию второго этапа лечения, который, по его мнению, должен был состоять в разделении системного и легочного кругов кровообращения с максимальным использованием собственных тканей. Физиологическая коррекция атрезии аорты на втором этапе должна была предусматривать анастомозирование проксимальной легочной артерии и устья правой ветви легочной артерии с гипоплазированной восходящей аортой, чтобы создать связь правого желудочка с аортой исключительно с помощью собственных тканей. Одновременно предполагалось иссечь кондуит. Затем пересеченную правую легочную артерию следовало анастомозировать с верхней полой веной по Glenn, а левую легочную артерию реконструировать с помощью клапанного кондуита. Это было первым указанием на необходимость реконструкции аорты собственными тканями. Вариант этой техники был описан Behrendt и Rocchini.
При множестве предложенных вариантов первой стадии реконструкции только заключительный этап лечения — операция Fontan — определяет отдаленный результат всей системы лечения. Первый успешный результат этапного лечения сообщили Norwood, Lange и Hanson в 1983 г. В настоящее время описанному в этой работе пациенту более 20 лет. У него диагностированы хроническая энтеропатия с потерей белка и предсердные нарушения ритма. Методы первого этапа лечения СГЛОС эволюционировали в направлении ограничения использования инородных материалов и сокращения продолжительности гипотермической остановки кровообращения.
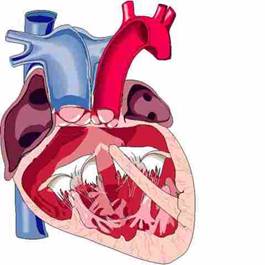
Операция Norwood предусматривает:
-
создание свободного и постоянного выхода в системный круг кровообращения;
-
обеспечение стабильного и контролируемого источника легочного кровообращения;
-
создание широкого сообщения на предсердном уровне.
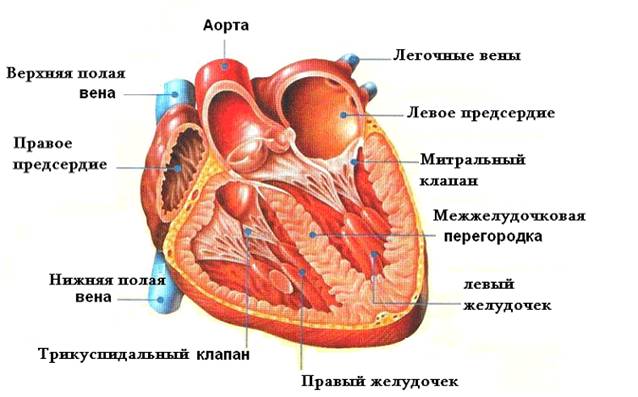
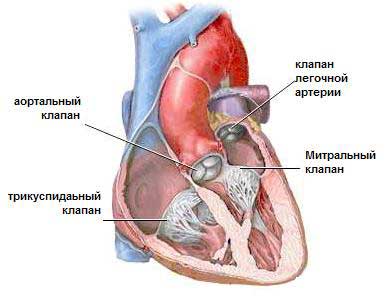
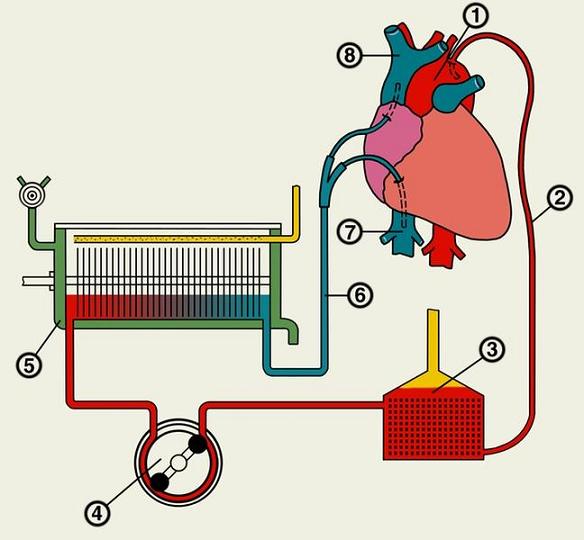
Выход в системный круг создают с помощью модифицированной операции Damus-Kaye-Stansel в сочетании с реконструкцией гипоплазированной восходящей аорты, дуги и перешейка аорты лоскутом из легочного гомографта. Ткань протока радикально резецируют для предупреждения рекоарктации. Легочное кровообращение осуществляется через модифицированный анастомоз Blalock-Taussig между основанием безымянной или подключичной артерии и правой легочной артерией. Отверстие в бифуркации легочной артерии рутинно закрывают заплатой или ушиванием в поперечном направлении для устранения вероятности развития сужения легочной артерии в отдаленном периоде.
Из-за отсутствия роста чужеродного материала, его деформации по мере увеличения массы тела и ограниченной доступности гомографтов Brawn и соавторы модифицировали коррекцию дуги аорты следующим образом: иссекали ткань протока и анастомозировали нисходящую аорту с дугой аорты, которую открывали с переходом на восходящую аорту. Затем в разрез аорты вшивали проксимальный конец легочного ствола. Таким образом, процедура Damus-Kaye-Stansel увеличила проходное сечение аорты. Размер системно-легочного шунта оптимизировали в ходе накопления клинического опыта. Большинство хирургов отказались от 4-мм протеза в пользу 3,5-3,0-мм. Из клинического опыта и ошибок выяснилось, что главным принципом ведения этих пациентов является поддержание сбалансированного кровотока в легочном и системном кругах кровообращения. Слишком большой шунт и, следовательно, легочный кровоток сопровождается утечкой крови из коронарных артерий и гипоксической дисфункцией миокарда, чреватой смертельным исходом. Некоторые специалисты связывают неудачи не с высокой сатурацией артериальной крови как признака легочной гиперволемии, а с гипоксемией, ответственной за малый сердечный выброс. Однако гемодинамика при меньшем системно-легочном анастомозе лучше управляема, несмотря на выраженную гипоксию в ближайшем послеоперационном периоде. Некоторые хирурги, использовавшие больший шунт, пытались регулировать легочный кровоток вентиляцией гипоксической газовой смесью. Недавно установлено, что снижение насыщения легочной венозной крови в раннем периоде после операции Norwood влияет на степень гипоксемии. Показано также, что анаэробный порог достигается, когда сатурация системной венозной крови ниже 30%, и что попытки поднять насыщение крови кислородом в верхней полой вене выше этого порога приводят к снижению летальности. Применение регулирующего турникета для управления объемом легочного кровотока было признано полезным. Оксигенация системной артериальной крови после операции Norwood зависит от ряда физиологических и анатомических факторов, среди них — состояние легочного сосудистого русла и размер межпредсердного сообщения.
Избыточный легочный кровоток при больших размерах шунта увеличивает объемную работу левого желудочка в условиях малого сердечного выброса, сниженного диастолического давления в аорте и неадекватной коронарной перфузии. Это является причиной смерти. Некоторые хирурги предлагали использовать гомографт подкожной вены бедра в качестве шунта, так как он ограничивает объем кровотока без риска тромбоза.
Пациентам с тяжелым клапанным стенозом легочной артерии, выраженной врожденной органической недостаточностью трехстворчатого клапана и односторонней гипоплазией легочной артерии не может быть предложена этапная одножелудочковая коррекция.
Одновременно с процессом усовершенствования операции Norwood в Бостоне, а затем и в Филадельфии, где он продолжил работу, многие другие центры также начали осуществлять паллиативные операции, но с неудовлетворительными результатами. Возникли сомнения в целесообразности этого подхода. Вследствие плохих хирургических результатов некоторые врачи советовали оказывать только сострадательную помощь. В 1983 г. Norwood и его сотрудники сообщили в New England Journal of Medicine об успешном этапном лечении детей с атрезией аорты, заключительным этапом которого была операция Fontan. Эта работа возродила интерес к спасению детей со СГЛОС. Среди других подходов к лечению в 1985 г. была предпринята попытка трансплантации сердца бабуина новорожденному со СГЛОС, но ребенок не выжил. Тем не менее, этот опыт открыл эру трансплантации сердца у детей со СГЛОС. Впервые пересадку донорского человеческого сердца при данном пороке произвели Bailley и сотрудники в Лома Линда. С конца 1980-х годов в одних центрах предпочитали реконструкцию по Norwood, в других — неонатальную аллотрансплантацию сердца или то и другое. Некоторые авторы считали, что оба подхода противоречат медицинской этике.
Усовершенствование операции Norwood по времени совпало с повсеместным накоплением опыта операции Fontan при различных ВПС. Были выполнены многие исследования после первой стадии этапного лечения. Они пролили свет на состояние реконструированной восходящей арты, адекватность коррекции дистальной дуги и коарктации, на проблему остаточной или возникшей обструкции легочных артерий и достаточности размеров ДМПП. Был проявлен интерес к функции правого желудочка и влиянию недостаточности трехстворчатого клапана на краткосрочные и среднесрочные исходы. Эти исследования способствовали уточнению и модификации хирургической техники и постепенному улучшению хирургических результатов. Были применены различные приемы для улучшения хирургических результатов, включая фенестрацию внутрипредсердного туннеля при операции Fontan с последующим закрытием отверстия. Установлен факт улучшения суммарных результатов путем применения этапных вмешательств для достижения полной коррекции гемодинамики по Fontan, поэтому хирургическое лечение СГЛОС стало трехэтапным. Промежуточной операцией является двунаправленное кавопульмональное соединение или hemi- Fontan с коррекцией сопутствующих анатомических аномалий, повышающих риск неблагоприятных результатов. Этапное лечение разгружает системный правый желудочек, улучшает его форму, снижает тенденцию к развитию недостаточности трехстворчатого клапана и улучшает коронарный кровоток. Однако необходимость этапных вмешательств разделяют не все.
Техника первого этапа хирургического лечения по norwood
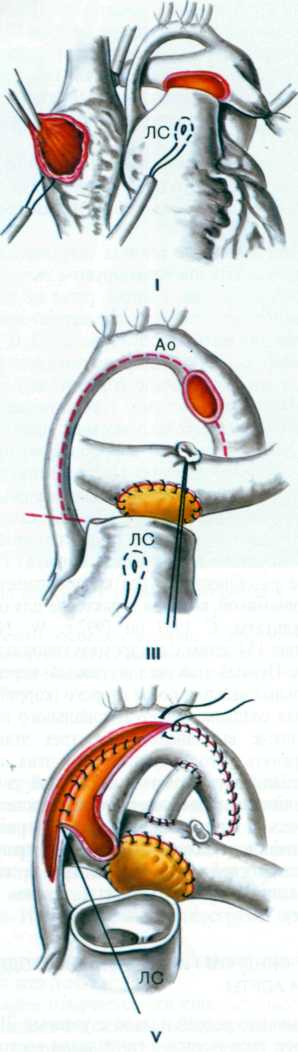
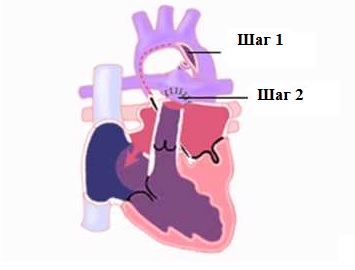
Классическую операцию Norwood выполняют через срединную стернотомию. Из-за выраженной дилатации правый желудочек крайне возбудим, поэтому манипуляции должны быть осторожными, чтобы не вызвать фибрилляции во время выделения структур сердца. Очень тонкую восходящую аорту отделяют на всем протяжении от легочного ствола и его правой ветви. Затем мобилизуют дугу, ее ветви и нисходящую аорту дистальнее боталлова протока, избегая прямого натяжения рыхлой ткани протока, из которого легко может возникнуть кровотечение. Выделяют бифуркацию легочной артерии и ее ветви обводят тесемками, предназначенными для прекращения легочного кровотока во время фазы охлаждения искусственного кровообращения. Накладывают кисетные швы для канюляции на легочный ствол у бифуркации и ушко правого предсердия.
После гепаринизации канюлируют легочный ствол и правое предсердие, начинают искусственное кровообращение при пережатых ветвях легочной артерии, больного охлаждают до назофарингеальной температуры 18 0С. Во время охлаждения сосудистым зажимом отжимают основание безымянной артерии и выполняют проксимальный анастомоз с сосудистым протезом из GorеTex диаметром 3,5-4 мм, снимают сосудистый зажим, чтобы убедиться в хорошей проходимости центрального анастомоза. Сосудистый протез пережимают скобкой на время выполнения дальнейших этапов операции и останавливают кровообращение при температуре 18 0С. Дальнейшую операцию можно проводить в условиях регионарной перфузии сосудов дуги со сниженной объемной скоростью 10 мл/кг/мин. Для этого артериальную канюлю удаляют и вводят ее в сосудистый протез.
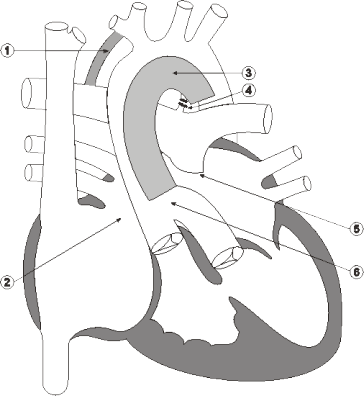
Линию для проведения кардиоплегии подсоединяют к боковому патрубку артериальной канюли. Сосуды дуги аорты обтягивают турникетами, а нисходящую аорту дистальнее артериального протока пережимают сосудистым зажимом. Вводят кардиоплегический раствор ретроградно в дугу аорты и общую коронарную артерию. Затем обе канюли и тесемки на ветвях легочной артерии удаляют.
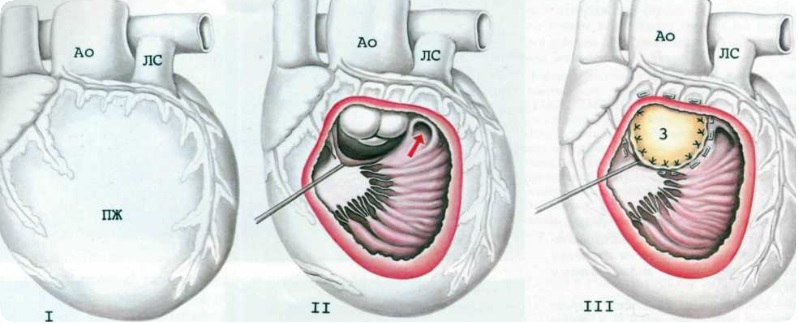
Основной этап операции начинают с перевязки и пересечения артериального протока у аортального конца. Через отверстие для венозной канюли иссекают межпредсердную перегородку для создания широкого межпредсердного сообщения. Затем поперечно пересекают легочный ствол на уровне правой легочной артерии, оставляя с левой стороны несколько больший участок стенки легочного ствола. Если легочные артерии широкие, бифуркацию закрывают прямым ушиванием, при узких ветвях используют заплату из лоскута гомографта. После реконструкции бифуркации тщательно выполняют дистальный анастомоз сосудистого протеза с разрезом устья правой легочной артерии, стараясь не вызвать ее деформации. Для облегчения экспозиции восходящую аорту оттягивают медиально. Далее продольно рассекают левую стенку восходящей аорты, начиная разрез на уровне пересечения проксимальной легочной артерии. Разрез продлевают на дугу, перешеек и нисходящую аорту дистальнее места отхождения протока.
Ткань протока максимально удаляют и иссекают уступ коарктации. В проксимальной легочной артерии делают короткий вертикальный надрез напротив нижнего конца разреза восходящей аорты. Соединение восходящей аорты с легочным стволом начинают с проксимального конца разреза отдельными швами, чтобы избежать сужения входа в общую коронарную артерию. Для реконструкции дуги используют лоскут из стенки легочного гомографта. Форма заплаты сложная, она не должна быть избыточной, так как под воздействием систолического давления заплата скручивается вправо вместе с устьем безымянной артерии, создавая препятствие току крови в шунт и сосуды головы. Избыточная заплата может также перекрутить нисходящую аорту, создавая обструкцию дистальной дуги аорты. В любом случае избыточная заплата хуже, чем узкая.
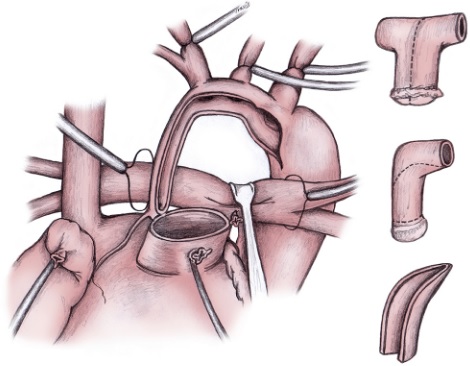
Задняя линия шва короче передней, поэтому нижний край заплаты выкраивают таким образом, чтобы спереди она была длиннее. Ширина и длина заплаты должна точно совпасть с конфигурацией естественных сосудов, иначе могут возникнуть недостаточность клапана и перегиб неоаорты. Необходимо учесть индивидуальный вариант СГЛОС, так как аорта шире при стенозе, чем при атрезии клапана, или когда дуга аорты хорошо развита и избыточная заплата может стать причиной ее перегиба.
В окончательном виде операции Norwood I расширенная с помощью гомографта аорта соединена с центральным концом легочного ствола. Этим достигается свободный выход из функционально единственного правого желудочка через легочный клапан в аорту и системное артериальное русло. Легочное кровообращение осуществляется через модифицированный анастомоз по Blalock-Taussig.
После завершения реконструкции аорты эвакуируют воздух из сердца, заполняя солевым раствором места канюляции предсердия и аорты, производят реканюляцию неоаорты и правого предсердия, восстанавливают перфузию и начинают согревание. Убедившись в том, что перфузия и функция миокарда удовлетворительны, больного согревают до 37 0С и начинают вентиляцию легких с большим дыхательным объемом для устранения ателектазов и снижения ЛСС. Затем снимают клемму с анастомоза и останавливают насос. Значительная дилатация сердца на этой стадии может быть следствием деформации и недостаточности клапана, которые требуют соответствующей коррекции. После удаления венозной канюли катетер для мониторирования центрального венозного давления и восполнения объема жидкости проводят через грудную стенку и ушко правого предсердия, контролируемое кисетным швом.
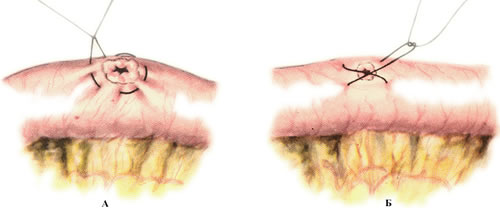
В соответствии с современной методикой проведения искусственного кровообращения и постперфузионного периода применяют модифицированную ультрафильтрацию для уменьшения отека миокарда и тканей и ведут пациента на низких дозах допамина одновременно с инфузией ингибитора фосфодиэстеразы, периферического вазодилататора для уменьшения системного сосудистого сопротивления и улучшения функции правого желудочка в раннем послеоперационном периоде. Контроль за поддержанием системной перфузии и снижение сопротивления периферических артерий являются принципиально важными условиями, так как в противном случае увеличивается шунтовой ток и возникает миокардиальная дисфункция.
В большинстве случаев при применении модифицированной ультрафильтрации удается закрыть грудную клетку без угрозы ухудшения функции сердца. При наличии кровоточивости и сомнениях в адекватности функции миокарда грудную клетку оставляют открытой, временно герметизируя рану листовым GoreTex или ксеноперикардом, фиксируя их к коже. Грудину сшивают после стабилизации гемодинамики. Необходимость отсроченного стягивания грудины или позднего открытия ее в послеоперационном отделении в клиниках, обладающих большим опытом коррекции СГЛОС, возникает менее чем у 15% пациентов.
Варианты оперативной техники первого этапа коррекции СГЛОС
При особенно узкой восходящей аорте вовлечение ее в качестве части стенки неоаорты, образованной преимущественно гомотрансплантатом, нецелесообразно, поэтому ее можно оставить in situ или пересечь косо и имплантировать в бок цилиндрического гомолегочного кондуита.
Если аорта и легочная артерия транспонированы и находятся в сагиттальной плоскости, или же аорта соизмерима с легочной артерией, проще реконструировать дугу путем пересечения обоих магистральных сосудов проксимально и соединения их «бок в бок» на небольшом протяжении с последующим расширением дуги и дистальной аорты треугольной заплатой из гомографта, а затем анастомозировать дистальный конец аорты с образованной «двустволкой». В результате образуется выход из обоих желудочков в единую аорту. Этот метод исключает искривление и скручивание реконструируемой дуги и серьезную дилатацию просвета аорты, которая могла бы сдавить левую легочную артерию, расположенную позади неоаорты.
Последние модификации первой стадии коррекции СГЛОС предполагают исключение использования инородных тканей для реконструкции дуги. Эта техника, впервые предложенная Brawn, Mee и соавторами, предусматривает прямое соединение проксимальной легочной артерии с нижней поверхностью дуги аорты. Упрощение техники и исключение инородных тканей сделало эту модификацию операцией выбора во многих центрах. Однако Scheeve считает, что при прямом соединении легочного ствола с дугой аорты уменьшается пространство для роста легочных артерий и последующей их реконструкции во время операции hemi-Fontan.
Важным условием выполнения этой операции является необходимость хорошей мобилизации сосудов дуги, чтобы не было натяжения дуги аорты, которая может сдавливать главный левый бронх. Восходящая аорта может приобрести избыточную длину и перегнуться. Чтобы избежать этого осложнения, Mee и соавторы предложили пересекать крошечную восходящую аорту и реимплантировать ее непосредственно в переднебоковую стенку легочной артерии. При наличии выраженной коарктации аорты суженный сегмент вместе с тканью протока должны быть полностью иссечены и дистальный конец аорты должен быть анастомозирован с будущей неоаортой перед реконструкцией дуги.
Новейшей модификацией первого этапа коррекции СГЛОС, быстро завоевавшей популярность во многих центрах, является описанная Sano и соавторами замена анастомоза Blalock-Taussig на сосудистый шунт между инфундибулярным отделом правого желудочка и бифуркацией легочной артерии с помощью 5-мм сосудистого протеза GoreTex. До выполнения реконструкции дуги отверстие в бифуркации ушивают, в зависимости от размеров легочных артерий, продольно или поперек, оставляя отверстие для анастомозирования дистального конца сосудистого протеза. Для расширения легочной артерии протез может быть предварительно вшит в отверстие лоскута перикарда, которым закрывают дефект бифуркации, образовавшийся в после отсечения легочного ствола. Проксимальный конец протеза соответствующей длины обрезают под углом и оставляют свободным. После завершения реконструкции аорты делают короткий вертикальный разрез в инфундибулярной части правого желудочка. Иссекают небольшое количество миокарда из краев отверстия и выполняют проксимальный анастомоз непрерывным швом. Длина трубки должна быть рассчитана точно с учетом возможности возникновения натяжения после наполнения желудочка кровью.
Потенциальным преимуществом этого метода является более стабильное послеоперационное течение. Оно объясняется тем, что легочный кровоток имеет пульсирующий систолический, а не непрерывный характер. Отсутствие диастолической утечки крови из большого круга кровообращения и в связи с этим более высокое диастолическое давление улучшают коронарную перфузию. Сатурация артериальной крови выше при данной модификации, однако, это не является угрожающим признаком избыточной утечки крови в легкие, что характерно при классической операции Norwood, и хорошо переносится. Пульсирующий кровоток способствует росту легочных сосудов, что важно перед предстоящей второй стадией лечения — кавопульмональным анастомозом.
Недостатком модификации Sano является необходимость разреза миокарда правого желудочка, который может в последующем ухудшить его функцию как системного желудочка, а также вероятность сужения шунта в месте отхождения от правого желудочка вследствие гипертрофии его стенки. Многоцентровое накопление опыта позволит установить, улучшает ли исходы и снижает ли летальность данная методика на этапах хирургического лечения.
Первый этап коррекции СГЛОС без полной остановки кровообращения
Реконструкция гипоплазии дуги предусматривает необходимость остановки кровообращения при глубокой гипотермии. В настоящее время отмечается тенденция к отказу от остановки кровообращения в пользу постоянной перфузии мозга с низким объемом кровотока без прямой канюляции сосудов дуги. При СГЛОС восходящая аорта обычно слишком узка для канюляции. Перфузию мозга проводят ретроградно через предварительно выполненный модифицированный анастомоз.
Последовательность операции такова. После наложения анастомоза легочные артерии обжимают тесемками для предупреждения утечки крови в легочную артерию и обеспечения стабильного системного и коронарного кровотока. Канюлируют боталлов проток и полые вены. Перед началом перфузии обжимают турникетом проксимальную часть протока и анастомоз. Начинают перфузию. Во время охлаждения пересекают легочный ствол и дистальный конец его закрывают заплатой из легочного гомографта. При достижении глубокой гипотермии аортальную канюлю направляют в сторону легочной артерии, тесьму на протоке смещают дистально. Открывают анастомоз — начинается перфузия мозга из легочной артерии с объемом кровотока, составляющим 30% нормального. Дугу аорты изолируют, обтягивая тесемками проксимальную часть безымянной артерии, левую сонную и подключичную артерии, пережимают нисходящую аорту. Мониторируют артериальное давление на правой лучевой артерии для предупреждения повреждения мозга. Венозный возврат осуществляют через канюлю в правом предсердии или с помощью активного отсоса из правого предсердия. После выполнения основного этапа операции Norwood артериальную канюлю переставляют в неоаорту, пережимают анастомоз и открывают нисходящую аорту и сосуды дуги. Боталлов проток легируют, удаляют тесемки с ветвей легочной артерии. Больного согревают и отключают АИК.
Некоторые хирурги используют прямое канюлирование левой сонной артерии для обеспечения системного кровообращения и изолированной перфузии мозга на этапе реконструкции дуги. На артерию накладывают кисетный шов овальной формы. Артериальная канюля 6 Fr или 8 Fr не должна упираться в заднюю стенку или быть проведена слишком глубоко для исключения дисбаланса перфузии. После начала искусственного кровообращения артериальный проток дважды перевязывают и пересекают. Во время охлаждения легочный ствол пересекают, как при классической операции Norwood, выполняемой в условиях остановленного кровообращения. Дефект бифуркации ушивают непрерывным рассасывающимся швом 7/0. После достижения заданной температуры аорту пережимают проксимальнее безымянной артерии и вводят кардиоплегический раствор в восходящую аорту. Проксимальную восходящую аорту рассекают книзу и нижний угол разреза несколькими витками сшивают с «пеньком» легочного ствола проленовым швом 7/0, ориентируясь на швы-держалки, предварительно наложенные на восходящую аорту и легочный ствол. Затем накладывают сосудистый зажим параллельно дуге аорты на основание левой сонной и безымянной артерий. Этим же или дополнительным зажимом перекрывают левую подключичную артерию. Отдельным зажимом пережимают нисходящую аорту дистальнее артериального протока. Объемную скорость перфузии снижают до 10-30 мл/кг/мин. Предварительно сделанный разрез восходящей аорты продлевают дистально на дугу, через область протока и на 5—10 мм в нисходящую аорту. Аорту реконструируют заплатой, как при традиционной операции Norwood. После завершения реконструкции аорты снимают все зажимы, увеличивают объем перфузии и начинают согревание. В этот период конструируют системно-легочный анастомоз обычным способом.
Атрезия аорты с ДМЖП: модифицированная одноэтапная бивентрикулярная коррекция в неонатальном периоде
Среди вариантов СГЛОС в 4-6% случаев встречается атрезия аорты с большим ДМЖП и двумя хорошо развитыми желудочками. Лечение этой аномалии первоначально предусматривало конверсию двухжелудочкового сердца в функционально единственный правый желудочек путем этапного лечения по методу Norwood. Работа Freedom и соавторов показала, что бивентрикулярная коррекция является теоретически возможной хирургической альтернативой. Эта идея вначале реализовалась в клинической практике в виде двухэтапного лечения. Первое паллиативное вмешательство выполняли в первые месяцы жизни, а завершение лечения откладывали на более поздний период. В последующем была предложена одноэтапная бивентрикулярная коррекция с использованием одного или двух кондуитов — для реконструкции аорты с помощью легочного ствола и протезирования легочной артерии, с вытекающими осложнениями, связанными с применением кондуитов в неонатальном возрасте. Первое описание одноэтапной коррекции атрезии аорты с нормальным левым желудочком и митральным клапаном у новорожденного было представлено группой хирургов из Бостона. Авторы признавали, что необходимость последующей замены кондуитов значительно снижает достоинства предложенной ими наиболее физиологичной двухжелудочковой одномоментной коррекции.
Вследствие высокого риска летального исхода при одномоментной коррекции в неонатальном периоде многие клиники продолжают использовать операцию Norwood как первый этап на пути создания одножелудочкового кровообращения по принципу Fontan. Очевидно, что два хорошо сформированных желудочка, нагнетающих кровь в большой круг кровообращения, обеспечивают достаточный сердечный выброс, что увеличивает безопасность операции Norwood.
Jacobs и соавторы предположили возможность конверсии в бивентрикулярное кровообращение в более старшем возрасте, заметив, что операция Norwood в неонатальном периоде не исключает вероятности последующей бивентрикулярной коррекции. Единственным теоретическим недостатком этой тактики является возможность повышения ЛСС после системно-легочного анастомоза.
Следующим шагом при попытках двухжелудочковой коррекции явилось использование операции Lecompte как альтернативы кондуитам. Она представляет собой транслокацию собственного легочного ствола на переднюю стенку правого желудочка.
Операция Lecompte была впервые описана в 1982 г. как дополнение к резекции перегородки при коррекции классической ТМА с ДМЖП и СЛА. Впоследствии REV применялась при коррекции и других аномалий вентрикулоартериального соединения. Она позволяет создать связь правого желудочка с легочной артерией без кондуита.
Приводим методику одноэтапной бивентрикулярной коррекции с использованием элементов операции Lecompte в описании Black и соавторов. Искусственное кровообращение осуществляют через легочную артерию при пережатых ветвях с дренированием обеих полых вен. После начала перфузии дренируют левые отделы сердца катетером, проведенным через устье правой верхней легочной вены. Больного охлаждают до 18 0С. Во время охлаждения выделяют и мобилизуют магистральные сосуды, включая все брахиоцефальные ветви. Обе легочные артерии мобилизуют до корней легких. По достижении глубокой гипотермии пережимают нисходящую аорту и брахиоцефальные сосуды и вводят кардиоплегический раствор в легочный ствол. Останавливают артериальный насос и опустошают сосудистое русло через венозные катетеры. Пересекают легочный ствол непосредственно в месте его деления на ветви. Лигируют и пересекают ОАП. Выполняют маневр Lecompte. Иссекают остатки ткани протока. Рассекают поперечную часть дуги аорты по ее нижней поверхности. Легочный ствол анастомозируют с нисходящей аортой и поперечной частью дуги по методике Bu'Lock и соавторов и Fraser и Mee. Таким образом, гипоплазия дуги и коарктация аорты устраняются собственной тканью. Накладывают швы-метки у комиссур клапана легочного ствола. Удаляют воздух из аорты и реканюлируют легочную артерию, которая теперь стала проксимальной неоаортой. Тесемки на сосудах дуги удаляют.
Больного согревают до 25 0С. Восходящую аорту пересекают у места ее перехода в поперечную часть. Дистальный конец перевязывают. В проксимальный конец аорты вводят следующую дозу кардиоплегического раствора и анастомозируют его с проксимальной неоаортой «конец в бок». Для этого в ней делают отверстие с помощью коронарного перфоратора диаметром 3 мм. Предварительно наложенные швы-метки позволяют избежать повреждения клапана. Анастомоз выполняют при боковом отжатии неоаорты проленовой нитью 8/0. Открытое овальное окно, расширенное до операции с помощью процедуры Rashkind, восстанавливают до исходных размеров доступом через правое предсердие.
Доступом через поперечную вентрикулотомию отводят устье неоаорты через ДМЖП в левый желудочек с помощью заплаты. Полоской перикарда укрепляют эпикардиальную поверхность верхнего края разреза правого желудочка для обеспечения надежности анастомоза дистальной легочной артерии с правым желудочком.
Бивентрикулярная коррекция атрезии аорты с ДМЖП в неонатальном периоде потенциально имеет ряд существенных преимуществ. Она призвана обеспечить бивентрикулярное кровообращение, предупредить развитие обструктивной болезни легочных сосудов, устранить объемную перегрузку и связанную с ней гипертрофию желудочков при межсосудистых анастомозах, а также необходимость применения и замены кондуитов по мере роста массы тела и развития обструктивных изменений в них. Приведенные ожидаемые преимущества этого типа операций перед многоэтапной одножелудочковой или одномоментной двухжелудочкой коррекцией с помощью кондуитов еще не проверены временем.
Гибридная операция
Хирургическое лечение СГЛОС по Norwood остается несовершенным. Нынешний энтузиазм, связанный с использованием кондуита между правым желудочком и легочной артерией вместо модифицированного анастомоза по Blalock-Taussig во время операции Norwood, существенно не повлиял на выживаемость больных.
Альтернативой традиционному методу коррекции гемодинамики при этом пороке является недавно разработанная гибридная технология. Ее первичная цель — обеспечение стабильной, сбалансированной гемодинамики без рискованных для новорожденного факторов, таких, как искусственное кровообращение, пережатие аорты, остановка кровообращения. Сложная операция на открытом сердце может быть смещена на более поздний период, когда создается последовательное кровообращение с помощью кавопульмонального анастомоза. Операция выполнима у пациентов без эхокардиографических признаков препятствия ретроградному кровотоку в поперечную аорту из артериального протока. Обычно у детей с СГЛОС даже в случаях атрезии аорты поперечная дуга аорты имеет адекватные размеры. Сужение в области поперечной дуги встречается приблизительно у 10% больных, которым гибридная операция противопоказана.
Первый этап гибридной операции
Целями первого этапа паллиативной гибридной операции являются:
-
обеспечение не лимитированного во времени свободного выброса в большой круг кровообращения через артериальный проток;
-
создание сбалансированного легочного и системного кровотока и нерестриктивного сообщения на предсердном уровне.
Срединным доступом суживают ветви легочной артерии. Тесемки в виде 1-2-мм колец формируют из 3,5-мм сосудистого протеза из GoreTex. Для пациентов массой менее 2,5 кг используют трубку диаметром 3 мм. Тесьму на левой ветви располагают непосредственно у места ее отхождения от ствола. Правую тесьму фиксируют между восходящей аортой и верхней полой веной. Тесемки фиксируют к адвентиции. Степень сужения зависит от массы тела пациента, калибра ветвей легочной артерии, изменения артериального давления и насыщения артериальной крови кислородом. Обычно систолическое артериальное давление повышается на 10 единиц, и также на 10 единиц снижается артериальная сатурация. Для стабилизации гемодинамики и создания сбалансированного легочного и системного кровотока в первую очередь производят суживание легочных артерий. Затем через стенку легочного ствола под ангиографическим контролем стентируют артериальный проток. Стент должен перекрывать проток на всю его длину.
Перед выпиской из клиники выполняют как отдельную процедуру баллонную атриосептостомию, когда градиент давления между предсердиями по ЭхоКГ превышает 8 мм рт. ст. Отсрочка этой процедуры позволяет создать широкое сообщение большим баллоном.
Перед вторым этапом необходим эхокардиографический контроль для своевременной диагностики уменьшения межпредсердного сообщения и ухудшения проходимости ОАП. Признаками этих изменений являются снижение фракции выброса правого желудочка или увеличение регургитации на трехстворчатом клапане.
Окончательный, второй этап операции
Операцию выполняют в условиях искусственного кровообращения. Она состоит из нескольких элементов: иссечения содержащего стент ОАП, удаления тесемок на легочных артериях, пластики дуги аорты и легочных артерий, пересечения крохотной восходящей аорты с реимплантацией ее в легочный ствол, анастомозирования последнего с реконструированной аортой, предсердной септостомии и создания двунаправленного кавопульмонального анастомоза.
Операцию выполняют в условиях искусственного кровообращения при пережатой аорте. В связи с благоприятной анатомией дуги аорты нет необходимости в остановке кровообращения, так как поперечная аорта имеет достаточные размеры. Это позволяет провести канюлю в безымянную артерию и выполнить реконструкцию дуги, не прибегая к остановке кровообращения.
Артериальный проток полностью удаляют и реконструируют дугу аорты заплатой из легочного гомографта. Расширения суженного участка правой легочной артерии достигают за счет выполнения кавопульмонального анастомоза на месте тесьмы. Сужение левой легочной артерии устраняют заплатой из аутоперикарда. Необходимость в этом возникает у половины пациентов.
Госпитальная выживаемость после первого этапа лечения составила 97,5%. Между первым и вторым этапом умерли 2 пациента, 3 пациента умерли в госпитальном периоде после второго этапа, 1 — умер между вторым и третьим этапом. Пятерым пациентам потребовалось стентирование левой легочной артерии, 15 — перенесли операцию Fontan и 17 — ожидают окончательной операции. Общая выживаемость в группе оперированных авторами детей составила 82,5%. Гибридная операция характеризовалась меньшей частотой отсроченного закрытия стернотомии, правожелудочковой недостаточности и отсутствием необходимости в ЭКМО. Отсрочка основного этапа операции позволяет применить искусственное кровообращение у ребенка с более развитым мозгом и в результате снизить частоту неврологических осложнений.
Интенсивная терапия в операционной
В течение заключительного этапа искусственного кровообращения проводят инфузию милринона в дозе 0,5-1,0 мкг/кг/мин и модифицированную ультрафильтрацию для гемоконцентрации и удаления излишка воды. После этого пациента отлучают от АИК. Правое ушко канюлируют двумя-тремя катетерами, которые выводят наружу. Инотропную поддержку начинают с постоянной инфузии допамина и корригируют дозу по мере необходимости. Возобновляют механическую вентиляцию с дыхательным объемом 15-20 мл/кг и положительным давлением на вдохе 3-5 мм рт. ст. Фиксируют два предсердных и два желудочковых временных электрода. В отдельных случаях при наличии выраженного отека миокарда, нестабильности гемодинамики, кровотечения или необходимости механической поддержки кровообращения рану не закрывают, пришивая лоскут листового синтетического или ксеноматериала к коже. После стабилизации гемодинамики больного транспортируют в отделение интенсивной терапии.
Лечение в отделении интенсивной терапии
Раннее послеоперационное лечение основано на патофизиологических особенностях вновь созданной модели кровообращения.
Главной задачей является максимальное увеличение доставки кислорода — доля экстракции. Она является функцией системной потребности в кислороде, объема системного кровотока и содержания кислорода в артериальной крови, которое зависит от гематокрита и процента оксигемоглобина.
У больных с бивентрикулярным кровообращением потребность в кислороде, объем системного кровотока, содержание кислорода в крови и способность тканей экстрагировать кислород крови являются основными показателями, определяющими эффективную доставку кислорода. Однако у больных с одножелудочковым кровообращением параллельное обеспечение легочного и системного кровотока, а также объем регургитации потенциально затрудняют эффективную системную доставку кислорода. У послеоперационных больных с функционально единственным желудочком и системно-легочным артериальным шунтом соотношение Qл/Qс является важным фактором в оптимизации доставки кислорода. Хотя математические расчеты предсказали оптимальную доступность кислорода при соотношении Qл/Qс < 1, модели, которые учли нелинейную функцию экстракции, а также более сложные компьютерные методы моделирования и исследования на животных показали, что оптимальная доставка кислорода происходит при Qл/Qс приблизительно равном 1. Важно отметить, что эти теоретические модели не учитывают, во-первых наличия общего сердечного выброса, во- вторых, соотношения Qл/Qс, в-третьих, потребления кислорода и, наконец, в-четвертых, концентрации гемоглобина. Кроме того, соотношение Qл/Qс рассчитывают с допущением, что венозная кровь полностью смешанная, чего в реальности не бывает, а также часто не принимают во внимание значительную регургитацию на трехстворчатом клапане.
С точки зрения регуляции легочного кровотока сопротивление системно-легочного шунта является наиболее важным фактором, который можно контролировать. В физиологических пределах сердечного выброса изменения диаметра шунта, длины и локализации оказывают значительно большее влияние на легочный кровоток, чем фармакологические средства и регуляция параметров вентиляции.
После первой стадии паллиативной операции Norwood последующее вмешательство обычно предпринимают в 4-6-месячном возрасте, поэтому нет смысла создавать анастомоз, удовлетворяющий старших младенцев. Обычно используют сосудистый протез 3,5-4 мм между проксимальной частью подключичной артерии и правой легочной артерией. Шунт этих размеров создает достаточное сопротивление кровотоку для предупреждения легочного «обкрадывания» в раннем послеоперационном периоде и обеспечивает приемлемую системную оксигенацию до 6-месячного возраста. Диаметр подключичной артерии у новорожденных меньше 3,5 мм и постепенно растет с увеличением возраста ребенка.
В большинстве случаев совокупный сердечный выброс и системная экстракция кислорода являются наиболее важными, наиболее вариабельными и наиболее управляемыми детерминантами системной доставки кислорода в раннем послеоперационном периоде. Следует иметь в виду, что сопротивление системных артерий, соотношение Qл/Qс и потребление кислорода легче поддаются регуляции, чем ЛСС.
У новорожденных и младенцев, подвергшихся бивентрикулярной коррекции ВПС в условиях искусственного кровообращения, обычно наблюдается падение сердечного выброса с одновременным увеличением сопротивления системных и легочных артерий в течение первых 6-18 ч после удаления аортального зажима. Сердечный выброс максимально снижается в среднем на 32% через 9-12 ч после открытия аорты, постепенно нормализуясь при постоянном уровне инотропной поддержки и снижении постнагрузки. Давление наполнения желудочка и системное артериальное давление обычно регулируют с помощью фармакологических средств и поддержания водного баланса. Снижение сердечного выброса приводит к увеличению артериовенозной разницы по кислороду как при бивентрикулярном, так и при одножелудочковом кровообращении.
Послеоперационное ведение направлено на увеличение эффективной доставки кислорода и снижение потребности в нем. Важным средством достижения последней цели является предупреждение чрезмерной и часто неэффективной метаболической активности и нейрогормонального ответа на стресс, который обычно наблюдается в раннем послеоперационном периоде. Ключевыми компонентами этой стратегии являются нейромышечная блокада и седация с применением инфузии панкурониума и фентанила. Панкурониум увеличивает частоту сердечных сокращений и артериальное давление и не вызывает освобождения вазоактивных хемокинов, таких, как гистамин. Фентанил является мощным агонистом опиоидных рецепторов. Он также блокирует стресс, не вызывает выделения гистамина и не нарушает системную и легочную гемодинамику.
Полная механическая вентиляция снимает дыхательную нагрузку и, соответственно, уменьшает метаболические потребности. Устанавливают дыхательный объем 15-20 мл/кг с положительным конечным давлением на выдохе 3-5 мм рт. ст. и частоту дыхания 18-22 в минуту. Содержание кислорода в дыхательной смеси регулируют для поддержания РаО2 в пределах 30-40 мм рт. ст. Давление на вдохе регулируют в период изменения комплайнса легких и грудной стенки. Растяжимость снижена в раннем послеоперационном периоде и постепенно улучшается при нормальном диурезе и уменьшении системного воспалительного ответа на искусственное кровообращение.
Нормальное потребление кислорода и его доставка обеспечиваются при системном сердечном индексе, превышающем 2 л/мин/м2. Однако избыточный конечно-диастолический объем или давление увеличивают напряжение стенки желудочка и, как следствие, его потребность в кислороде. Центральное венозное давление обычно поддерживают в пределах 6-10 мм рт. ст. Применяют инотропную поддержку кальцием и поддерживают слегка щелочной артериальный рН. У большинства пациентов проводят постоянную инфузию допамина 3-5 мкг/кг/мин и инфузию милринона 0,5-1,0 мкг/кг/мин. Если требуется дополнительная инотропная поддержка, доза допамина может быть увеличена и параллельно начата инфузия адреналина в дозе, не превышающей 0,2 мкг/кг/мин, так как увеличение стимуляции а-адренорецепторов и увеличение сопротивления периферических артерий при больших дозах при длительном применении оказывают отрицательное действие на миокард. Снижение системной постнагрузки достигается применением милринона, который кроме инотропного оказывает сосудорасширяющее действие, но более короткое, так же как и селективные антагонисты альфа-адренергических рецепторов. Кроме того, милринон как ингибитор фосфодиэстеразы действует на адренергическую систему не непосредственно, а синергично с допамином. При чрезмерной гипертензии часто применяют нитропруссид натрия, несмотря на лечение милриноном, особенно если имеют место кровотечение или избыточный шунтовой кровоток. Другой важной детерминантой сердечного индекса является частота сердечных сокращений. Брадикардия приводит к снижению сердечного выброса, а тахикардия — к увеличению потребления кислорода миокардом без повышения сердечного индекса. Обычная частота сердечных сокращений после операции Norwood I — 140-180 уд/мин. Кислородная емкость крови является оптимальной при гематокрите 40-50%.
В раннем послеоперационном периоде у новорожденных значительно повышены метаболические потребности и дефицит энергии может быть даже перед операцией. Кроме того, операция на сердце в условиях искусственного кровообращения значительно увеличивает расход энергии в покое и метаболизм питательных веществ, поэтому оптимизация питания в раннем послеоперационном периоде очень важна для ускорения заживления и обеспечения метаболического резерва. Энтеральное питание начинают относительно рано, а парентеральное питание через центральный венозный катетер осуществляют уже в первый день после операции и продолжают до установления адекватного режима энтерального питания.
Предупреждение осложнений на этапе нахождения в отделении интенсивной терапии в значительной степени предопределяет исход лечения. Для этой цели максимально сокращают процедуры, которые могут стать причиной осложнений, прекращают механическую вентиляцию, удаляют катетеры и прекращают внутривенную инфузию, если это безопасно.
Физиологический стресс стараются по возможности минимизировать в течение первых 24 ч. Отсасывание из эндотрахеальной трубки выполняют только при необходимости, определяемой по увеличению давления в дыхательных путях и падению системной сатурации. Желательно избегать потенциально болезненных процедур.
Основные проблемы послеоперационного течения
Основными проблемами раннего послеоперационного течения являются малый сердечный выброс и гипоксемия.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии