Оценка состояния сердечно-сосудистой системы. Алгоритм обследования новорожденного. Диагностика ВПС у новорожденных
Для новорожденных характерно преобладание правого желудочка, утолщение его стенки и повышение ЛСС, обусловленное утолщением гладкомышечного медиального слоя стенки легочных артериол. Он постепенно становится тоньше, и к 6-8-недельному возрасту структура легочных артериол приближается к таковой у взрослых.
Постнатальные изменения гемодинамики связаны главным образом с этой нормальной эволюцией. Постепенно снижаются ЛСС и масса правого желудочка. У недоношенных детей преобладание правого желудочка выражено меньше, а ЛСС ниже, чем у родившихся в срок. Ниже приведены нормальные и патологические признаки, которые обнаруживаются при исследовании сердечно-сосудистой системы новорожденных.

Физикальные исследования
Нормальные физические показатели
-
Частота сердечных сокращений больше у новорожденных, чем у детей старшего возраста и взрослых. Обычно ЧСС более 100 уд/мин и варьирует от 70 до 180 уд/мин.
-
Различная степень акроцианоза является скорее правилом, чем исключением.
-
Обычно снижено насыщение артериальной крови кислородом до рО2 60 мм рт. ст. Это связано либо с внутрилегочным шунтированием через еще не раскрывшиеся сегменты легких, либо с право-левым шунтом через открытое овальное окно.
-
Относительная перегрузка правого желудочка на ЭКГ.
-
Второй тон не расщеплен в первые дни жизни.
-
Иногда слышен щелчок выброса.
-
У новорожденного может быть слышен функциональный систолический шум, генерируемый выбросом крови в легочную артерию. Шум иррадиирует во все стороны и в спину.
-
Периферический пульс хорошо пальпируется навсех конечностях практически у всех здоровых младенцев.
Недоношенные дети имеют дополнительные особенности, о которых врачи должны помнить при исследовании.
-
Шум легочного кровотока более громкий, чем у доношенных детей, из-за более тонкой грудной стенки.
-
У недоношенных детей ОАП встречается чаще.
-
Периферический пульс более напряженный из-за невыраженной подкожной клетчатки. Важно иметь представление о нормальном пульсе у недоношенных детей.
Аномальные физические показатели
Аномальные признаки могут свидетельствовать о наличии сердечной патологии. Необходимы повторные осмотры, так как физические находки быстро изменяются во времени как у здоровых, так и у больных детей.
-
Цианоз, особенно если он не исчезает при ингаляции кислорода, является признаком порока сердца.
-
Ослабление или отсутствие периферического пульса на нижних конечностях свидетельствует в пользу коарктации аорты. Слабый пульс является одним из признаков синдрома гипоплазии левых отделов сердца или циркуляторного шока. Напряженный и высокий пульс характерен для пороков, сопровождающихся утечкой крови из аорты, таких, как ОАП или ОАС.
-
Тахипноэ более 60 в минуту, с втяжением межреберных промежутков или без него, может быть признаком порока сердца.
-
Гепатомегалия является признаком пороков сердца. Срединное расположение печени может указывать на синдром асплении или полисплении.
-
Сердечные шумы являются признаком ВПС, однако функциональные шумы более часты, чем патологические.
-
Признаком сердечной патологии являются также нарушения ритма и ЧСС.
Измерение артериального давления
Измерение АД у новорожденных особенно важно при подозрении на коарктацию аорты, ги- пер- или гипотензию. Следует отдавать предпочтение электронным методам, так как аускультативный метод в этом возрасте затруднителен.
-
Непрямые методы.
Опубликованные нормы АД у новорожденных получены при использовании в основном допплер-ультразвукового или осциллометрического методов. Манжетка при этом должна быть примерно в 2 раза уже окружности конечности, точность измерения осциллометрическим методом у недоношенных детей сомнительна.
Электрокардиография
Для нормальной ЭКГ новорожденных характерны:
-
Синусовая тахикардия с частотой до 180 уд/мин.
-
Отклонение QRS-оси вправо в среднем на + 1250, максимально на +1800.
-
Относительно низкий вольтаж комплекса QRS и волны T.
-
Преобладание высоких волн в правых отведениях.
-
У 10% детей встречаются g-волны в отведении V1.
-
У недоношенных детей, а также у родившихся в срок нередко встречаются доброкачественные аритмии. Частота сердечных сокращений варьирует от 70 до 210 уд/мин. Ритм AV-соединения отмечается у 18-70% младенцев, преждевременное сокращение предсердий – у 30-35%, желудочков – у 6-17%, AV-блокада I-II степени – у 4-6%. Особенно часто встречаются внезапная синусовая брадикардия или синусовая пауза. Патологические изменения ЭКГ обычно включают отклонения Р- и QRS-оси, гипертрофию желудочков и предсердий, нарушения проводящей системы, аритмии.
Вследствие широких вариаций нормальных показателей у многих новорожденных с выраженными ВПС ЭКГ может быть нормальной для данного возраста.
Электрическая ось
-
Отклонение оси вправо может свидетельствовать в пользу предсердного situs inversus, синдрома асплении или неправильно размещенных электродов ЭКГ.
-
Верхняя Р-ось может быть признаком эктопического предсердного ритма или синдрома полисплении.
Диагностика ВПС
Еще недавно диагноз ВПС у новорожденного, достаточный для принятия адекватных решений, мог поставить лишь проницательный клиницист. Даже в эру современных диагностических технологий стетоскоп клинициста касается грудной клетки ребенка раньше датчика эхокардиографиста и физикальные методы исследования не утратили своей роли. Более того, именно клиницист играет решающую роль в формулировании дифференциального диагноза и оптимальной тактики лечения. Раннее распознавание, срочный неинвазивный диагноз и стабилизация состояния ребенка с помощью решительных терапевтических действий являются залогом снижения летальности как на дохирургическом, так и на периоперационном этапах.

Развитие и уточнение диагноза проходит несколько логических стадий. С этой точки зрения удобно разделить пороки на 3 клинико-гемодинамические группы, отличающиеся по внешним признакам:
-
Пороки, ведущим проявлением которых является цианоз.
-
«Белые» пороки с сердечной недостаточностью.
-
Пороки, при которых сердечная недостаточность сочетается с цианозом: ТМА, единственный желудочек сердца, ТАДЛВ, аномалия Эбштейна.
Это деление позволяет сузить круг предполагаемых диагнозов, хотя одни и те же пороки могут оказаться в различных группах в зависимости от степени обструкции выводного тракта правого желудочка и объема легочного кровотока.
Материнский анамнез
Материнский анамнез очень важен для диагностики ВПС. Материнскими факторами риска являются: ВПС, кардиальные тератогенные воздействия, метаболические нарушения у матери, инфекция, коллагенозы, много- и маловодие. Семейными факторами риска являются: ВПС и генетические синдромы.
ВПС матери увеличивает вероятность развития порока сердца ребенка с 1% в общей популяции до 15%. Среди медикаментозных средств амфетамины повышают вероятность образования ДМЖП, ОАП, ДМПП и ТМА. Противосудорожные средства могут стать причиной стеноза легочной артерии, стеноза аорты, коарктации аорты, ОАП. С приемом триметадиона связывают ТМА, тетраду Фалло и синдром гипоплазии левых отделов сердца, с прогестероном-эстрогеном – ДМЖП, ТФ, ТМА. При фетальном алкогольном синдроме частыми пороками являются ДМЖП, ОАП, ДМПП, тетрада Фалло. Тератогенный эффект курения табака не отмечен, однако очевидна задержка роста плода. У беременных, страдающих сахарным диабетом, часты случаи рождения детей с кардиомиопатией, ТМА, ДМЖП, ОАП. Материнский люпус эритематозус и болезни соединительной ткани ассоциируются с большой частотой АV-блокады у ребенка. Перенесенная матерью в I триместре беременности краснуха, как правило, осложняется полиорганными аномалиями плода, включая ВПС. Инфекции, вызванные цитомегаловирусом, вирусом герпеса и вирусом коксаки В, являются тератогенными, если они имели место в ранней беременности, в более позднем сроке они могут быть причиной миокардита.
Послеродовой анамнез
Прибавка в массе тела и общее развитие могут задерживаться при застойной сердечной недостаточности или цианозе. Отставание роста выражено меньше. Недоедание во время кормления должно привлечь внимание врача как ранний признак ВПС, особенно если оно обусловлено быстрым утомлением и одышкой.
Масса плода при рождении дает полезную информацию. Если она мала для данного гестационного возраста, это может указывать на наличие внутриутробной инфекции. Типичным примером является синдром краснухи. У новорожденных с большой массой, родившихся от матерей, страдающих сахарным диабетом, повышена частота ВПС. Младенцы с ТМА часто имеют массу выше средней, хотя этот признак малоценен из-за очевидного цианоза.

Фетальная эхокардиография
Благодаря увеличению количества ультразвуковых исследований в акушерстве обычным становится рождение младенцев с пренатальным заключением о возможном ВПС. Фетальную эхокардиографию рекомендуют проводить на 18-22-й неделе беременности, хотя подозрение о ВПС может возникнуть уже на 12-16-й неделе. Показания к проведению эхокардиографии определяет акушер после общего ультразвукового исследования при наличии у плода экстракардиальных аномалий, аритмий, при малом плоде для данного гестационного возраста, неиммунной водянке плода, двухсосудистой пуповине. Выраженная сердечная патология обнаруживается при четырехкамерном скрининге в 40% случаев, при патологическом кариотипе – в 25%, аритмиях плода – в 10%, диабете у матери – в 5%, семейном анамнезе, наркотической или алкогольной зависимости матери – в 1% случаев.
Большинство сложных врожденных аномалий сердца могут быть точно диагностированы с помощью фетальной эхокардиографии, но некоторые пороки типа коарктации аорты, небольшого межжелудочкового и межпредсердного дефекта перегородки, полного аномального дренажа легочных вен, умеренного аортального или легочного стеноза могут быть не выявлены. Нозологическая форма сложного порока хорошо идентифицируется эхокардиографией плода, но полное анатомическое описание требует проведения послеродовой эхокардиографии. Постоянные или перемежающиеся тахи- или брадиаритмии плода могут быть обнаружены при стандартных акушерских ультразвуковых исследованиях. Если обнаружена аритмия плода, следует провести углубленное эхокардиографическое исследование, чтобы выявить связанную с ней структурную патологию сердца и конкретизировать аритмию.
Медицинская тактика при пренатально диагностированных ВПС обычно достаточно консервативна и в основном заключается в направлении матери на роды в высокоспециализированные центры и в лекарственной терапии тахиаритмий. При аномалиях, отличающихся критическим послеродовым течением, может рассматриваться вопрос о прерывании беременности. К ним относятся пороки с дуктусзависимым системным кровотоком или с зависимым легочным кровотоком, а также пороки, которые требуют неотложного вмешательства для улучшения внутрисердечного смешивания или экстренной полной коррекции. Однако если нет неиммунной водянки плода и известно, что роды произойдут вблизи квалифицированного кардиохирургического центра или будет обеспечена экстренная доставка новорожденного в центр при условии выполнения известных протоколов ведения, предпочтительны спонтанные роды в срок. Прерывание беременности для выполнения более раннего вмешательства нецелесообразно из-за совместимости большинства пороков с условиями внутриутробного кровообращения. С другой стороны, доношенных младенцев легче выхаживать, учитывая зрелость органов; они имеют накопленные в течение последнего триместра беременности пищевые резервы, которых нет у недоношенных. У недоношенных детей также более вероятны электролитные нарушения, развитие респираторного дистресс-синдрома, некротического энтероколита и желудочных кровотечений.
Послеродовой диагноз
После родов подозрение на наличие у ребенка ВПС должно возникнуть у врачей уже в роддоме. Все многообразие анатомических форм ВПС манифестируется всего несколькими признаками:
-
цианозом;
-
застойной сердечной недостаточностью или шоком;
-
сердечными шумами;
-
необычной конфигурацией и увеличением размеров сердечной тени;
-
наличием левограммы у новорожденных или сохраняющейся гипертрофией правого желудочка на ЭКГ;
-
отсутствием пульса на бедренных артериях;
-
нарушениями ритма.
Первичное обследование новорожденных с предполагаемым ВПС заключается в сборе подробного анамнеза, физикальном исследовании с измерением АД на четырех конечностях, выполнении рентгенографии грудной клетки, электрокардиографии и фонокардиографии, гипероксического теста и эхокардиографии.
Физикальное исследование
Физикальное исследование лучше проводить в наиболее комфортабельных, не беспокоящих ребенка условиях. Детей можно обследовать на руках у родителей или на столиках с подогревом, оборудованных инфракрасными нагревателями. Руки врача, его стетоскоп должны быть теплыми, чтобы не вызвать плача, который затруднит обследование.
Для анестезиолога ряд данных физикального обследования представляет особый интерес. В первую очередь это связанные с сопутствующими врожденными синдромами аномалии развития лицевого черепа и верхних дыхательных путей. Так, при синдроме Робена интубация может представлять большие трудности, поэтому следует предусмотреть возможность трахеостомии и при необходимости обеспечить выполнение этой операции. При синдроме Дауна, кроме повышенной чувствительности к антихолинэстеразным препаратам, проблему для анестезиолога представляют большой язык, слабые мышцы глотки и опасность дислокации шейных позвонков.
Артериальное давление должно быть измерено на всех четырех конечностях. Систолическое давление на руках, превышающее таковое на ногах более чем на 10 мм рт. ст., указывает на возможность коарктации аорты. Наличие градиента давления между правой и левой рукой является признаком коарктации, гипоплазии или перерыва дуги аорты. Однако систолический градиент АД не будет определяться у новорожденного с сопутствующим ОАП при сбросе крови справа налево, т.е. из правого желудочка в нисходящую аорту. Поэтому отсутствие систолического градиента давления полностью не исключает сужения или другой патологии дуги.
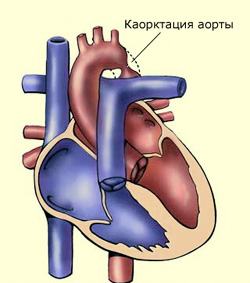
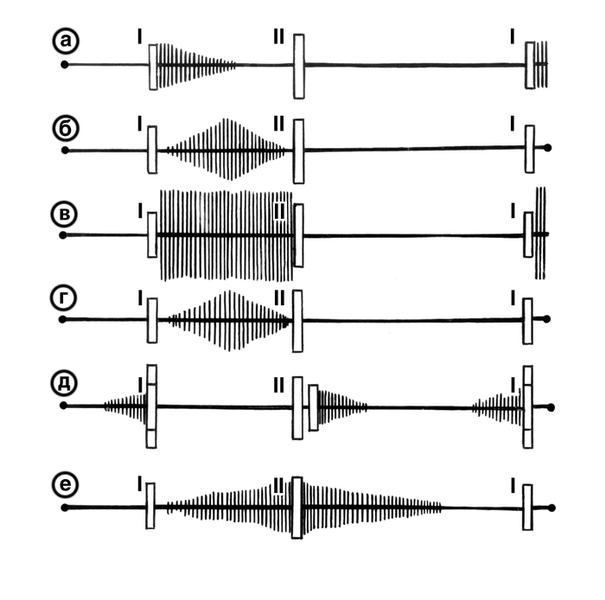
Сердечные шумы
-
Функциональные сердечные шумы.
У новорожденных, так же как и у детей других возрастных групп, не все шумы являются патологическими. Более чем у 50% детей отмечается систолический шум в 1-й недели жизни.
У недоношенных детей шум отмечается чаще, чем у новорожденных, родившихся в срок. Причинами функциональных шумов являются:
-
шум легочного кровотока;
-
преходящий систолический шум ОАП;
-
преходящий систолический шум недостаточности трехстворчатого клапана;
-
вибрационный функциональный систолический шум.
Шум легочного кровотока является наиболее типичным. Он слышен во II межреберье слева от грудины и распространяется в обе стороны, в подмышечную область и на спину. Этот шум мягкий, небольшой интенсивности. ЭКГ и рентгенограмма – без отклонений от нормы. Шум слышен в течение недель или месяцев и обычно исчезает к 6 месячному возрасту.
Преходящий систолический шум ОАП слышен во II межреберье слева от грудины и в надключичной области в 1-й день после рождения и вскоре исчезает. Обычно это систолический шум, усиливающийся ко ІІ тону.
Преходящий систолический шум недостаточности трехстворчатого клапана малоотличим от шума ДМЖП. Эпицентр шума находится снизу слева от грудины и исчезает через 1 или 2 дня при снижении ЛСС. Этот шум чаще наблюдается у младенцев, у которых имеет место дистресс-синдром или неонатальная асфиксия, поскольку у них дольше сохраняется высокое ЛСС.
Вибрационный функциональный шум в средней части систолы напоминает звук натянутой струны, писк или жужжание. Обычно он низкочастотный, лучше выслушивается в положении лежа снизу слева от грудины или на верхушке. Интенсивность шума усиливается при увеличенном сердечном выбросе, например при лихорадке. Дифференциация вибрационного шума от шума ДМЖП затруднена. Вибрационный шум не сопровождается дрожанием или щелчком выброса.
-
Патологические сердечные шумы.
Большинство патологических шумов слышны в течение 1-го месяца жизни, за исключением шума, создаваемого ДМПП. Время появления шумов зависит от характера ВПС.
-
Сердечные шумы при стенотических пороках слышны сразу после рождения и не изменяются со временем, поскольку они не связаны с уровнем ЛСС.
-
Шумы, сопутствующие порокам со сбросом слева направо, зависят от величины ЛСС и могут появиться не сразу после рождения. Например, шум небольшого ДМЖП, при котором ЛСС снижается, как у здоровых детей, слышен вскоре после рождения. Появление шума большого ДМЖП может быть отсрочено на 1-2 нед по мере снижения ЛСС.
-
Типичный непрерывный шум ОАП может не появиться до 2-3 нед жизни. Вначале он слышен как систолический шум крещендо с невыраженным или отсутствующим диастолическим компонентом. Эпицентром шума является подключичная область.
-
Шум ДМПП становится слышимым после 1 года или 2 лет, когда растяжение правого желудочка достигает максимума.
Даже при отсутствии сердечного шума у новорожденного может быть тяжелый ВПС. У больных с тяжелой сердечной недостаточностью шумы могут не появиться, пока функция миокарда не улучшится в результате лечения.
Рентгенограмма грудной клетки
Нормальная рентгенограмма
Кардиоторакальный индекс у здоровых новорожденных больше 0,5. Размеры сердечной тени и ее конфигурация значительно варьируют в зависимости от положения диафрагмы, степени инспираторного расширения легких, увеличения тени вилочковой железы.
Тень вилочковой железы в верхнем средостении может иметь различные формы: классический вид паруса по правому или левому краю средостения или билатерально. Край тени может быть волнистым или гладким. Идентифицировать тимус помогает боковая рентгенограмма.
Силуэт сердца не всегда хорошо виден в этом возрасте. Легочный ствол часто не формирует выбухание грудной части левого края сердечной тени. На боковой рентгенограмме можно обнаружить расширение левого желудочка.
Оценка легочно-сосудистого рисунка обычно малоинформативна. Он не всегда усилен даже у детей с увеличенным легочным кровотоком. Трудно также дифференцировать увеличение легочного кровотока от легочного венозного застоя. Уменьшенный легочной кровоток диагностируется легче.
Рентгенограмма при сердечной патологии
Патологию сердца можно заподозрить при аномальных размерах, расположении или конфигурации сердечной тени, а также при аномалиях формы и расположения печени, при усиленном или ослабленном легочно-сосудистом рисунке.
-
Размеры сердца.
К сожалению, надежные критерии для идентификации кардиомегалии у новорожденных отсутствуют. Кардиоторакальный индекс больше 0,5 даже у здоровых детей. При многих тяжелых ВПС, обычно сопровождающихся кардиомегалией, на рентгенограмме сердце может выглядеть нормально. Очевидная кардиомегалия может быть выявлена при:
-
ВПС с ДМЖП, ОАП, ТМА, аномалией Эбштейна, СГЛОС;
-
экссудативном перикардите;
-
миокардите или кардиомиопатии;
-
метаболических нарушениях, таких, как гипогликемия, тяжелая гипоксемия и ацидоз;
-
гипергидратации или чрезмерной трансфузии.
У новорожденных, которые находятся на искусственной вентиляции, на размеры сердца оказывает влияние режим вентиляции. Так, у недоношенных детей с большим шунтом через ОАП размеры сердца могут быть нормальными, если установлено высокое положительное давление на выдохе.
Аномальная конфигурация сердечной тени может помочь в постановке правильного диагноза. Наиболее патогномотичны 4 типа:
-
сердце в виде башмачка отмечается при тетраде Фалло и трикуспидальной атрезии;
-
сердце в виде яйца с узкой талией типично для ТМА;
-
большое шарообразное сердце характерно для аномалии Эбштейна;
-
сердечная тень в виде снежной бабы или цифры «8» – надежный признак ТАДЛВ.
Декстрокардия и мезокардия, когда сердце расположено в правой половине грудной клетки или по средней линии, наблюдаются при:
-
situs viscerum inversus при нормальном сердце;
-
гипоплазии правого легкого со смещением вправо нормально сформированного сердца ;
-
сложных цианотических ВПС, включающих предсердную или желудочковую инверсию;
-
синдроме асплении или полисплении, сочетающемся со срединным расположением печени.
-
Расположение внутренних органов.
Расположение печени или желудочного воздушного пузыря и форма печени дают важную информацию о характере порока:
-
срединное расположение печени указывает на синдром асплении и полисплении в сочетании со сложным цианотическим ВПС;
-
печень, расположенная слева при праворасположенности сердца указывает на зеркальное расположение всех органов, включая декстрокардию ;
-
расположение печени и верхушки сердца с одной стороны обычно свидетельствует о наличии сложного ВПС.
Легочный сосудистый рисунок. Оценка ЛСР является важной частью интерпретации рентгеновского снимка.
-
Усиленный ЛСР у больных с цианозом указывает на вероятность ТМА, общего артериального ствола или единственного желудочка сердца. У ацианотичного новорожденного ребенка усиление ЛРС отмечается при ДМЖП, ОАП и АВСД.
-
Ослабленный ЛСР в виде черных легочных полей указывает на критический цианоти- ческий ВПС со сниженным легочным кровотоком — атрезию легочной артерии, атре- зию трехстворчатого клапана, тетраду Фалло с легочной атрезией. При этих пороках размеры сердца обычно нормальны, только при аномалии Эбштейна сердце значительно увеличено.
-
Сетчатый характер ЛСР характерен для легочной венозной обструкции при СГЛОС и ТАДЛВ с обструкцией оттока.
Патологические синдромы
Цианоз у новорожденного
Раннее выявление цианоза у новорожденного имеет решающее значение. Необходимо осмотреть типичные места его появления: губы, ногти пальцев рук и ног, слизистую оболочку рта, конъюнктивы, кончик языка и носа. Цианоз проявляется при насыщении артериальной крови кислородом ниже 85%. При высоком уровне гемоглобина, что часто бывает у новорожденных, вследствие капиллярного стаза экстракция кислорода тканями увеличена, поэтому цианоз может появиться при более высоком насыщении кислородом, например при 90%.
При сомнении необходимо измерить насыщение с помощью пульсоксиметра или исследовать пробу артериальной крови. Нормальное рО2 у однодневного ребенка может быть равным 60 мм рт.ст. При некоторых цианотических ВПС с увеличенным легочным кровотоком рО2 может превышать 60 мм рт.ст. При этом насыщение не увеличивается на кислородную пробу. Насыщение более 90% не исключает цианотического ВПС, так как при этом рО2 может быть 45-50 мм рт.ст. из-за физиологического смещения влево кривой диссоциации оксигемоглобина. У старших детей и взрослых насыщение, приближающееся к 90%, достигается при рО2 60-65 мм рт.ст.
Клинические признаки цианоза при нормальном насыщении артериальной крови кислородом называют периферическим цианозом. Для него характерен акроцианоз, который наблюдается при охлаждении, изменении распределения кровотока по капиллярам кожи, связанном с влиянием автономной нервной системы, при увеличении вязкости крови, способствующей замедлению ее прохождения через капилляры, а также вследствие недостаточности кровообращения в активной фазе септического шока.
Центральный цианоз сопровождается снижением насыщения артериальной крови. Он клинически значим и может быть обусловлен:
-
угнетением ЦНС;
-
патологией легких;
-
цианотическим ВПС.
Диагностические действия у больных с центральным цианозом:
-
отсутствие хрипов, за исключением не связанных с сердечной недостаточностью;
-
наличие сердечных шумов;
-
наличие непрерывного шума ОАП;
-
увеличение сердца или изменение его конфигурации на рентгенограмме;
-
усиленный или ослабленный легочный рисунок;
-
отрицательная кислородная проба.
Гематологическая причина
-
Метгемоглобинемия врожденная или приобретенная.
Цианоз проявляется при концентрации метгемоглобина >15% общей концентрации Hb.
-
рО2 артериальной крови нормальное
Насыщение О2 снижено 10 мин, чтобы полностью заместить кислородом альвеолярный воздух. Оценивают степень цианоза и величину рО2 путем исследования газов артериальной крови или чрескожного мониторинга.
При легочной патологии артериальное рО2 обычно возрастает выше 100 мм рт. ст. При значительном сбросе крови справа налево рО2 не превышает 100 мм рт. ст. и возрастает не более чем на 10-30 мм рт. ст. Однако при некоторых цианотических ВПС с увеличенным легочным кровотоком, таких, как ТАДЛВ, рО2 в артериальной крови может превышать 100 мм рт. ст. С другой стороны, у детей с тяжелой легочной патологией, сопровождающейся массивным внутрилегочным шунтом, рО2 артериальной крови может не возрастать. Таким образом, кислородная проба должна интерпретироваться с учетом клинической картины, в частности рентгенологических проявлений легочной патологии.
Важное диагностическое значение имеет сравнение насыщения кислородом крови из верхней половины тела и нижней. Это позволяет избежать ложных данных вследствие право-левого шута через ОАП. Разница считается значительной, если рО2 крови из правой лучевой артерии на 10-15 мм рт. ст. выше, чем из пупочной артерии. При выраженном право-левом сбросе через ОАП можно заметить разницу окраски верхней половины туловища и нижней. Этот признак отмечается при синдроме персистирующего фетального кровообращения или обструктивных аномалиях левых отделов сердца – тяжелом аортальном стенозе, перерыве дуги аорты, коарктации аорты, СГЛОС. Как только заподозрен или установлен диагноз порока с дуктусзависимым системным кровотоком или цианотического порока с дуктусзависимым легочным кровотоком, следует начать инфузию ПГЕ1.
Постоянное внутривенное вливание начинают с дозы 0,05-0,1 мкг/кг/мин. По достижении эффекта дозу снижают до 0,01 мкг/кг/мин. Если начальная доза не дала эффекта, она может быть увеличена до 0,4 мкг/кг/мин.
Постогландин Е1 вызывает ряд побочных реакций: могут возникнуть апноэ, лихорадка, покраснение. Реже встречаются брадикардия, гипотензия, остановка сердца, кровоточивость тканей.
Протокол обследования новорожденного с цианотическим ВПС
-
Рентгенограмма позволяет выявить легочные причины цианоза и ургентность проблемы, а также заподозрить ВПС и даже его характер.
-
Газы артериальной крови при комнатной температуре позволяют подтвердить центральную природу цианоза. Повышение рСО2 указывает на наличие легочной патологии или проблемы, связанной с ЦНС. Снижение рН отмечается при сепсисе, циркуляторном шоке, тяжелой гипоксемии.
-
Кислородная проба. Повторное исследование газов крови при дыхании 100% кислородом позволяет дифференцировать цианотический ВПС от внесердечных причин – болезней легких или ЦНС.
-
Отклонение ЭКГ от нормы.
-
Катетеризация пупочной артерии. Величина рО2 в предуктальной артерии, превышающая таковую в постдуктальной артерии на 10-15 мм рт.ст., является признаком право-левого шунта. Катетер в пупочной артерии, проведенный в нисходящую аорту, может быть использован для выполнения аортографии, что сокращает время проведения исследования и устраняет риск повреждения артериальных сосудов.
-
При подозрении на цианотический ВПС, возникшем на основании лабораторных тестов, показано введение ПГЕ1.
Точный диагноз устанавливается с помощью эхокардиографии. Однако даже физикальное исследование, ЭКГ и рентгенограмма могут сузить круг вероятных пороков еще до профессионально проведенного ультразвукового исследования, не всегда доступного в условиях роддома.
Все цианотические пороки целесообразно разделить на две группы по рентгенологическому признаку – с усиленным или ослабленным легочным рисунком, что отражает увеличенный или уменьшенный легочной кровоток.
Клиническую картину ЗСН в период новорожденности могут симулировать другие заболевания: менингит, сепсис, пневмония, бронхиолит. Основными признаками ЗСН являются тахипноэ,тахикардия, хрипы в легких, гепатомегалия, ослабленный периферический пульс. Врожденные пороки сердца и заболевания, не связанные с пороками, сопровождающиеся тяжелой сердечной недостаточностью в период новорожденности.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии