Трансплантация почки. Операция трансплантация почки
Первое описание анестезии при трансплантации почки относится к началу 1960-х гг. В нем подробно рассказывалось о первых попытках проведения трансплантации почки от живого донора между двумя однояйцевыми близнецами в Бостоне. В то время единственными средствами наблюдения за состоянием пациента были аппарат для измерения артериального давления и электрокардиограф, а операция была проведена под спинальной анестезией. С той поры многое изменилось в анестезиологической тактике ведения таких пациентов. То, что ранее выглядело героическим и экстраординарным, стало привычным. Проведение анестезии у этих пациентов является непростой задачей, так как терминальная стадия почечной недостаточности приводит к дисфункции других органов и систем, что делает реакции организма на лекарственные препараты и анестезиологические манипуляции менее предсказуемыми. Кроме того, у данной категории пациентов вследствие основного заболевания повышен риск развития в периоперационном периоде осложнений со стороны сердечно-сосудистой и других систем.
Показанием к трансплантации почки является терминальная стадия почечной недостаточности, к которой может приводить прогрессирование гломерулонефрита, сахарного диабета, злокачественной артериальной гипертензии, поликистоза почек, другой семейной или врожденной патологии, а также тубулоинтерстициального нефрита. Трансплантация почки – самая часто выполняемая операция по пересадке органов в США, Европе и Азии. Число этих вмешательств стабильно увеличивалось на протяжении 1990-х гг. В мире наблюдается значимое различие в пропорции органов, полученных от умерших либо живых доноров. В некоторых странах, например в Китае, полагаются практически полностью на умерших доноров, в то время как в других, например в Японии и Тайване, в основном на живых. На территории США количество трансплантаций от умерших доноров составило 10 659 в 2006 г. и 8849 в 2007 г. Число пересадок от живых доноров также сократилось в 2007 г., по сравнению с 2006 г, когда было выполнено 6432 трансплантации почек.

В листе ожидания в США на начало 2008 г. находилось примерно 78 700 пациентов со средним сроком ожидания трансплантации более 3 лет. Этот факт подразумевает, что реципиенты как группа стали еще старше, а состояние их здоровья еще хуже, чем прежде. И, тем не менее, трансплантация почки является одним из самых важных и экономически эффективных методов лечения терминальной стадии почечной недостаточности. В группе трансплантируемых больных наблюдается снижение уровня смертности примерно на 40-60% по сравнению с пациентами, остающимися на диализе. Общая трехлетняя выживаемость трансплантата при трансплантации от умершего донора составляет более 88%, а у реципиентов почки от живого донора – более 93%.
Патофизиология терминальной стадии почечной недостаточности
Основными функциями почек являются регулирование водного баланса, электролитного состава крови, кислотно-щелочного равновесия и содержания гемоглобина в организме. Почки получают около 25% от сердечного выброса и выступают в роли фильтров для циркулирующих в крови токсинов и медикаментов. При повреждении почек эти функции нарушаются. Хроническая почечная недостаточность приводит к устойчивому снижению клубочковой фильтрации и мочеобразования, что оказывает губительный эффект на органы и системы организма. У пациентов с клубочковой фильтрацией менее 30 мл/ мин/м2 наблюдается увеличение в крови содержания конечных продуктов азотистого обмена, в основном мочевины, а также задержка жидкости и нарушение электролитного баланса. Снижение диуреза менее 400 мл/сут называется олигурией и характеризуется неспособностью пациента выводить потребляемую жидкость и электролиты. Наблюдаются нарушения содержания Na+, K+, Ca2+, Mg2+ и фосфатов в крови с возможным развитием жизнеугрожающего состояния – гиперкалиемии.
Сердечно-сосудистые заболевания – самая распространенная причина смерти у пациентов с терминальной стадией почечной недостаточности, причем даже после трансплантации почки. Более 50% смертей у пациентов на диализе вызваны острым инфарктом миокарда, аритмией, кардиомиопатией и остановкой сердца неясной этиологии. С возрастом смертность от сердечно-сосудистых заболеваний у пациентов на диализе только увеличивается: эта цифра практически в два раза выше в группе пациентов от 45 до 64 лет и в четыре раза выше среди пациентов старше 65 лет по сравнению с пациентами от 22 до 44 лет. При проведении скрининговой эхокардиографии отмечается высокая частота выявления отклонений от нормы. Более того, при аутопсии пациентов, находившихся на диализе, в 60% случаев были зафиксированы лево/правожелудочковая гипертрофия либо перикардит.
Дилатационная кардиомиопатия и концентрическая гипертрофия могут развиться в ответ на увеличение внутрисосудистого объема и постнагрузки. При невозможности вывести из организма потребляемую жидкость развивается гиперволемия, которая приводит к последующей перегрузке объемом и застойной сердечной недостаточности. Свой вклад в низкую производительность миокарда вносит накопление в организме уремических токсинов и метаболических кислот. Cho с соавт. продемонстрировали, что у части пациентов со вторично сниженной фракцией выброса на фоне уремической кардиомиопатии возможно полное восстановление нормальной сердечной функции в случае успешной трансплантации почки. Таким образом, терминальная стадия почечной недостаточности со сниженной сократительной способностью миокарда не является противопоказанием к трансплантации почки, однако может осложнить анестезиологическое ведение пациента.
Гипертензия при заболеваниях почек вызвана нарушением регуляции обмена натрия и воды, что приводит к увеличению объема жидкости в организме, а также изменениями содержания вазоактивных веществ в крови, что сопровождается нарушением локального и системного сосудистого тонуса. Гиперренинемия может сопровождаться увеличением ОПСС и подъемом артериального давления, но она имеется не всегда. При отсутствии лечения повышенное системное давление внутри почки вызывает склеротические изменения в ее сосудах. Порочный круг замыкается: высокое артериальное давление повреждает почки и этим создает условия для дальнейшего прогрессирования гипертензии. Кроме того, высокие цифры артериального давления могут быть первым признаком перегрузки объемом, развившейся на фоне олигурии. Артериальная гипертензия увеличивает постнагрузку и напряжение стенки миокарда, что в сочетании с уремией приводит к изменениям, соответствующим понятию кардиомиопатии. Хроническая гипертензия ведет к левожелудочковой гипертрофии и увеличивает потребность миокарда в кислороде.
Почечная недостаточность также ускоряет развитие атеросклероза, особенно в системе коронарного кровообращения. Уремия вызывает нарушения липидного обмена, приводя к повышенной концентрации триглицеридов в плазме и пониженному уровню защитных липопротеинов высокой плотности.
Другой патологией, с которой можно столкнуться у пациентов с терминальной почечной недостаточностью, являются перикардит и аритмии. Перикардит, который может сочетаться с геморрагическим перикардиальным выпотом, является обратимым при подключении диализа. Обычно у пациентов, которым проводится адекватная диализная терапия, наблюдается разрешение перикардиального выпота. Эпизоды аритмии могут быть связаны с электролитными нарушениями либо обусловлены возникшей ишемией миокарда.
Причиной развития терминальной почечной недостаточности в 30-40% случаев является сахарный диабет. Более 30% этих пациентов находятся в листе ожидания трансплантации почки. Выраженная нефропатия развивается примерно у 60% больных, страдающих инсулинозависимым сахарным диабетом. Кардиоваскулярный риск у пациентов с терминальной стадией почечной недостаточности на фоне сахарного диабета гораздо выше, чем у пациентов только с уремией, из-за быстрого прогрессирования атеросклероза мелких сосудов.
Хроническая уремия также вызывает замедленное опорожнение желудка. Точный механизм развития этого явления не выяснен, однако было обнаружено, что у пациентов с хронической уремией, находящихся на диализе, наблюдается нарушение моторики желудка на фоне дискоординированной миоэлектрической активности. По-видимому, замедленное опорожнение желудка не зависит от того, находится пациент на классическом гемодиализе либо же на перитонеальном. Всех пациентов, поступивших на трансплантацию почки, следует рассматривать как больных с полным желудком, независимо от продолжительности предоперационного голодания. Следует придерживаться протокола быстрой последовательной индукции, особенно у пациентов с сахарным диабетом. Эта рекомендация важна в свете исследований, показавших, что у 50% больных сахарным диабетом с уремией остаточный объем желудка составил более 3 мл/кг, в то время как у людей с уремией без диабета подобный объем был обнаружен только у 4 из 24 пациентов.
Для пациентов с почечной недостаточностью типична нормохромная нормоцитарная анемия, что связано со снижением эритропоэза и накоплением токсинов в организме вследствие почечной недостаточности. Лечение рекомбинантным эритропоэтином достаточно часто позволяет повысить уровень гемоглобина до 100-140 г/л, что приводит к уменьшению симптомов утомления, улучшению работы сердца и мозга. У некоторых пациентов с артериальной гипертензией лечение эритропоэтином может ухудшить ее течение.
Общепризнанной является взаимосвязь между почечной недостаточностью и тенденцией к кровотечениям. Похоже, что центральную роль в этом играет нарушение функции тромбоцитов вследствие уремии. Дефект связан с накоплением при уремии гуанидин-янтарной кислоты, которая ингибирует аденозиндифосфат-индуцированную агрегацию тромбоцитов.
Несмотря на то, что у пациентов с ХПН часто наблюдаются качественные нарушения функции тромбоцитов, недавние исследования указывают на возможное наличие у них гиперкоагуляционного состояния на фоне уремии. Результаты исследования, в ходе которого изучались результаты тромбоэластографии цельной крови, показали повышение свертываемости и снижение фибринолитической активности в группе пациентов с уремией по сравнению с контрольной группой. После активации тромбоциты высвобождают микрочастицы небольшого размера с прокоагуляционной активностью, которые могут быть вовлечены в клинически значимое тромбообразование.
Уремия может вызвать различные нарушения нервной системы, начиная от чувства сонливости, потери памяти и концентрации до судорог, сопора и комы. Признаки периферической либо вегетативной нейропатии считаются непосредственным показанием к началу диализной терапии.
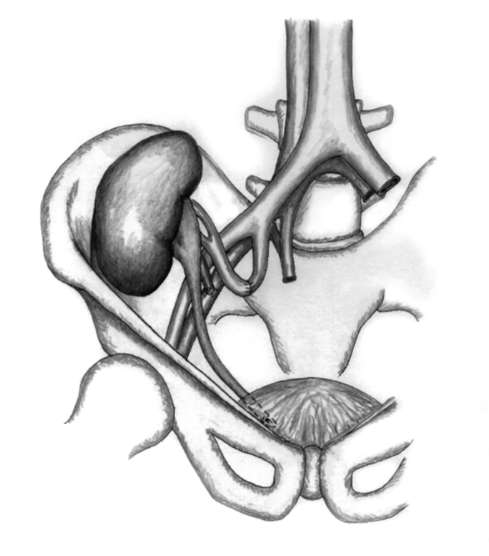
Операция трансплантации почки
Донорские почки, как от живого, так и от умершего донора обычно имплантируются в область подвздошной ямки. Возможно использование как правой, так и левой стороны. Разрез длиной от 20 до 25 см обеспечивает достаточное раскрытие операционного поля. Обычно он начинается на уровне середины лобкового симфиза и продолжается до точки на 2-3 см выше и медиальнее верхней передней подвздошной ости. Анатомические особенности – не редкость, и зачастую необходимо проведение реконструкции сосудов или мочеточника. Донорская почка может получать кровоснабжение от двух или более артерий, отходящих от аорты. Хотя анастомозы могут быть наложены с разными сосудами реципиента, однако чаще используют наружные подвздошные артерию и вену. На наружные подвздошные артерию и вену реципиента накладываются дистальный и проксимальный зажимы, и сосудистый анастомоз выполняется «конец в бок» с донорской артерией и веной. Продолжительность тепловой ишемии обычно составляет около 15-30 мин.
После наложения анастомозов зажимы последовательно снимаются. Впоследствии мочевой пузырь заполняется через катетер Фолея для облегчения имплантации мочеточника в пузырь. Во время послойного ушивания раны необходимо следить за диурезом, чтобы не пропустить возникновения проблем со стороны сосудистых или мочеточникового анастомозов.
Предоперационная оценка и ведение
Примерно у 50% пациентов с терминальной стадией почечной недостаточности имеется одно или несколько сопутствующих заболеваний, описанных выше. Это в значительной мере влияет на выбор метода анестезии у этих пациентов. Хотя трансплантация от умершего донора считается срочным или даже экстренным вмешательством, длительная холодовая ишемия почки хорошо переносится и предоставляет достаточно времени для адекватной подготовки пациента к операции. Если есть возможность, то перед операцией реципиентам необходимо проводить диализ для коррекции электролитных нарушений и стабилизации волемического статуса. Пациенты, не получавшие ранее диализную терапию, обычно выделяют достаточный объем мочи, чтобы предотвратить перегрузку жидкостью. Концентрации электролитов, в особенности калия и HCO3- , могут значительно отличаться от нормы и свидетельствовать о серьезных нарушениях гомеостаза.
Оценить волемический статус пациента можно, сравнив его нынешний вес с его «сухим весом», который диализные больные обычно знают. Иногда продленный амбулаторный перитонеальный диализ применяется в качестве альтернативы гемодиализу. Пациентам, получающим гемодиализ, избыток жидкости может быть удален непосредственно перед операцией для облегчения периоперационной инфузионной терапии. В таком случае пациенты могут оказаться гиповолемичными и подвергнутся риску выраженной гипотензии во время индукции анестезии. Непосредственно перед операцией необходим контроль уровня калия в крови, особенно у пациентов, пропустивших сеанс гемодиализа. Маловероятно, но если после выполнения перед операцией сеанса гемодиализа уровень калия остается более 6 ммоль/л, необходимо отложить операцию и провести коррекцию его концентрации в крови.
Важное значение имеет предоперационная оценка сердечно-сосудистой системы, при этом объем обследования зависит от этиологии поражения почек, продолжительности и наличия сопутствующей патологии. Для молодого пациента с недавно диагностированной терминальной стадией почечной недостаточности без сахарного диабета вполне достаточно будет перед операцией записать ЭКГ и выполнить стресс-тест. В то же время больному с кардиальными симптомами либо пациенту, длительно страдающему хронической почечной недостаточностью, ассоциированной с сахарным диабетом, может быть показано выполнение стресс-эхокардиографии либо коронарографии. Многие пожилые и больные диабетом неспособны пройти ЭКГ с нагрузкой и могут иметь безболевую ишемию миокарда. В настоящее время отсутствует единое мнение об объеме необходимого обследования сердечно-сосудистой системы у пациентов, поступающих на трансплантацию почки.
Несколько неинвазивных скрининговых тестов были изучены для оценки их способности выявлять атеросклеротическое поражение коронарных артерий в данной популяции пациентов. Herzog с соавт. выполняли стресс-ЭхоКГ с добутамином перед проведением количественной коронарной ангиографии в гетерогенной группе пациентов с терминальной стадией почечной недостаточности, ожидавших трансплантацию почки. Более 50% пациентов имели ту или иную степень атеросклеротического поражения. Чувствительность стресс-эхокардиографии с добутамином в отношении выявления больных с атеросклерозом коронарных артерий была всего лишь 52-75%, а специфичность 74-76%. В последующем эти пациенты наблюдались в течение двух лет. На протяжении этого времени у 20% больных с отрицательным результатом стресс-теста были зафиксированы такие события, как:
-
кардиогенная смерть;
-
инфаркт миокарда;
-
операция реваскуляризации миокарда.
Herzog с соавт. пришли к выводу, что стресс-тест с добутамином полезен, однако не совершенен для выявления больных, нуждающихся в дальнейшем клиническом обследовании. Добутаминовый тест определяет функционально значимый стеноз, однако большинство внезапных коронарных смертей происходят как раз на фоне функционально незначимых повреждений. Результаты других неинвазивных методов также показали их ограниченные возможности в отношении выявления атеросклеротического поражения коронарных артерий среди больных с терминальной стадией почечной недостаточности. В одном из исследований сцинтиграфия с таллием и фармакологической нагрузкой дипиридамолом продемонстрировала высокую чувствительность, но достаточно низкую специфичность.
Данные других исследований свидетельствуют о том, что при определении сердечно-сосудистого риска для начала следует использовать легкодоступные клинические показатели, а не применять дорогие тесты с ограниченной чувствительностью и специфичностью. Полезной отправной точкой для выявления атеросклеротического поражения сосудов сердца у таких больных является загрудинная боль в анамнезе, которая обладает чувствительностью и специфичностью порядка 65%. Более комплексное исследование, пересмотренный индекс кардиоваскулярного риска, разработанный на основании ретроспективных данных, продемонстрировал достаточно высокий уровень прогнозирования риска развития осложнений со стороны сердечно-сосудистой системы у больных без почечной недостаточности при проведении им некардиохирургических вмешательств. При определении индекса кардиоваскулярного риска учитывается наличие либо отсутствие следующих шести признаков:
-
высокотравматичная операция;
-
наличие в анамнезе ишемической болезни сердца;
-
сердечной недостаточности;
-
инсульта либо транзиторной ишемической атаки;
-
терапия инсулином до операции;
-
повышенный креатинин в крови.
Перечисленные факторы риска часто встречаются среди пациентов, поступающих на операцию трансплантации почки. При отсутствии либо наличии одного фактора риска вероятность осложнения со стороны сердечно-сосудистой системы в периоперационном периоде достаточно мала; однако уже при наличии двух или трех факторов она возрастает до 5% и 11%, соответственно. Кроме того, на сегодняшний день очевидно, что пациенты, ожидающие трансплантации почки, должны регулярно проходить повторное исследование сердечно-сосудистой системы. В случае отсутствия патологии со стороны сердечно-сосудистой системы во время первичного осмотра необходимо разделить пациентов по группам риска и в дальнейшем производить их осмотр раз в год, раз в два года либо с меньшей частотой. Пациенты с выявленными нарушениями со стороны сердечно-сосудистой системы обычно проходят обследование один раз в год.
Пациенты вначале могут быть разделены по группам риска на основании данных первичного осмотра, истории болезни и симптомов. Пациенты низкого риска не требуют дополнительных исследований перед трансплантацией, больные с высоким риском, возможно, нуждаются в таких инвазивных методах диагностики, как коронарография. В группе среднего риска полезно будет проведение скринингового теста, например, стресс-ЭхоКГ с добутамином либо сцинтиграфии.
В группе пациентов высокого риска в периоперационном периоде трансплантации почки рекомендовано назначение а-блокаторов для снижения риска развития осложнений со стороны сердечно-сосудистой системы. Ряд исследований, проведенных в конце 1990-х гг. установил, что периоперационное применение а-блокаторов значительно снижает риск развития кардиоваскулярных осложнений у пациентов высокого риска при проведении операций, не связанных с трансплантацией. Однако исследование POISE поставило это утверждение под сомнение. В группе почечных реципиентов не было проведено ни одного контролируемого рандомизированного исследования по использованию а-блокаторов в периоперационном периоде. Неизвестно, безопасно ли применение а-блокаторов у этой группы пациентов, особенно у пациентов с сахарным диабетом.
Пациенты с сахарным диабетом имеют более высокую частоту нейропатии вегетативной нервной системы, что проявляется более высоким уровнем артериального давления и частоты сердечных сокращений по сравнению с больными с терминальной стадией почечной недостаточности без диабета. Для пациентов с диабетом второго типа характерно сочетание абдоминально-висцерального ожирения, атерогенной дислипидемии, гипертензии и инсулинорезистентности. Подобная комбинация приводит к повышению риска развития сердечно-сосудистых заболеваний.
Необходимо точно знать, когда был последний прием сахароснижающих препаратов. Не следует принимать данные препараты в день операции из-за риска нераспознанной гипогликемии во время анестезии. Инсулинозависимые пациенты, крайне нестабильные и со снижающимся уровнем инсулина, имеют повышенный риск интраоперационного кетоацидоза.
Перед операцией рутинно оценивают коагуляционный статус:
-
протромбиновое время;
-
МНО;
-
АЧТВ;
-
фибриноген;
-
уровень тромбоцитов.
Хотя пациенты с почечной недостаточностью обычно находятся на диете с ограничением потребления белка, такой рацион питания крайне редко приводит к выраженному дефициту факторов свертывания. Тщательно собранный у пациента анамнез является эффективным методом определения риска кровотечения. Время кровотечения не может служить надежным предиктором интраоперационной кровопотери.
Анестезия у пациентов, перенесших трансплантацию почки
Хотя первые операции по трансплантации почки проводились исключительно под спинальной анестезией, а некоторые авторы и сегодня сообщают об успешном использовании для этой операции регионарных методик, большинство медицинских центров применяют общую эндотрахеальную анестезию с целью обеспечения стабильной гемодинамики, превосходной мышечной релаксации и предсказуемой глубины анестезии. При сравнении сбалансированной анестезии летучими анестетиками в сочетании с опиоидами и тотальной внутривенной анестезии пропофолом с опиоидами различия не были обнаружены. Для трансплантации почки обычно достаточно стандартного протокола мониторирования состояния пациента, утвержденного Американской ассоциацией анестезиологов. Пациенты с тяжелой сопутствующей патологией могут нуждаться в проведении расширенного мониторинга, с использованием инвазивного артериального давления и контроля ЦВД. В течение операции могут наблюдаться выраженные колебания артериального давления; данные одного крупного исследования демонстрируют, что у пациентов чаще встречается гипотензия, нежели гипертензия. Пациентам с наиболее тяжелой сопутствующей патологией, например, имеющим клинические проявления ишемической болезни сердца или застойной сердечной недостаточности, следует проводить расширенный мониторинг с использованием катетера в легочной артерии или транспищеводной эхокардиографии для своевременного выявления эпизодов ишемии миокарда или тяжелых гемодинамических нарушений. Во время укладки пациента и в течение всей операции необходимо контролировать состояние шунтов или фистул для гемодиализа: удостовериться в их проходимости по наличию характерного шума.
Если используется мониторинг ЦВД, его целевые значения для оптимизации сердечного выброса и почечного кровотока находятся в пределах 10-15 мм рт. ст. Хорошая немедленная функция трансплантата наблюдалась при объеме крови более 70 мл/кг и при объеме плазмы более 45 мл/кг. Еще одно исследование показало наличие корреляции между легочным артериальным давлением и функцией трансплантата. При высоком давлении заклинивания функция трансплантата была лучше, чем при более низком. В последнее время активно обсуждалось, является ли использование того или иного кристаллоидного раствора предпочтительней для функции почек в послеоперационном периоде. Национальный опрос, проведенный в 49 больницах США, показал, что более 90% пациентов во время трансплантации почки получают в качестве базовой инфузии физиологический раствор натрия хлорида либо другие растворы на его основе. Однако результаты двойного слепого рандомизированного проспективного исследования, проведенного с целью сравнить интраоперационное применение физиологического раствора и рингер-лактата, показали гораздо большую частоту развития выраженной гиперкалиемии и метаболического ацидоза в группе реципиентов, получавшей физиологический раствор. Хотя перед операцией у реципиента определяется группа крови, риск кровотечения обычно минимален, поэтому вероятность трансфузии мала.
Больные с уремией и некоторыми другими сопутствующими заболеваниями должны рассматриваться как пациенты с повышенным риском аспирации во время индукции анестезии. Прием жидкого раствора антацида в количестве 30 мл увеличивает pH желудочного сока. Для предотвращения регургитации и аспирации следует применять быструю последовательную индукцию, параллельно осуществляя давление на перстневидный хрящ. В нескольких исследованиях было показано, что доза пропофола, необходимая для выключения сознания и уменьшения биспектрального индекса, примерно на 40-60% больше, чем для нормальных пациентов. В работе Goyal с соавт. пропофол в дозе 2,5 мг/кг вводили методом титрования каждые 15 с до достижения определенных исследованием параметров. Была обнаружена обратная зависимость между дозой пропофола и уровнем гемоглобина до операции. Механизм данного явления неизвестен, и введение увеличенной индукционной дозы по результатам исследования не рекомендуется.
У пациентов с артериальной гипертензией повышен риск значительных колебаний артериального давления и частоты сердечных сокращений во время индукции и интубации трахеи. Кроме того, часто у этих пациентов имеется ишемическая болезнь сердца, поэтому важно тщательно контролировать во время индукции артериальное давление и частоту сердечных сокращений, чтобы уменьшить риск развития ишемии миокарда. Для поддержания адекватного артериального давления и частоты сердечных сокращений во время индукции опробованы несколько методов. Применение умеренных или больших доз опиоидов, например, фентанила, может устранить гемодинамическую реакцию на ларингоскопию, однако после индукции анестезии поддержание адекватного артериального давления без использования вазоконстрикторов может быть достаточно затруднительным. В последние годы эффективным препаратом для контроля ЧСС показал себя короткодействующий опиоид ремифентанил, метаболизирующийся в плазме. Ремифентанил можно титровать, что позволяет достаточно быстро достичь необходимой глубины анестезии. При адекватной сократительной способности миокарда короткодействующий а-блокатор эсмолол может быть идеальным препаратом для подавления гемодинамической реакции в ответ на интубацию в этой группе пациентов.
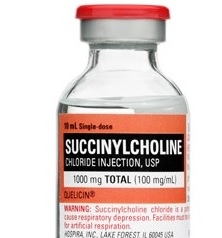
Терминальная стадия почечной недостаточности не является абсолютным противопоказанием к использованию сукцинилхолина. У всех пациентов с ХПН вне зависимости от того, какой вид диализной терапии они получают, активность псевдохолинэстеразы снижена примерно на 20%. Больной может находиться на перитонеальном диализе или гемодиализе либо не нуждаться в диализной терапии, в любом случае стандартная доза сукцинилхолина для интубации не приводит к продленной мышечной релаксации, если, конечно, у пациента нет атипичной формы сывороточной холинэстеразы. У пациентов как с терминальной стадией почечной недостаточности, так и без нее после введения интубационной дозы сукцинилхолина происходит увеличение уровня калия в крови. Такой подъем калия хорошо переносится и не несет в себе дополнительного риска для сердечно-сосудистой системы даже при исходной концентрации калия более 5 ммоль/л.
У больных с терминальной стадией почечной недостаточности наблюдается пролонгированное действие недеполяризующих мышечных релаксантов в силу того, что их элиминация зависит от функции почек. Атракурий и цисатракурий метаболизируются с участием плазменной холинэстеразы и посредством спонтанной элиминация Хоффмана. Таким образом, продолжительность действия этих препаратов не зависит от функции почек или печени. В то же время пациенты с терминальной стадией почечной недостаточности обладают повышенной чувствительностью к векуронию, что сопровождается увеличением продолжительности его действия в организме. То же относится и к рокуронию, продолжительность действия которого удлиняется при назначении в дозе 0,6 мг/кг.
К ингаляционным анестетикам относят десфлуран, изофлуран и севофлуран. Образующиеся в процессе метаболизма севофлурана вещества могут проявлять нефротоксичность, но контролируемых исследований, в которых были бы продемонстрированы безопасность или повреждающее действие севофлурана на трансплантированную почку, нет. Существуют два соображения, касающиеся токсичности севофлурана: метаболизм севофлурана с образованием фторид-иона и образование субстанции А при разрушении севофлурана сорбентом на основе гидроксида натрия или бария. Несмотря на это, севофлуран зарекомендовал себя безопасным препаратом. Он был использован у десятков миллионов пациентов во всем мире, однако достоверных доказательств его почечной токсичности нет. Два исследования, проведенные на добровольцах, обнаружили биохимические доказательства повреждения почек во время анестезии севофлураном, однако пять других исследований не подтвердили эту информацию. Однако, как отметил Artru в своей недавней работе, при трансплантации почки создаются условия повышенного риска ее повреждения. В двух исследованиях было показано, что севофлуран при потоке свежего газа свыше 4 л/мин не оказывает влияние на клинико-лабораторные показатели работы почек у пациентов с исходно нарушенной почечной функцией. Кроме того, у пациентов с почечной недостаточностью не отмечено значимых эффектов на такие показатели почечной функции, как концентрация креатинина и клиренс креатинина при проведении им низкопоточной анестезии севофлураном или изофлураном.
Что касается периоперационного обезболивания, то такие лекарства, как морфин, меперидин и оксикодон следует использовать с осторожностью, так как выведение этих препаратов или их метаболитов зависит от функции почек, и они могут накапливаться в организме. Безопасной альтернативой являются:
-
фентанил;
-
суфентанил;
-
альфентанил;
-
ремифентанил.
Фармакокинетика суфентанила практически не отличается у здоровых людей и у пациентов с терминальной стадией ХПН. Время действия ремифентанила достаточно коротко даже у пациентов c терминальной стадией ХПН. Его основной метаболит GR90291 элиминируется преимущественно через почки. Тот факт, что метаболит в 4000 раз менее активен, чем исходное вещество, позволяет безопасно применять ремифентанил у этой группы пациентов.
После снятия зажимов с подвздошных сосудов и реперфузии трансплантата возможно развитие гипотензии. В связи с тем, что функция почечного трансплантата во многом зависит от адекватной перфузии, необходимо приложить все усилия для предотвращения любого значимого эпизода гипотензии. Считается, что такие вазоконстрикторы с выраженным а-адренергическим эффектом, как фенилэфрин, в этой группе пациентов следует использовать в последнюю очередь. Несколько исследований на животных продемонстрировали повышенную чувствительность сосудов трансплантируемого органа к симпатомиметикам, поэтому эти препараты могут ухудшать почечный кровоток.
Немедленная продукция мочи наблюдается в 90% случаев трансплантаций от живого донора и в 40-70% случаев трансплантаций от трупного донора. На заключительном этапе зашивания раны снижение темпа диуреза вероятнее всего указывает на механическое сдавление трансплантата, сосудов или мочеточника. Катетер Фолея необходимо промыть, чтобы удостовериться, что его проходимость не нарушена тромбом либо тканями. При возможности интраоперационная ультрасонография может быть использована для оценки кровотока в артериальном и венозном анастомозах. В течение операции, помимо поддержания адекватного перфузионного давления, для стимулирования образования мочи дополнительно используются такие препараты, как маннитол, петлевые диуретики и иногда дофамин, хотя данные за и против их использования достаточно противоречивы.
Маннитол фильтруется почками без последующей канальцевой реабсорбции, что вызывает осмотическое увеличение объема мочи. Кроме того, он может обладать защитным эффектом на клетки, выстилающие почечные канальцы. Маннитол обычно назначают донорам перед пробуждением и реципиентам перед снятием зажимов с артерии. В этом случае он может защитить пересаженную почку от ишемического повреждения и индуцировать осмотический диурез. В большинстве центров назначают небольшие дозы маннитола, от 0,5 до 1,5 мг/кг, и данные о резких изменениях в концентрации электролитов на фоне применения маннитола необоснованны. Есть данные, что применение маннитола в интраоперационном периоде может предотвратить отсроченную функцию трупного почечного трансплантата.
Петлевые диуретики блокируют №+/К+-насос в тонкой восходящей части петли Генле, препятствуя реабсорбции электролитов в этом отделе нефрона. Высокоосмолярная жидкость, попадая в дистальную часть канальца, предотвращает реабсорбцию воды и способствует выведению большого объема воды с высокой концентрацией электролитов. Хотя увеличение диуреза является основным эффектом петлевых диуретиков, их способность предотвращать развитие олигурии также может быть важным результатом.
Так называемая «почечная» или низкая доза дофамина обычно используется для стимуляции DA1-дофаминовых рецепторов сосудов почки, что вызывает вазодилятацию и увеличивает темп диуреза. Что касается трансплантированной почки, то в ряде исследований продемонстрировано увеличение диуреза и клиренса креатинина при использовании низких доз дофамина, в то время как в более масштабных исследованиях существенное улучшение обнаружено не было. Целесообразность данной методики ставится под сомнение, так как трансплантированная почка, лишенная иннервации, возможно, не будет реагировать на низкие дозы дофамина так же, как и нормальная почка. Данные, полученные с помощью допплерографии, не продемонстрировали изменений в почечном кровотоке при инфузии дофамина в дозе от 1 до 5 мкг/кг/мин.
Еще один агонист дофамина, фенолдопам, сохраняет почечный кровоток во время искусственного кровообращения при операциях, сопровождающихся пережатием аорты, и у больных в критическом состоянии. Эффекты данного препарата на функцию пересаженной почки изучены не были.
Послеоперационное ведение
У всех пациентов после трансплантации почки необходимо обеспечить полную реверсию мышечного блока, по возможности, экстубировать и перевести в палату пробуждения. В послеоперационном периоде эти больные достаточно редко нуждаются в переводе в отделение интенсивной терапии – по данным крупных наблюдений около 1%. Причиной перевода в реанимацию обычно является сепсис или перегрузка жидкостью.
Темп мочеотделения должен тщательно мониторироваться, и в случае значимого его снижения следует заподозрить возникновение устранимой механической проблемы с новой почкой. Недопустимо откладывать повторную ревизию раны при подозрении на перекрут сосудистых структур, обструкцию мочеточника на протяжении либо в месте его имплантации в мочевой пузырь. Боль в послеоперационном периоде обычно носит умеренный характер. В одном исследовании было показано, что интраоперационное применение определенного анестетика может повлиять на уровень контроля послеоперационной боли. У пациентов, получавших пропофол, быстрее восстанавливались психомоторные функции, а пациент-контролируемая аналгезия была более эффективной, нежели у больных, получавших галотан либо изофлуран. Выполнение межреберной блокады не влияет на уровень послеоперационной боли и эффективность пациент-контролируемой аналгезии.
Пациентов с хорошей работой трансплантата, оцениваемой по лабораторным маркерам, и с достаточным диурезом следует рассматривать как имеющих адекватную функцию почек. Средний уровень клубочковой фильтрации через 6 месяцев после трансплантации от умершего донора составляет примерно 50 мл/мин. С течением времени примерно у 50% пациентов наблюдается постепенное снижение гломерулярной фильтрации, но у 30% эта величина остается неизменной.
Учитывая улучшение выживаемости после трансплантации почки, вероятнее всего, стремительное развитие сердечно-сосудистой патологии несколько замедляется, но не останавливается. Эти пациенты по-прежнему подвергаются большему кардиологическому риску, чем те, у которых не было терминальной стадии почечной недостаточности. Связано это, в основном, с наличием постоянных факторов риска, таких как артериальная гипертензия, диабет, дислипидемия и вторичный гиперпаратиреоз. Выраженное прогрессирование кальциноза коронарных сосудов отмечается у больных как минимум через год после операции. Этот процесс зависит от ряда факторов:
-
этнической принадлежности;
-
артериального давления;
-
индекса массы тела;
-
функции почек;
-
исходного уровня кальцификации коронарных сосудов.
У пациентов, которым требуется проведение кардиохирургического вмешательства после успешной трансплантации почки, частота осложнений в первые 30 дней не отличается от популяции нетрансплантированных пациентов, за исключением повышения риска развития почечной недостаточности и необходимости в гемодиализе. Значительное повышение уровня сердечно-сосудистой заболеваемости связано не только с исходными кардиологическими рисками, но и с развитием отторжения трансплантата, вирусной инфекции, анемии, а также с применением иммуносупрессивных лекарств, в частности циклоспорина. Создается впечатление, что новые иммуносупрессанты имеют лучшую переносимость. Застойная сердечная недостаточность, гипертрофия левого желудочка и ишемическая болезнь сердца остаются серьезными осложнениями у реципиентов почечных трансплантатов.
Живые доноры почки
В последние годы быстро возрастает количество трансплантаций почек от живых доноров. Ранее нефрэктомия у донора выполнялась либо через традиционный латеральный подреберный доступ, либо с помощью минимальной инцизионной методики, либо лапароскопическим способом. На современном этапе лапароскопический забор почки у живого донора практически полностью вытеснил традиционный открытый подреберный латеральный доступ. Melcher с соавт. докладывали о проведении 500 последовательных лапароскопических заборов донорских почек без перехода к открытому доступу или необходимости в повторной операции по причине технических трудностей. Показано, что лапароскопическая техника имеет ряд преимуществ над другими методиками в отношении уменьшения послеоперационного болевого синдрома, продолжительности госпитализации, ускорения выздоровления и лучшего косметического эффекта.
Частота осложнений у живых почечных доноров низкая, а их характер зависит от вида хирургической техники. Matas с соавт. сообщили о двух летальных исходах и персистирующем вегетативном состоянии одного донора после выполнения 10 828 последовательных заборов почек от живых доноров в период с 1999 по 2001 гг. Shokeir46 провел мета-анализ 69 исследований, сравнивая традиционную и лапароскопическую нефрэктомии у доноров, и обнаружил восемь периоперационных летальных исходов после лапароскопических нефрэктомий. Недавно опубликованные работы подтверждают безопасность, скорейшее выздоровление и более низкий уровень потребности в опиодных аналгетиках при выполнении лапароскопического забора донорской почки по сравнению с открытой операцией. Постановка эпидурального катетера в данном случае не показана. Тем не менее, Elisson с соавт. высказали предположение о возможных не столь очевидных отдаленных рисках и о необходимости получения данных о более длительных сроках наблюдения.
Любая из двух почек является пригодной для донорства, однако обычно предпочтение отдается левой ввиду более простого хирургического доступа и длинной сосудистой ножки. Пациента укладывают в левое либо правое латеральное положение со сгибанием операционного стола. Необходимость в инвазивном мониторинге отсутствует, достаточно постановки одного либо двух периферических венозных катетеров большого диаметра. В некоторых центрах принято иметь в операционной 2 дозы эритроцитарной массы на случай повреждения крупных сосудистых структур, что может потребовать выполнения экстренной лапаротомии. С целью поддержания адекватного диуреза и оптимизации функции трансплантата волемическая нагрузка во время операции должна быть обильной, несмотря на минимальную кровопотерю в большинстве случаев. Пока неизвестно, какой именно инфузионной среде должно быть отдано предпочтение, поскольку клинических исследований по данному вопросу нет. По этой причине большинство центров используют изотонические растворы кристаллоидов. Техника ведения анестезии у этих практически здоровых пациентов не отличается от таковой при других лапароскопических вмешательствах. Использование закиси азота противопоказано по причине вздутия петель кишечника и ухудшения обзора операционного поля. Во время проведения данного вмешательства возможно возникновение осложнений, характерных для всех лапароскопических операций.
Первый этап операции представляет собой мобилизацию толстой кишки и верхнего полюса почки с последующим выделением и диссекцией мочеточника, почечной вены и артерии. Также производится выделение надпочечниковой вены. С целью поддержания адекватного объема диуреза хирург может попросить о введении фуросемида либо маннитола. Незадолго до пережатия почечных сосудов внутривенно вводится гепарин. В различных центрах протоколы могут варьировать, и взаимодействие анестезиолога и хирурга является необходимым. После мобилизации почки и пересечения питающих ее сосудов орган извлекается с использованием техники «hand-assisted» или «non-hand-assisted»52 под контролем лапароскопа через небольшой разрез в пери- или инфраумбиликальной области. С целью нормализации коагуляции после использования гепарина может быть введен протамин. После извлечения почки выполняется ревизия операционного поля на предмет кровотечения. Ушивание раны, как и при всех лапароскопических вмешательствах, производится достаточно быстро, поэтому следует обратить внимание на нейтрализацию нейромышечного блока по окончании процедуры. Болевой синдром, как правило, умеренный и может быть легко купирован дополнительным внутривенным введением опиоидных аналгетиков в раннем послеоперационном периоде.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии