Операция Фонтена: показания, этапы, последствия, лекарственные препараты
В отличие от паллиативных вмешательств, коррекция гемодинамики «в обход правого желудочка» решает основную задачу — разобщение системного и легочного кругов кровообращения. При этом исключается возможность смешивания венозной и артериальной крови, а также нормализуется ее насыщение кислородом в большом круге, что приводит к исчезновению симптомов гипоксемии. Кроме того, уменьшается объемная перегрузка единственного желудочка и приостанавливается расширение его полости.
В результате операции Fontan возникает новый тип кровообращения — без участия правого желудочка. Механизмы, осуществляющие кровоток по легким при таком типе кровообращения, в настоящее время недостаточно изучены. Вероятнее всего, он поддерживается за счет повышения правопредсердного давления, изменения внутригрудного давления при акте дыхания и образования возможного интервала для опорожнения легочных вен, что создает условия для исчезновения чрезлегочного градиента.
Показания к операции и критерии отбора больных
В 1977 г. был проведен анализ результатов операции Fontan у разной категории больных определены критерии, влияющие на хирургический риск полной коррекции гемодинамики в обход правого желудочка. Риск операции повышается у больных:
-
в возрасте младше 4 лет и старше 15 лет;
-
при нарушениях ритма сердца в виде полной AV-блокады или мерцательной аритмии;
-
с нетипичным впадением системных и легочных вен;
-
с увеличенным объемом правого предсердия;
-
с повышенным средним давлением в легочной артерии;
-
с повышенным ЛСС;
-
при отношении диаметра легочного ствола к диаметру аорты < 0,75;
-
при фракции выброса желудочка менее 60%;
-
с недостаточностью AV-клапана;
-
при наличии вредных последствий ранее выполненного системно-легочного анастомоза.
Как показали дальнейшие исследования, только около 30% больных с одножелудочковым сердцем отвечают идеальным условиям для операции Fontan. В остальных случаях существует тот или иной фактор риска, а в некоторых и по нескольку, которые могут оказать влияние на результат операции.
В настоящее время абсолютным противопоказанием является лишь повышенное ЛСС и сниженная сократимость желудочка.
Повышенное давление в легочной артерии не всегда может быть противопоказанием к выполнению операции Fontan. Если повышенное давление сопровождается высоким ЛСС, гемодинамическая коррекция обречена на неудачу. Невысокое ЛСС сохраняет возможность успешного результата операции при условии, что оперативное лечение будет проводиться поэтапно. В качестве предварительного этапа выполняют суживание легочного ствола и формируют ДКПА.
Многие специалисты считают, что гемодинамическую коррекцию возможно выполнить у больных с гиперволемической формой легочной гипертезии, т. е. в случаях, когда величина среднего давления в легочной артерии не превышает 60% системного давления. Среди прооперированных в ходе исследования было трое больных, у которых среднее давление в легочной артерии было выше 15 мм рт. ст. Все они успешно перенесли операцию Fontan.
У них была гиперволемическая форма легочной гипертензии и ЛСС находилось в пределах 1,2-2 ед/м2. У двоих пациентов операция Fontan была выполнена в один этап, у одного — в два этапа.
Вопрос о противопоказаниях у пациентов с наличием сужений легочных артерий решается в зависимости от характера сужений и возможности их устранения оперативным путем. Fontan-коррекция не показана больным с резкой гипоплазией легочных артерий на всем протяжении. Локальные сужения возможно устранить путем пластической реконструкции, которую выполняют во время подготовительного этапа или во время операции Fontan. На подготовительном этапе пластику сужений лучше сочетать с формированием ДКПА.
Авторы определили нормальную величину индекса легочных артерий, которая составляет 330+30 мм2/м2. Они также показали, что безопасной величиной индекса для выполнения операции Fontan является величина больше 250 мм2/м2. Girod и соавторы не выявили значительной разницы в летальности между пациентами, у которых индекс легочных артерий превышал 250 мм2/м2, и теми, у кого он был меньше. Не смогли установить значимость индекса Nakata и другие исследователи. Они подчеркивают, что для кровообращения по Fontan более значимым является сопротивление, которое возникает на прекапиллярном и посткапиллярном уровнях.
Senzaky и соавторы, изучая влияние величины индекса легочных артерий на послеоперационную гемодинамику у пациентов, перенесших операцию Fontan, не нашли коррелляции между индексом Nakata и ЛСС, но установили корреляцию между индексом легочных артерий и комплайнсом легочных сосудов. Их исследования показали, что плохая растяжимость легочных сосудов влияла на повышение центрального венозного давления после операции. Они также установили взаимосвязь между малыми размерами легочных артерий и худшими показателями гемодинамики в послеоперационном периоде.
В последнее время для определения степени гипоплазии легочных артерий стали применять индекс нижнедолевых легочных артерий. Нормальная величина этого показателя составляет 120+30 мм2/м2. Считается, что этот индекс более достоверно отражает развитость сосудистого русла легких.
Kawahira и соавторы считают, что наиболее информативным показателем, отражающим пропускную способность сосудистого ложа легких у пациентов с одножелудочковым сердцем, является диаметр легочных вен. Они предлагают вычислять индекс легочных вен, который основан на том же принципе, что и индекс Nakata. Разница состоит в том, что вместо суммарного поперечного сечения легочных артерий вычисляют сумму поперечного сечения легочных вен. Диаметр легочных вен измеряют проксимально от входа их в предсердие в позднюю фазу легочной артериографии. По их данным, у пациентов, которые успешно перенесли операцию по формированию ДКПА, индекс легочных вен составлял 361 + 153 мм2/м2, а в случаях неудовлетворительного результата операции — 275 + 60 мм2/м2.
Они установили, что для пациентов, которые успешно перенесли операцию Fontan, этот индекс был меньше 2 мм рт. ст./мм2/м2, а с плохим результатом операции — 4,4 мм рт. ст./мм2/м2.
Размеры правого предсердия, а также наличие нарушений ритма отнесены к факторам риска в связи с тем, что в прошлом использовали модификации операции Fontan, при которых правое предсердие выполняло функцию насоса, нагнетающего кровь в легочное русло. Поэтому результат операции зависел от сократительной способности правого предсердия. Применение модификации с исключением правого предсердия в качестве насоса в виде полного кавопульмонального соединения, а также использование двухкамерных водителей ритма в случаях нарушения ритма позволяет пренебрегать этими критериями.
Серьезным фактором риска у кандидатов на операцию Fontan является наличие умеренной или выраженной недостаточности AV-клапанов. Почти у всех больных с одножелудочковым сердцем она сочетается с ухудшением сократительной функции миокарда. В большинстве случаев недостаточность клапана возникает вследствие дилатации доминирующего желудочка. Существовали предположения, что выполнение ДКПА может способствовать уменьшению обратного тока на AV-клапане, так как вследствие этого уменьшается объемная перегрузка желудочка. К сожалению, несмотря на уменьшение объемной нагрузки, недостаточность AV-клапана прогрессирует и ухудшает результат операции.
Возраст больных не является противопоказанием к выполнению операции Fontan. Теоретически операцию Fontan невозможно выполнить лишь в течение первого года жизни. Это связано с повышенным ЛСС в этом возрасте. Детям старше 1 года коррекция гемодинамики возможна, но ее проведение очень рискованно в связи с трудностями регулирования гомеостаза у маленьких детей в раннем послеоперационном периоде. Значительно легче контролировать послеоперационный период у детей старше 4 лет. Поэтому желательно дать возможность ребенку пережить этот критический период с помощью паллиативных операций.
У взрослых пациентов вследствие гипоксических изменений стенки легочных сосудов могут возникать процессы, которые влияют на повышение ЛСС. Также прогрессируют изменения в миокарде желудочка, приводящие к уменьшению его сократимости. Эти факторы не могут не влиять на результаты операции Fontan у взрослых пациентов, поэтому возраст от 4 до 15 лет считается оптимальным для ее выполнения. Но это не значит, что у пациентов до 4 лет или после 15 лет невозможно добиться положительного результата операции Fontan. Успех зависит от показателей сократительной способности желудочка и ЛСС.
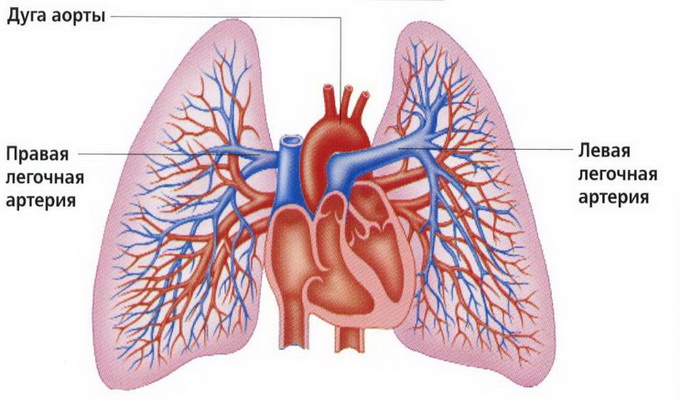
Идеальными кандидатами на операцию Fontan являются пациенты с ЛСС меньше 2 ед/м2 по Wood и средним давлением в легочной артерии меньше 15 мм рт. ст.. У больных с ЛСС больше 4 ед/м2 очень высок риск возникновения в послеоперационном периоде малого сердечного выброса и венозной гипертензии. До операции трудно предсказать обратимость повышенного сопротивления, даже если отмечается положительная кислородная проба, выполненная во время зондирования.
Повышение давления в легочной артерии может быть связано с увеличенным легочным кровотоком или с повышенным конечно-диастолическим давлением в левом желудочке. Mayer и соавторы в своих исследованиях установили, что само по себе повышенное давление в легочной артерии не является фактором риска. Однако пациентам, у которых оно больше 20-25 мм рт. ст., показано предварительное лечение, направленное на уменьшение легочного кровотока или на улучшение функции желудочка.
Снижение систолической и диастолической функции желудочка значительно увеличивает риск коррекции по Fontan. Она противопоказана при фракции выброса меньше 45% или КДДЛЖ больше 10 мм рт. ст. Дисфункция желудочка может быть связана с его объемной перегрузкой или обструкцией на выходе в системный круг кровообращения.
У пациентов с одножелудочковым сердцем определить функцию желудочка довольно сложно. Параметры функции желудочка в случаях с доминирующим левым желудочком сравнивают с показателями, которые отражают функцию левого желудочка при бивентрикулярной физиологии кровообращения и в случаях с доминирующим правым желудочком. Существенное значение для определения сократимости желудочка у пациентов до и после операции имеет оценка локального движения стенок. Graham и Johns установили, что фракция выброса у кандидатов на операцию Fontan должна быть >50%, но в случаях, когда она меньше этой величины, необходимо оценить конечно-систолическое напряжение сердечной мышцы и ее сократительную способность на всех участках доминирующего желудочка.
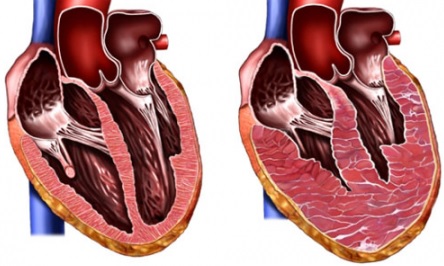
Не являются надежными существующие методики по оценке диастолической функции желудочка и его комплайнса. Очевидно лишь то, что у пациентов без признаков объемной перегрузки и с конечно-диастолическим давлением, превышающим 12 мм рт. ст., выполнять операцию Fontan нецелесообразно.
Не существует единственного или нескольких факторов, которые позволили бы автоматически исключить пациента как кандидата на операцию Fontan. У некоторых пациентов с ЕЖС по левому типу сократительная функция желудочка может восстанавливаться после конверсии желудочка в кровообращение Fontan. С помощью эхокардиографических исследований Sluysmans и соавторы установили, что объём желудочка у пациентов с двуприточным левым желудочком и АТК перед операцией Fontan в 2-3 раза больше нормальной величины. У пациентов, которым выполняли ДКПА или операцию Fontan в возрасте младше 10 лет, после операции уменьшались объём доминирующего желудочка и напряжение его стенки. Также улучшались функция желудочка и сократительная способность миокарда, в то время как у пациентов, оперированных после 10 лет, улучшение функции левого желудочка было незначительным. Авторы установили, что послеоперационная функциональная способность желудочка была обратно пропорциональна возрасту и насыщению крови кислородом в аорте до операции.
Характерными для одножелудочкового сердца являются локальные нарушения движения миокардиальной стенки. Kurotobi и соавторы считают, что причиной нарушений систолической функции является наличие рудиментарной камеры. Их исследования показали, что локальные нарушения сократимости стенки связаны с асинхронным сокращением рудиментарной и доминирующей желудочковых камер. Существуют и другие факторы, которые ухудшают сократимость миокарда. К ним относятся первичные нарушения организации мышечных волокон, нарушения проводимости в желудочках, фиброз миокарда вследствие хронической перегрузки объёмом и давлением и др.
Seliem и соавторы установили взаимосвязь неудовлетворительных результатов операции Fontan и величины массы левого желудочка. В связи с этим для предотвращения гипертрофии миокарда рекомендуют раннюю физиологическую коррекцию и применяют на этапах хирургического лечения системно-легочные анастомозов с небольшим шунтированием. Graham и Johns установили, что пациенты, у которых масса желудочка превышает 200% нормы, не могут быть кандидатами на операцию.
Наиболее частой формой ЕЖС, при которой гипертрофия желудочка сказывается на результате операции, является двуприточный левый желудочек с ТМА после суживания легочного ствола. Размеры ДМЖП в этих случаях обычно меньше диаметра корня аорты, поэтому гипертрофия миокарда способствует обструкции выхода в аорту из доминирующей левожелудочковой камеры. Этот фактор может быть нейтрализован путём этапого лечения — наложения ДКПА и устранения обструкции выхода в аорту путем примения процедуры Damus-Kaye-Stansel или расширения ДМЖП.
Для отбора кандидатов на операцию Fontan Mair и соавторы предлагают индекс, который отражает сочетание основных факторов, влияющих на исход коррекции. Ими являются ЛСС, конечно-диастолическое давление в желудочке и соотношение величин легочного и системного кровотоков.
Учет этого индекса позволил прогнозировать величину давления в правом предсердии после операции и за счет отбора больных добиться снижения операционной летальности до 5 %.
Еще одним из показателей, позволяющих прогнозировать исход операции Fontan, является величина чрезлегочного градиента давления. Некоторые авторы предлагают дополнить вышеперечисленные факторы риска еще одним.
Этим фактором является величина кровотока через аортолегочные коллатерали. Наличие аортолегочных коллатералей встречается у 59-84% претендентов на операцию Fontan.
После выполнения операции Fontan через аортолегочные коллатерали кровь из аорты шунтируется в легочные артерии, в результате чего может возникать объемная перегрузка единственного желудочка, а также оставаться повышенными легочный кровоток и давление в легочной артерии, что способствует увеличению чрезлегочного градиента давления.
Spicer и соавторы установили, что у больных со значимыми аортолегочными коллатералями, выявленными во время катетеризации сердца, после операции Fontan отмечалась длительная транссудация в плевральные полости.
McElhinney и соавторы приводят противоположные данные. Они отмечают, что у пациентов с наличием значимых аортолегочных коллатералей продолжительность транссудации после операции Fontan была значительно меньше по сравнению с теми, у кого они отсутствовали.
Среди аномалий сердца с функционально единственным желудочком существует порок, при котором ведущей патологией является гипоплазия правого желудочка. Показания к выбору метода хирургического лечения при этом зависят от степени гипоплазии правого желудочка, которая определяется величиной конечно-диастолического объема правого желудочка, соотношением линейных размеров приточного и выводного отделов, а также диаметром трехстворчатого клапана. Считается, что в случаях умеренной гипоплазии правого желудочка, при которой конечно-диастолический объем составляет в среднем 70% возрастной нормы, а соотношение приточного и выводного отделов больше 0,73, после выполнения радикальной коррекции сопутствующих пороков правый желудочек сможет обеспечить адекватный минутный объем малого круга кровообращения. Напротив, при резкой гипоплазии правого желудочка, когда конечно-диастолический объем его составляет в среднем 47% возрастной нормы, а соотношение приточного и выводного отделов в среднем 0,63, эта вероятность минимальна, поэтому таким больным показана гемодинамическая коррекция. В промежуточной группе может быть выполнен любой из вариантов указанных операций, но риск радикального вмешательства повышен.
Измерение линейных размеров правого желудочка осуществляют методом ангиокардиометрии. Длина путей притока измеряется от середины трехстворчатого клапана до верхушки, а путей оттока — от верхушки до клапана легочного ствола.
Величина окружности кольца отверстия трехстворчатого клапана и его диаметр могут с определенной достоверностью указывать на степень гипоплазии правого желудочка.
Окружность кольца правого предсердно-желудочкового отверстия, при котором возможна радикальная коррекция, по данным Alboliras и соавторов, должен составлять 70% нормы, тогда как при величине его менее 55% нормы показана операция гемодинамической коррекции порока. У большинства больных с окружностью отверстия трехстворчатого клапана, составляющей 55-70% нормы, также следует устанавливать показания к коррекции по Fontan и лишь у отдельных пациентов — к радикальной операции сопутствующих пороков.
Учитывая, что по размерам отверстия трехстворчатого клапана можно судить о степени гипоплазии правого желудочка, de Leval и соавторы при определении показаний к операции у больных с АЛА и интактной межжелудочковой перегородкой ориентируются именно на этот показатель. Проведя анализ результатов хирургического лечения 51 больного и сопоставив результаты разных типов операций в зависимости от степени уменьшения диаметра отверстия трехстворчатого клапана, авторы вывели доверительную границу. Если диаметр отверстия трехстворчатого клапана выше доверительной границы для данного возраста больного, показана анатомическая коррекция, если ниже — операция Fontan или другой вид паллиативного вмешательства.

Некоторые специалисты, на основании собственного опыта, пришли к такому заключению: всем больным без исключения при наличии гипоплазии правого желудочка безопаснее применять комбинированный метод хирургического лечения. Он включает в себя элементы радикальной коррекции и частичного «обхода» правого желудочка путем формирования кавопульмонального анастомоза. У пациентов с выраженной гипоплазией правого желудочка также может быть применен данный метод хирургического лечения, но в этих случаях при возникновении признаков малого сердечного выброса необходимо оставлять частично открытым ДМПП.
Особенности кровообращения при различных модификациях операции Fontan
Атриовентрикулярное соединение
В ходе выполнения операции Fontan у больных с наличием подлегочной желудочковой камеры напрашивается вовлечение ее в качестве вспомогательного звена, которое бы потенцировало легочный кровоток. В первую очередь это касается пациентов с АТК. Поэтому и была предложена модификация в виде AV-соединения.
Bull и соавторы показали, что вовлечение подлегочной желудочковой камеры в кровообращение Fontan не влияет на его основные характеристики в случаях, когда наблюдается правопредсерднозависимый легочный кровоток. При записи кривых давления в послеоперационном периоде они не наблюдали появления желудочковой волны и увеличения величины среднего давления в легочной артерии по сравнению с правым предсердием. В некоторых случаях после операции наблюдается увеличение полости рудиментарного желудочка и он может выполнять ударную работу, в результате которой предсерднозависимый легочный кровоток превращается в двухжелудочковый. У такого желудочка обязательно должна быть трабекулярная часть и полость, составляющая не меньше 30% нормы. Только такие условия позволяют получить кровообращение с участием двух желудочков. Во избежание возврата крови в полые вены необходимо имплантировать клапан между правым предсердием и желудочком. Недостатки, связанные с имплантацией клапана, являются противовесом тем положительным сторонам, которых можно достичь в результате вовлечения в кровообращение подлегочной желудочковой камеры.
В случаях, когда легочный кровоток остается предсерднозависимым, вовлеченная в кровообращение Fontan правожелудочковая камера и клапанный аппарат во время диастолы препятствуют передаче сокращений в легочную артерию. Потеря энергии во время диастолы в данной ситуации значительно больше, чем ее увеличение за счет систолического выброса, осуществленного маленьким желудочком.
Атриопульмональное соединение
Использование правого предсердия в качестве насосной камеры, обеспечивающей легочный кровоток в кровообращении Fontan, являлось первоначальной идеей создания кровообращения «в обход» правого желудочка. Исходя из этого, Fontan и Baudet в своих первых операциях имплантировали клапаны на входе в предсердие и на выходе из него. Необходимым условием для выполнения операции являлось также наличие гипертрофии стенки правого предсердия. Вскоре стало ясно, что в имплантации клапанов нет необходимости и операцию можно выполнять при отсутствии гипертрофии стенки правого предсердия.
При кровообращении с участием двух желудочков правое предсердие выполняет функцию усиливающего насоса. Оно увеличивает приток венозной крови в правый желудочек. Давление в системных венах снижается во время сокращения предсердия и повышается, когда активность его уменьшается. В условиях атриопульмонального соединения правое предсердие действует в качестве клапанно-сократительной камеры, расположенной между системными венами и легочным артериальным руслом. В таком состоянии оно преимущественно служит как клапан, предотвращающий обратный ток крови в системные вены, а не как насосная камера, выбрасывающая кровь в малый круг кровообращения.
Экспериментальные исследования на животных, у которых создавали кровообращение по Fontan, не подтвердили факта выполнения правым предсердием функции насосной камеры, перекачивающей венозную кровь в легкие. У пациентов, перенесших операцию Fontan в виде клапансодержащего атриопульмонального соустья, записи кривых давления не показали увеличения среднего давления в легочной артерии. Сокращение стенки правого предсердия уменьшает размер его полости и проталкивает кровь в наиболее податливое рядом расположенное пространство. При нормальном кровообращении этим пространством является полость правого желудочка. Теоретически сокращения правого председрия могут проталкивать кровь в легочную артерию при двух условиях:
-
систолическая функция правого председрия должна быть достаточной, чтобы обеспечить необходимое давление и расслабление его стенки для осуществления кровообращения по Fontan;
-
сопротивление по антеградному току крови должно быть ниже, чем сопротивление ретроградного тока крови.
Изучение кривых функции правого предсердия показало, что усиление его систолы наблюдается при условии, когда продолжительность диастолы находится выше определенной точки, расположенной на кривой Frank-Starling. Точка критического расслабления правого предсердия, при котором начинает уменьшаться интенсивность систолы, как показали исследования Payne и соавторов, в каждом конкретном случае разная и зависит от степени гипертрофии стенки правого предсердия. Так, при АТК, при которой стенка правого предсердия гипертрофирована, этот уровень находится, как правило, в восходящей части кривой, тогда как при ЕЖС, при котором стенка предсердия тонкая, он может находиться в нисходящей части. Однако преимущества хорошей сократимости правого предсердия во многом ограничиваются низким сопротивлением в системных венах, что создает условия обратному току крови в венозное русло.
Полное кавопульмональное соединение
Экспериментальные исследования, проведенные de Leval и соавторами на гидродинамической модели, привели к иному пониманию роли правого предсердия в цикле кровообращения по Fontan. Использование правого предсердия в качестве нагнетательной камеры фактически оказывает больше вреда, чем пользы. Так, данные исследования позволяют утверждать, что с точки зрения гидродинамики атриопульмональное соединение является не лучшим вариантом операции Fontan. Негативным моментом атриопульмонального соединения является возникновение турбулентности крови, изменения естественного тока крови из полых вен к атриопульмональному соустью. При сокращениях предсердия турбулентность усиливается.
При полном кавопульмональном соединении кровь из ВПВ отводится прямо в легочные артерии и из НПВ кровь также попадает в легочные артерии через прямой внутрипредсердный канал. Следовательно, отсутствуют условия для возникновения турбулентности на пути тока крови. Установлено, что поток жидкости на модели был в основном ламинарным, за исключением места, где встречаются потоки из обеих полых вен в области анастомозирования их с правой легочной артерией.
Другим преимуществом данной модификации является меньший застой крови в канале по сравнению с прямым атриопульмональным соустьем, поэтому уменьшается вероятность возникновения тромбоза предсердия. В связи с тем, что большая часть предсердия изолирована от растяжения давлением, при этом виде вмешательства уменьшается также вероятность возникновения нарушений ритма. Кроме того, полное кавопульмональное соединение является простым хирургическим вмешательством, которое можно использовать при всех типах анатомического строения сердца с функционально единственным желудочком без риска повреждения AV-узла. При этой операции коронарный синус остается в зоне низкого давления, что важно для сохранения хорошего кровоснабжения миокарда.
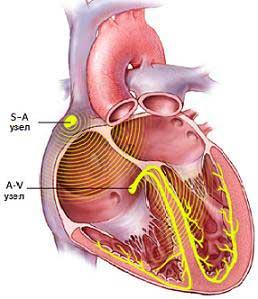
Методики выполнения полной гемодинамической коррекции
После исследований de Leval и соавторов, в результате которых были установлены недостатки атриопульмонального соединения, большинство хирургов отказались от этого варианта гемодинамической коррекции. В связи с этим целый ряд модификаций операции Fontan в виде атриопульмонального соединения в настоящее время имеет только историческое значение. Операцией выбора является полное кавопульмональное соединение.
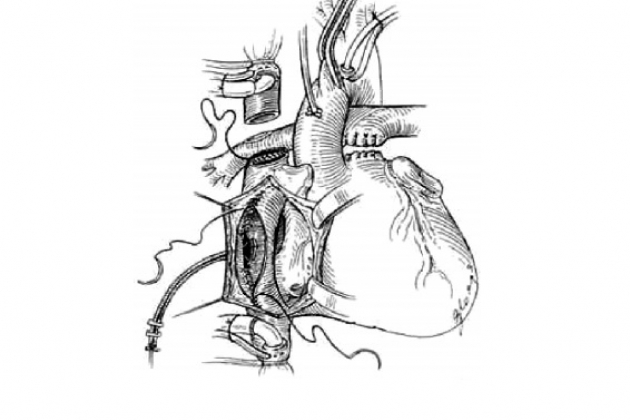
Техника полного кавопульмонального соединения
Операцию начинают, как и при формировании ДКПА. Выполняют субтотальную резекцию правой доли вилочковой железы. Выкраивают заплату из аутоперикарда, из которой может быть сформирован внутрипредсердный канал. Перикард может также понадобиться для расширения соустья полой вены и легочной артерии или для пластики сужений легочных артерий, если таковые имеются. Верхнюю полую вену мобилизуют полностью на всем протяжении до места впадения в нее безымянной вены. При отделении ее от перикарда стараются не повредить диафрагмальный нерв. Выделяют также и непарную вену, чтобы можно было ее пережать во время наложения анастомозов. Ствол и обе легочные артерии освобождают от окружающих тканей до места разделения их на сегментарные ветви. Артериальную связку перевязывают и отсекают от легочной артерии. Если ранее был наложен системно-легочный анастомоз, его отсекают от легочной артерии.
Восходящую аорту канюлируют обычно. Полые вены канюлируют изогнутыми под прямым углом канюлями, ВПВ — возле места впадения в нее безымянной вены, НПВ — в месте кавоатриального соединения.

Начинают искусственное кровообращение и охлаждают больного. Вокруг канюли ВПВ обжимают тесьмой. Ниже места канюляции, на расстоянии 4-5 мм кверху от кавоатриального соустья, ВПВ пережимают сосудистым зажимом и пересекают. Затем на сокращающемся сердце накладывают анастомоз между головным концом ВПВ и верхней стенкой правой легочной артерии, как при выполнении ДКПА. Во время формирования этого анастомоза больного охлаждают до 22-24 0С, в результате чего наступает гипотермическая остановка сердца. Далее пересекают легочный ствол и его проксимальный конец ушивают двурядным непрерывным швом. Сердечный конец ВПВ рассекают спереди и медиально, чтобы его диаметр соответствовал диаметру НПВ, оставляя неповрежденной артерию синусового узла. В случаях, когда легочная артерия располагается сзади и справа от аорты, сердечный конец ВПВ анастомо- зируют прямо к дистальной части легочного ствола. Когда магистральные артерии располагаются нормально или легочный ствол находится слева от аорты, пересеченную часть легочной артерии ушивают непрерывным швом, а ВПВ анастомози- руют с нижним краем правой легочной артерии. Для расширения соустья иногда используют маленькую треугольную заплату, которую вшивают в переднемедиальной плоскости.
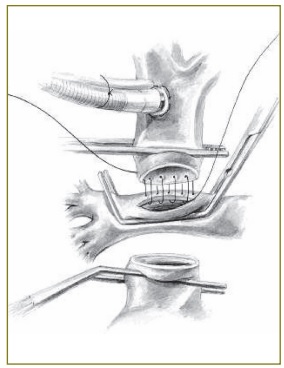
Следующий этап операции заключается в создании внутрипредсердного канала, через который отводится кровь из НПВ к соустью между легочной артерией и кардиальным концом ВПВ. Эту часть операции выполняют в условиях кардиопле- гии. Для этого пережимают восходящую аорту и вводят кардиоплегический раствор. Разрез на правом предсердии делают параллельно разграничивающей борозде. Для создания внутрипредсердного канала может применяться различный материал. Он может быть сформирован из политетрафлюороэтиленового протеза, который подшивают к окружностям мест впадения полых вен, или являться комбинацией заплаты со стенкой венозного синуса. Мы предпочитаем использовать заплату из аутоперикарда, обработанную 1% раствором глютаральдегида, или заплату из политетрафлюороэтилена.
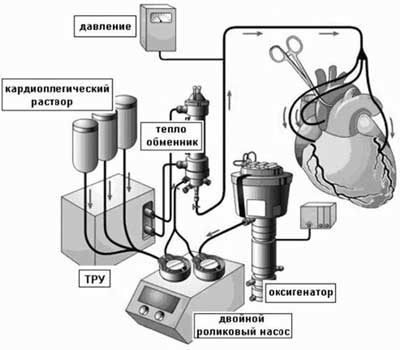
При создании канала с использованием заплаты измеряют расстояние между устьями полых вен. Длина заплаты не должна превышать это расстояние. Ширина ее должна быть такова, чтобы вместе со стенкой венозного синуса был образован канал диаметром 16-18 мм. Заплату подшивают латерально вдоль crista terminalis, снизу и сверху — к окружностям полых вен и сзади — к межпредсердной перегородке. Коронарный синус оставляют вне внутрипредсердного туннеля, чтобы он дренировался через ДМПП в левое предсердие. После этого ушивают стенку правого предсердия, производят эвакуацию воздуха из полостей сердца и снимают зажим с аорты.
В зависимости от патологии могут использоваться дополнительные процедуры:
-
билатеральные кавопульмональные анастомозы;
-
пластические операции на клапанах при их недостаточности или их протезирование;
-
закрытие заплатой AV-клапана при его недостаточности;
-
создание ДМПП.
Существуют несколько альтернативных методик для создания полного кавопульмонального соединения. Среди них — методика, в основе которой лежит создание внутрипредсердного туннеля из стенки предсердия по типу операции Senning. Основным недостатком этой методики является большая вероятность возникновения нарушений ритма в послеоперационном периоде.
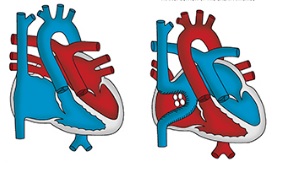
Полное кавопульмональное соединение с разгрузочным отверстием
Ранняя послеоперационная летальность после операции Fontan может быть связана с преходящими гемодинамическими нарушениями, такими, как повышение сопротивления легочных сосудов или дисфункция системного желудочка. Любое из этих нарушений приводит к гипертензии в системных венах. В результате высокого венозного давления происходит просачивание жидкости из капиллярного русла в интерстициальное пространство, а также в плевральные, брюшную и перикардиальную полости. Венозная гипертензия также вызывает повышение давления в лимфатической системе легких и застойные явления, в результате чего повышается ЛСС. Кроме того, внезапное уменьшение объемной нагрузки на единственный желудочек, которое возникает после операции Fontan, может привести к резким изменениям геометрии желудочка. Это вызывает ухудшение его диастолической функции и уменьшение сердечного выброса вплоть до критического. Применение полного кавопульмонального соединения с созданием разгрузочного отверстия в стенке внутрипредсердного канала позволяет ограничить влияние порочных механизмов кровообращения по Fontan на выживаемость и раннее послеоперационное течение.
Создание разгрузочного отверстия сохраняет возможность право-левого сброса крови, за счет которого поддерживается сердечный выброс при ухудшении диастолической функции желудочка и ограничивается повышение давления в полых венах. Умеренное снижение насыщения артериальной крови кислородом вследствие перемешивания ее с венозной кровью компенсируется повышением величины сердечного выброса.
Существует несколько методик создания разгрузочного отверстия в канале, разграничивающего кровоток по системным и легочным венам. Одна из них предусматривает создание резидуального отверстия в месте подшивания заплаты, образующий туннель, к задней стенке предсердия. Посередине линии шва, прикрепляющего заплату к задней стенке предсердия, оставляют отверстие, не вовлеченное в шов. Матрацный шов с прокладками накладывают вокруг отверстия и выводят через боковую стенку предсердия наружу. Под контролем зрения шов затягивают для того, чтобы проверить, насколько герметично он будет закрывать отверстие. Затем его отпускают и герметизируют стенку правого предсердия. Матрацный шов пропускают в длинный турникет, конец которого выводят через белую линию живота под кожу. Таким образом, можно легко регулировать величину отверстия в раннем послеоперационном периоде.

Мы просекаем разгрузочное отверстие в стенке канала калиброванными перфораторами. Диаметр отверстия зависит от возраста больного и факторов риска. Чтобы насыщение артериальной крови было не ниже 85%, для разгрузки венозной системы достаточно отверстия диаметром 4-6 мм. При использовании аутоперикардиальной заплаты для формирования канала ее необходимо перед употреблением обработать 1% раствором глютаральдегида.
Для венозной разгрузки можно использовать несколько небольших отверстий диаметром до 2 мм, созданных с помощью толстой иглы. Имеются наблюдения, что эти маленькие отверстия со временем самопроизвольно закрываются.
Через некоторое время при сниженном насыщении артериальной крови кислородом отверстие может быть закрыто. Это можно сделать оперативным путем или путем катететеризации сердца с помощью специального устройства.
Недостатком фенестрации является повышенный риск возникновения тромбоэмболии в сосуды головного мозга и другие системные органы в отдаленном послеоперационном периоде.
О пользе разгрузочного отверстия свидетельствуют снижение ранней послеоперационной летальности и уменьшение транссудации. Отмечено, что со временем отверстие может спонтанно закрыться. Так, у 90% пациентов с разгрузочными отверстиям диаметром 2,5 мм они закрывались спонтанно в течение первого года после операции. Спонтанное закрытие фенестра диаметром 4 мм отмечается в 64% случаев.
Некоторые хирурги используют методику частичного отведения печеночных вен от нижней полой вены таким образом, что одна или несколько печеночных вен остаются вне кавопульмонального соединения и дренируются вместе с коронарным синусом в левое предсердие. Однако эта методика хуже предыдущих в связи с тем, что в некоторых случаях наблюдается переток венозной крови на уровне печеночных вен, в результате чего увеличивается количество сбрасываемой венозной крови в левое предсердие и значительно снижается насыщение артериальной крови кислородом. Кроме этого, исключение попадания печеночной крови в легкие способствует развитию артериовенозных фистул после операции.
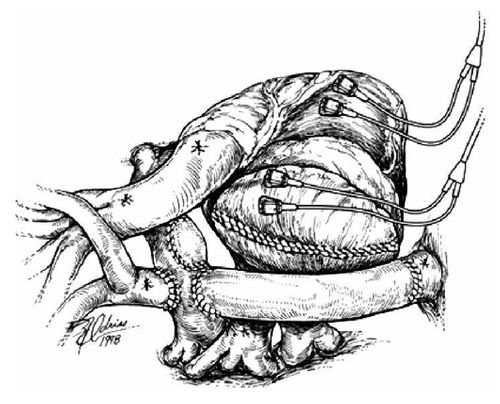
Экстракардиальное полное кавопульмональное соединение
В последнее время стала популярной одна из модификаций операции Fontan в виде экстракардиального полного кавопульмонального соединения. Эта модификация имеет некоторые преимущества по сравнению с ранее описанными. В частности, экстракардиальное соединение выполняют без пережатия аорты, что предотвращает ишемию миокарда. Также исключается возможность воздействия высокого давления на стенку правого предсердия и вовлечения в шов большого количества тканей, в результате чего уменьшается вероятность возникновения аритмий в послеоперационном периоде.
Операцию выполняют из срединного доступа в условиях искусственного кровообращения. Выделяют легочные артерии, восходящую аорту, верхнюю и нижнюю полые вены. Канюлируют восходящую аорту и обе полые вены. В НПВ канюлю вводят как можно ближе к диафрагме, а в ВПВ — в месте впадения левой плечеголовной вены. После перехода на искусственное кровообращение обжимают тесемки вокруг канюль на полых венах.
На сокращающемся сердце без пережатия аорты накладывают зажим у устья ВПВ, на 4-5 мм дистальнее кавоатриального соединения. Головной конец ВПВ анастомозируют с правой легочной артерией аналогично тому, как это делают при выполнении ДКПА. Кардиальный конец ВПВ ушивают непрерывным швом. Затем накладывают зажим на основание правого предсердия, проксимально от места его соединения с НПВ. Предсердие пересекают ниже зажима, в результате чего остается часть правого предсердия в виде скошенной манжетки НПВ. Культю правого предсердия ушивают непрерывным швом ниже зажима. Продольным разрезом вскрывают нижнюю стенку правой легочной артерии. При наличии сужений проксимального участка легочной артерии разрез продлевают к центру и латерально — при наличии сужения ее дистальной части. Следующим этапом вшивают гибкий трубчатый протез. Лучше всего использовать сосудистый протез из политетрафлюороэтилена диаметром 20-22 мм или аортальный аллографт без клапана. Конец протеза обрезают под углом и анастомозируют «конец в конец» с НПВ непрерывным обвивным швом. Протез располагают так, чтобы его дуга находилась впереди верхней правой легочной вены и простиралась к разрезу правой легочной артерии. Край протеза обрезают таким образом, чтобы он соответствовал контуру разреза на легочной артерии. При необходимости протезом можно расширить участок сужения на ней. После наложения анастомоза между протезом и правой легочной артерией проверяют, не сдавливает ли он рядом лежащие структуры. Из протеза эвакуируют воздух и отпускают тесемки на полых венах.

Если необходимо оставить небольшое сообщение между протезом и правым предсердием, формируют прямой анастомоз или их соединяют сосудистым протезом соответствующего диаметра. Для того чтобы в послеоперационном периоде можно было регулировать размеры сообщения, анастомоз, соединяющий экстракардиальный «кондуит» и правое предсердие, обводят лигатурной нитью, которую проводят в турникет.
После отключения искусственного кровообращения в экстракардиальное кавопульмональное соединение проводят катетер для измерения давления. С этой же целью канюлируют левое предсердие. После стабилизации гемодинамики измеряют давление в экстракардиальном кондуите. Если оно ниже 15 мм рт. ст., соустье между протезом и правым предсердием постепенно суживают под контролем давления в венозном канале. Если давление не превышает 15 мм рт. ст., соустье можно полностью перекрыть и удалить турникет. При повышенном венозном давлении турникет оставляют и выводят наружу через нижний угол раны.
В послеоперационном периоде всем пациентам необходимо назначать антикоагулянты для предотвращения тромбоза экстракардиального канала. Регуляция размера сообщения между венозным каналом и правым предсердием может понадобиться в раннем послеоперационном периоде. В зависимости от течения оно может быть частично открытым или полностью перекрытым в раннем послеоперационном периоде или позже.
Интра-экстракардиальное полное кавопульмональное соединение
Альтернативной техникой является имплантация интра-экстракардиального кондуита, которая особенно полезна у пациентов с множествнными отверстиями печеночных вен, открывающихся в правое предсердие. Пациентов охлаждают до 22°С, чтобы иметь возможность снизить кровоток. Полые вены обжимают турникетами, вводят в аорту кардиоплегический раствор для остановки сердца. Производят продольный разрез правого предсердия до нижнего кавоатриального соединения. Снижают скорость кровотока, пережимают и удаляют канюлю НПВ, заменяя ее тонким отсосным наконечником.
Отверстия НПВ и печеночных вен должны быть хорошо видны. Подбирают трубку из GoreTex подходящего размера и пришивают ее вокруг всех венозных отверстий. Линию шва начинают с медиального края отверстия НПВ. После анастомозирования нижнего конца кондуита последний выводят наружу сердца через отверстие в предсердии. Выбирают место перфорации кондуита внутри предсердия и просекают 4-мм отверстие аортальным пробойником. Далее края разреза предсердия пришивают к наружной поверхности кондуита непрерывным 5/0 или 6/0 проленовым швом. Верхний конец трубки должен быть без натяжения и избытка прилажен к нижней поверхности правой легочной артерии. Выполняют разрез правой легочной артерии от места ее отхождения до начала ветвления. Анастомоз выполняют непрерывным 6/0 проленовым швом. Отсосный наконечник удаляют из НПВ и через отверстие, ограниченное кисетным швом, вводят венозную канюлю. Аорту заполняют кровью, удаляют воздух и больного согревают.
Особенности ведения раннего послеоперационного периода
Ведение раннего послеоперационного периода у больных, перенесших операцию Fontan, имеет специфические особенности. При данной модели кровобращения источником энергии является только один желудочек, который обеспечивает кровоток как в системных, так и в легочных сосудах. Поэтому очень важно, чтобы сопротивление потоку крови на всех ее участках было минимальным. В связи с этим надо быть абсолютно уверенным в отсутствии градиента давления между полыми венами и легочными артериями. Градиент давления больше 2 мм рт. ст. указывает на наличие существенного сужения в месте анастомоза, которое необходимо устранить.
Для оценки состояния кровообращения в первые 24 ч после операции важными показателями являются величины давления в правом и левом предсердиях. Если операция выполнена адекватно, показатель отношения среднего давления в правом предсердии к среднему давлению в левом предсердии должен быть около 2, что является отражением оптимальных условий кровотока в малом круге кровообращения при отсутствии в нем активной нагнетающей камеры. Повышение давления в левом предсердии неизбежно приводит к повышению давления в правом предсердии из-за возрастания постнагрузки. Считается, что после операций, которые предусматривают двухжелудочковый тип кровообращения, среднее давление в левом предсердии должно быть в пределах 14 мм рт. ст. После операции Fontan такое давление может существенно ухудшить легочный кровоток.
Для обеспечения нормального сердечного выброса правопредсердное давление необходимо поддерживать на уровне 10-15 мм рт. ст. Если для поддержания адекватной гемодинамики в раннем послеоперационном периоде необходимо повысить давление в правом предсердии выше 16 мм рт. ст., это свидетельствует о наличии факторов, негативно влияющих на кровообращение: сужения в месте анастомоза, высокого ЛСС, гипоплазии легочных артерий, а также высокого давления в левом предсердии из-за патологии AV-клапанов или миокардиальной недостаточности. Указанные факторы приводят к повышению давления в правом предсердии, а это, в свою очередь, ухудшает гемодинамику и усиливает транссудацию.

Известно, что на обеспечение артериального кровотока расходуется около 90% энергии системного желудочка, а венозного — только 10%. В цикле кровообращения по Fontan легочный кровоток является продолжением венозного, поэтому единственный желудочек должен затрачивать энергию на преодоление не только сопротивления системных сосудов, но и общелегочного сопротивления. Повышение венозного давления в результате Fontan-коррекции приводит к рефлекторному повышению тонуса артериол, что также влияет на постнагрузку. Вследствие этого возникает необходимость в применении вазодилататоров для снижения общего периферического сопротивления. Также необходимо создать оптимальный режим вентиляции легких в целях предотвращения повышения ЛСС. Во время самостоятельного дыхания ЛСС ниже, чем при искусственной вентиляции легких, поэтому мы предпочитаем переводить больных на самостоятельное дыхание как можно раньше, если позволяет состояние гемодинамики. При спонтанном дыхании во время вдоха давление в плевральных полостях и легочных капиллярах снижается, что облегчает приток крови в малый круг кровообращения и увеличивает сердечный выброс. Во время искусственной вентиляции при поступлении газовой смеси в легкие повышается внутрилегочное давление, а это приводит к уменьшению притока крови к правому предсердию и ухудшению легочного кровотока. В эксперименте Shemin и соавторы обнаружили снижение кровотока по атриопульмональному кондуиту при повышении дыхательного объема и давления на вдохе. Во время выдоха кровоток по кондуиту резко возрастал. Вместе с тем, общий объем протека- емой крови не менялся. Williams и соавторы изучали влияние искусственной вентиляции с положительным давлением в конце выдоха на гемодинамику у больных после операции Fontan. Они установили, что положительное давление в конце выдоха существенно повышало РаО2. Однако с нарастанием давления снижался сердечный выброс. Падение величины сердечного выброса было связано с повышением ЛСС. В то же время многолетний клинический опыт показывает, что на практике вредное влияние искусственной вентиляции на гемодинамику можно наблюдать не так часто.
В связи с тем, что при данной модели кровообращения имеется тенденция к просачиванию жидкости из кровяного русла в интерстициальное пространство, необходимое давление в правом предсердии должно поддерживаться за счет инфузии раствора 10% альбумина или нативной плазмы. Для поддержания адекватного сердечного выброса обычно требуется инотропная поддержка допамином.
В наблюдениях в назначении допамина нуждались 84 % больных. Доза допамина у выживших больных не превышала 10 мкг/кг/мин. Отмечено, что у пациентов, умерших вследствие синдрома малого сердечного выброса, увеличение дозы выше 10 мкг/кг/мин не оказывало существенного эффекта.
Одним из важных моментов ведения раннего послеоперационного периода является определение возможности пациента адаптироваться к физиологии кровообращения по Fontan. Больным, которые не могут приспособиться к этому типу кровообращения, в целях сохранения жизни следует предпринять срочное вмешательство по конверсии его в состояние, приближенное к исходному. Признаками недостаточности кровообращения по Fontan являются:
-
повышенное венозное давление;
-
артериальная гипотония;
-
олигурия;
-
нарушение периферического кровообращения;
-
резистентность к высоким дозам инотропной поддержки.
Наличие стойкого повышенного давления в левом предсердии, также является угрожающим признаком. В этих случаях немедленно должны быть произведены эхокардиография и катетеризация сердца для выявления дефектов коррекции, которые следует сразу же устранить. Если это невозможно, необходимо конвертировать операцию Fontan в ДКПА или системно-легочный анастомоз. По данным Castaneda и соавторов, трансформация кровообращения Fontan в ДКПА предпочтительнее другого варианта.
Наиболее частым осложнением раннего послеоперационного периода является выраженная транссудация в плевральные, перикардиальную и брюшную полости. В связи с этим обязательным компонентом операции является дренирование всех полостей.
Возникновение транссудации связано с повышением системного венозного давления. Предполагается, что в механизме транссудации важную роль играет венозный застой в органах брюшной полости. Среди наших больных после ДКПА, у которых отмечалось повышение венозного давления только в верхней половине туловища, транссудация наблюдалась значительно реже, чем у пациентов, перенесших полную коррекцию по Fontan. Jacobs и Norwood наблюдали существенное снижение частоты возникновения транссудации в плевральные полости у больных, которым во время выполнения операции Fontan печеночные вены отводили в левое предсердие. Необходимо также отметить, что стенки капилляров печени обладают большей проницаемостью, чем стенки капилляров других органов.
Опыт показывает, что частота возникновения транссудации у пациентов после операции Fontan с разгрузочным отверстием была меньше, чем у пациентов без фенестрации венозного канала. Наличие фенестра также сказалось на уменьшении продолжительности транссудации.
В последнее время установлено, что в генезе выпотевания жидкости в экстравазальное пространство имеет значение повышение уровня натрийуретического фактора в плазме крови, который способствует усилению транссудации. В дальнейшем Mainwaring и соавторы показали, что у пациентов с кровообращением по Fontan наблюдается усиленная эндокринная реакция, проявляющаяся повышением уровня антидиуретического гормона, альдостерона, ренина и ангиотензина II. Эти данные позволили сделать предположение о том, что повышенная активность ренин-ангиотензиновой системы также принимает участие в патогенезе транссудации. Такая взаимосвязь была подтверждена последующими исследованиями.
У детей младшего возраста риск возникновения стойкой транссудации значительно выше, чем у старших. Установлено, что проницаемость системных капилляров у них выражена больше. Этим объясняется большая вероятность возникновения и тяжесть протекания этих осложнений у младенцев.
В связи с потерей белка из-за транссудации возникает необходимость в его ежедневном восполнении. В первые дни после операции это достигается путем внутривенных инфузий белковых препаратов, а в последующем — сочетанием сбалансированного питания, обеспечивающего синтез нового белка, с инфузией белковых препаратов. Кроме того, назначают диету с исключением жиров, соли и ограничением употребления жидкости. Если транссудация не прекращается в течение 2-3 нед после операции, для исключения причин анатомического характера производят катетеризацию сердца.
В течение первых 3-6 нед прекратившаяся транссудация может возобновиться, поэтому больные должны находиться под постоянным наблюдением врача. В этот период им назначают диуретики и рекомендуют соблюдение режима с ограничением приема жидкости и соли.
Серьезным осложнением ближайшего послеоперационного периода является хилоторакс. Если в первые дни после операции обычно наблюдается выпот серозной жидкости, то при длительной транссудации всегда следует ожидать хилоторакс. Причины развития данного осложнения до конца не выяснены. Если исключить простую травму грудного протока во время операции, то появление этого осложнения, очевидно, связано с чрезмерным повышением венозного давления, вследствие которого нарушается дренаж лимфы. Подобное осложнение встречается и у больных без выраженного повышения венозного давления. Лечение хилоторакса включает выполнение плевральных пункций, диетотерапию, восстановление нормального уровня белка крови. В случаях, когда не удается избавиться от лимфореи путем консервативного лечения, можно сформировать торакоабдоминальный шунт. Для этих целей лучше использовать армированную силиконовую трубку, которую проводят в плевральную полость через VI межреберный промежуток и фиксируют к надкостнице ребра. Второй конец силиконовой трубки проводят через подкожный канал и отверстие в брюшной стенке в полость живота.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии