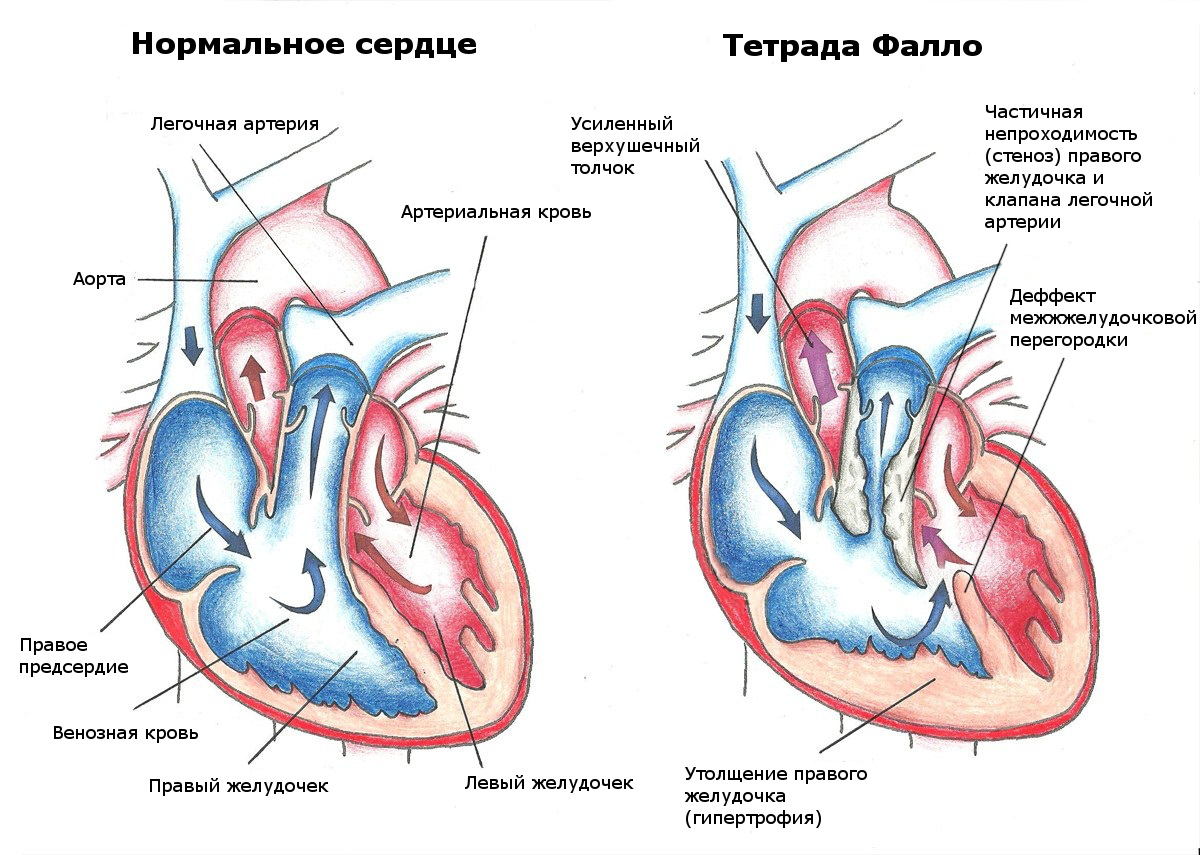
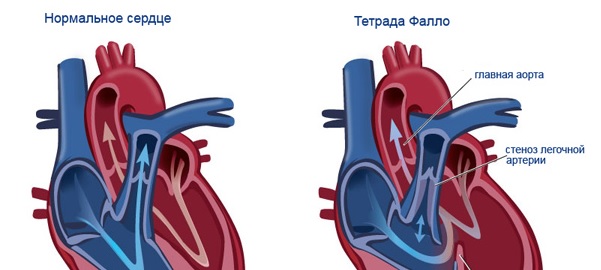
Лечение тетрады Фалло: способы, этапы, рекомендации врачей
Естественное течение тетрады Фалло — это история возникновения и неуклонного прогрессирования гипоксемии, цианоза и связанных с ними органных проявлений. Приблизительно 40% больных цианотичны с момента рождения. Около 25% детей, не имевших цианоза, становятся синюшными через недели, месяцы и годы по мере их соматического роста. Степень цианоза со временем усиливается в связи с прогрессированием сужения и полицитемии. У некоторых больных развивается аортальная недостаточность вследствие дилатации аорты. С возрастом увеличивается вероятность возникновения мозговых инсультов и абсцессов мозга, септического эндокардита. При длительно существующем цианозе развивается коагулопатия. Средняя продолжительность жизни таких больных составляет 12-15 лет. Вторую декаду жизни переживают только 8% пациентов. Выживаемость больных зрелого и пожилого возраста является казуистической редкостью, хотя и описаны наблюдения таких пациентов в 5, 6-й и даже 7-й декадах жизни. Основными причинами смерти неоперированных больных являются:
-
со стороны центральной нервной системы — нарушения гемо- и ликвородинамики, эмболия и тромбоз сосудов головного мозга, абсцессы головного мозга;
-
со стороны легких — тромбозы периферических легочных сосудов и легочные кровотечения;
-
со стороны сердца — сердечная недостаточность, инфекционный эндокардит.
В раннем возрасте типичной причиной смерти являются одышечно-цианотические приступы.
Лечение
Медикаментозное
Перед операцией необходимо следить за уровнем гемоглобина и эритроцитов в крови. Особое внимание обращают на низкий или чрезмерно высокий уровень этих показателей. Низкий уровень гемоглобина необходимо корригировать назначением железосодержащих препаратов. При выраженных нарушениях свертывающей системы крови проводят подготовку к операции путем замещения крови плазмой и ее компонентами.
Одним из тяжелых осложнений порока является бактериальный эндокардит, особенно часто возникающий у пациентов с системно-легочным анастомозом. Коррекция порока не снижает частоты развития бактериального эндокардита. В целях профилактики этого осложнения необходимо проводить своевременное лечение кариеса даже молочных зубов.
Одышечно-цианотические приступы могут иметь фатальные последствия у пациентов с некорригированной тетрадой Фалло. Большинство приступов купируется при помощи довольно простых медикаментозных методов, но само их появление рассматривается как показание к немедленной хирургической коррекции порока. Лечение приступа должно разорвать порочный круг, лежащий в его основе. К методам купирования приступов относятся в первую очередь создание вынужденного положения пациента, аналогичного тому, которое принимают пациенты с тетрадой Фалло при гипоксии. Ребенка укладывают на спину, колени подтягивают к животу; или ребенка младшего возраста удерживают в вертикальном положении, прижав к груди с поджатыми ножками. Это положение эффективно благодаря повышению общего периферического сопротивления за счет временного выключения из кровообращения большого бассейна артериальной системы. Наружное сдавление брюшной аорты является альтернативным приемом, который также обеспечивает повышение общего периферического сопротивления, что позволяет купировать приступ. Во время приступа показана ингаляция кислорода.

При отсутствии эффекта следует применить более интенсивную программу лечения:
1. Периферические вазоконстрикторы, обладающие а-миметическим действием. Например, фенилэфрин введенный внутривенно в дозе 0,02 мг/кг, позволяет увеличить периферическое сопротивление и легочный кровоток.
2. Кетамин, введенный внутривенно в дозе 1-3 мг/ кг в течение 60 с, увеличивает сопротивление системных сосудов и успокаивает ребенка. Если есть возможность, можно ввести морфин-сульфат в дозе 0,2 мг/кг подкожно или внутримышечно. Его эффективность связана с прямым отрицательным инотропным действием на инфундибулярные мышцы правого желудочка или с воздействием препарата на центральную нервную систему, которое позволяет разорвать замкнутый круг «гипоксия-возбуждение» благодаря угнетению дыхательного центра и устранению гиперпноэ.
3. Пропранолол в дозе 0,01-0,25 мг/кг, вводимый медленно внутривенно, снижает частоту сердечных сокращений и расслабляет тонус инфундибулярного отдела правого желудочка. Могут быть использованы и другие р-адреноблокаторы.
4. Другие методы купирования приступа, такие, как увеличение объема циркулирующей крови, приводят к повышению системного давления и снижению право-левого сброса крови.
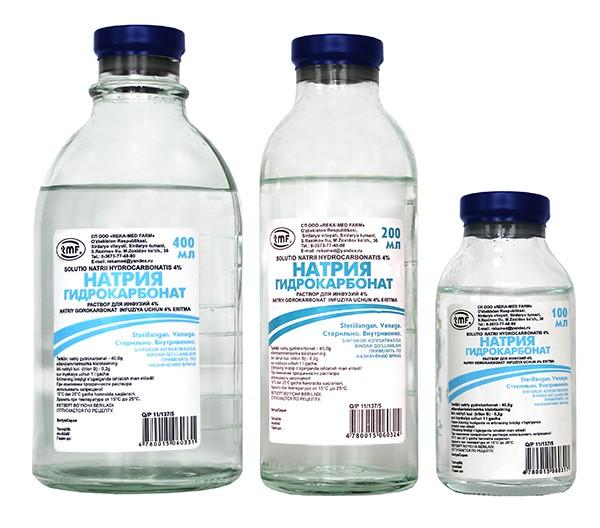
5. Для борьбы с ацидозом вводят натрия бикарбонат в дозе 1 мэкв внутривенно. Ту же дозу можно повторено ввести через 10-15 мин. Натрия бикарбонат снижает стимулирующее влияние ацидоза на дыхательный центр.
После проведенного лечения ребенок становится менее цианотичным, сердечный шум — более громким, что указывает на увеличение легочного кровотока через спазмированный выводной тракт правого желудочка. Крайне редко, несмотря на проводимую терапию, приступ продолжается и может потребоваться хирургическое вмешательство по неотложным показаниям. Прервать приступ может также общий наркоз.
Для предупреждения гипоксических приступов пациентам назначают пропранолол внутрь по 2-6 мг/кг в день, разделенные на 3-4 приема. Это позволяет избежать смерти ребенка вдали от хирургического центра и отсрочить операцию у больных высокого риска.
Хирургическое
-
История.
Первое паллиативное вмешательство было выполнено в 1945 г. Blalock в Балтиморе совместно с педиатром Taussig. Именно она подсказала идею соединения между большим и малым кругами кровообращения для хирургического лечения тетрады Фалло в целях устранения гипоксемии. Прямой подключично-легочный анастомоз имитировал ОАП. В зарубежной литературе ошибочно считают, что Klinner и соавторы в 1962 г. первыми применили синтетический сосудистый протез между подключичной и легочной артериями — техника, которую возродили de Leval и соавторы, применившие трубку из политерафлюороэтилена. Она получила наименование «модифицированный анастомоз по Blalock—Taussig». Соблюдение исторической справедливости требует настойчивого напоминания, что в нашей стране А.А. Вишневский и Д.А. Донецкий разработали операцию шунтирования между подключичной и легочной артериями с помощью лиофилизированного гомотрансплантата, которую впервые осуществили в 1958 г. Этот материал использовался долгие годы, пока в клиническую практику не были внедрены синтетические сосудистые протезы, а сама операция в среде отечественных кардиохирургов до сих пор носит имя ее авторов. При определении авторского первенства логично принять за основу принцип предложенной операции, а не использованный материал. Существенное дополнение к методике операции внесли Laks и Castaneda, которые показали преимущество использования подключичной артерии с противоположной от дуги аорты стороны.
В 1946 г. Potts и соавторы наложили прямой анастомоз между нисходящей аортой и левой легочной артерией. В 1955 г. Davidson сообщил о первом «центральном» аортолегочном анастомозе, и в 1962 г. Waterston выполнил прямой анастомоз восходящей аорты с правой легочной артерией. В 1948 г. Sellors и Brock пополнили список паллиативных операций закрытой легочной вальвулотомией и инфундибулотомией.
31 апреля 1954 г. произошло знаменательное событие, которое открыло эру внутрисердечной хирургии. Lillehei и соавторы впервые в открытом поле зрения, используя контролируемое перекрестное кровообращение, выполнили первую анатомическую коррекцию тетрады Фалло у
10-месячного мальчика. Операция включала закрытие ДМЖП и устранение обструкции выводного тракта правого желудочка. Эта операция стала гимном дерзновенной устремленности хирургов и родительской жертвенности. Первый успех, окрыливший группу Lillehei, стал стимулом для быстрого накопления опыта. Всего с помощью этого метода были прооперированы 11 детей с тетрадой Фалло, 6 которых были младше 2 лет.
Уже через год, в 1955 г., Kirklin и соавторы сообщили о первой успешной операции по поводу тетрады Фалло в условиях искусственного кровообращения с помощью аппарата «сердце-легкие». Lillehei, имевший к тому времени большой опыт, понял необходимость расширения инфундибулума правого желудочка с помощью трансанулярной заплаты, о чем сообщил в 1956 г.
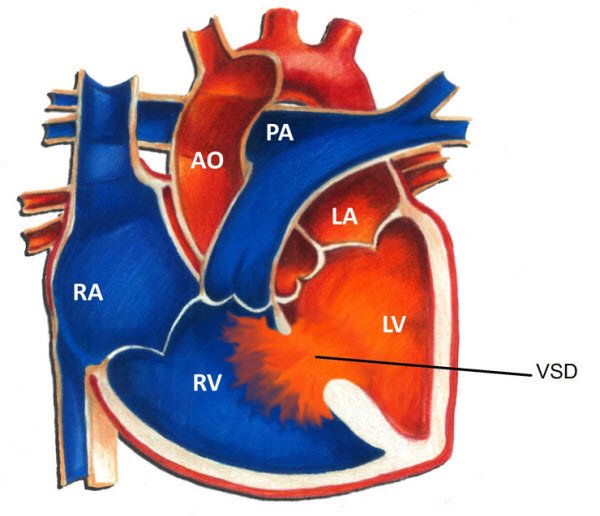
Н.М. Амосовым 10 марта 1960 г. в Киеве была выполнена первая успешная операция на открытом сердце в условиях искусственного кровообращения у мальчика с тетрадой Фалло.
Klinner первый сообщил об имплантации бесклапанного синтетического кондуита между правым желудочком и легочной артерией для лечения тетрады Фалло с АЛА. Применение клапанного аортального гомографта при этом варианте порока впервые описали Ross и Sommerville в 1966 г..
После первого успеха коррекции тетрады Фалло в младенческом возрасте последующие попытки ранних вмешательств сопровождались высокой летальностью, поэтому повсеместно утверждалось двухэтапное лечение. В 1969 г. Barratt-Boyes и Neutze успешно возродили первичную коррекцию тетрады Фалло у младенцев, применив метод гипотермической остановки кровообращения. В 1972 г. Castaneda внедрил раннюю коррекцию тетрады Фалло у детей первых 3 мес жизни.
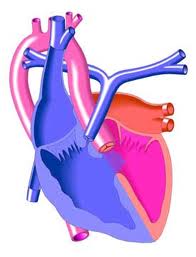
Показания и сроки проведения операции
Существуют различные взгляды на оптимальные сроки коррекции тетрады Фалло. Еще на заре эры хирургии открытого сердца несовершенство аппаратуры искусственного кровообращения и высокая летальность были причиной отказа от первичной коррекции в пользу двухэтапного лечения, предусматривающего вначале наложение паллиативного шунта. Впоследствии стало очевидным, что межсосудистые шунты также сопровождаются высокой летальностью и осложнениями. В частности, ранние типы анастомозов по Potts и по Waterston деформировали ветви легочной артерии и приводили к увеличению сосудистого сопротивления. Классический анастомоз по Blalock, наложенный в неонатальном периоде и в раннем младенческом возрасте, часто тромбируется. Этот анастомоз стал более надежным после внедрения de Leval в начале 80-х годов модифицированного шунта с помощью протеза из политетрафлюороэтилена.
Тем не менее, даже модифицированный анастомоз Blalock обычно вызывает рубцевание и деформацию легочной артерии в месте дистального анастомоза, что снижает податливость легочного артериального русла. Хороший комплайнс сосудистой системы смягчает отрицательный эффект легочной регургитации, которая сопровождает трансанулярную пластику. Модифицированный анастомоз по Blalock сопровождается утечкой крови из подключичной и позвоночной артерий с соответствующей симптоматикой. Однако при хороших коллатералях в основании мозга клинические проявления отсутствуют или минимальны. Редкими осложнениями классического анастомоза Blalock являются ишемия и гангрена конечности на стороне операции. В угрожающих случаях требуется реваскуляризация. Многие пациенты испытывают слабость в руке в течение многих лет после наложения анастомоза. Одним из редких ятрогенных летальных осложнений является ошибочное анастомозирование подключичной артерии с легочной веной. Такие случаи в реальной жизни встречаются чаще, чем в описаниях. Потенциальными недостатками модифицированного анастомоза по Blalock-Taussig являются также:
-
объемная перегрузка левого желудочка;
-
частичная обструкция или полная окклюзия шунта;
-
серома вокруг протеза вследствие порозности политетрафлюороэтилена;
-
синдром Горнера;
-
шунтовой эндокардит;
-
деформация легочной артерии;
-
обструктивная болезнь легочных сосудов.
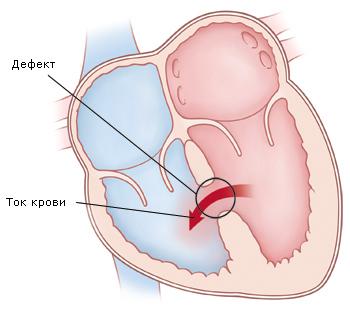
Ранние первичные операции имеют очевидные преимущества перед этапным лечением. При тетраде Фалло легочное сосудистое русло развивается в условиях низкого давления и уменьшенного кровотока, поэтому соотношение капилляров и альвеол снижено. Легкие формируются в течение первых нескольких лет жизни. Последствием отсрочки операции является уменьшение площади газообмена. Развитие сердца у не оперированного происходит с отклонениями от нормы. Наличие системного давления в правом желудочке приводит к гипертрофии его стенки, фиброзу и снижению комплайнса. В нормальном сердце правый желудочек обладает хорошей растяжимостью, что позволяет при нагрузке сильно увеличивать легочный кровоток без существенного повышения венозного давления. Преимущество ранних операций состоит в предупреждении гипертрофии и фиброза правого желудочка, обеспечении нормального роста легочных артерий и альвеолярной ткани, снижении частоты послеоперационных желудочковых эктопических нарушений ритма и внезапной смерти.
В передовых центрах детской кардиохирургии первичную коррекцию начали выполнять детям в возрасте 4-6 нед. Позже этого срока ткань боталлова протока, внедряющаяся в устье левой легочной артерии, может проявить себя в виде стеноза устья левой легочной артерии. Ранее считалось, что коррекция порока в младенческом возрасте повышает необходимость трансанулярной пластики, однако это не подтвердилось при сравнении результатов операций в разных возрастных группах. В настоящее время существенных противопоказаний к ранней первичной операции нет, хотя до недавнего времени считалось, что операцию целесообразно отложить при аномалиях коронарных артерий, множественных ДМЖП, несливающихся легочных артериях.
Паллиативные хирургические операции в виде системно-легочных анастомозов показаны у тяжелых синюшных больных в возрасте до 3 мес при АЛА, для смягчения клинического синдрома, в случаях некурабельных гипоксических приступов, для увеличения размеров гипоплазированного левого желудочка и расширения узких легочных артерий. Классический или модифицированный анастомоз по Blalock-Taussig между подключичной артерией и ипсилатеральной легочной артерией является операцией выбора у младенцев младше 3 мес. Правосторонний шунт выполняют у больных с левой дугой аорты, и наоборот, левосторонний шунт накладывают при правой дуге аорты. Модифицированный анастомоз с использованием сосудистого протеза из Gore-Tex накладывают у детей младше 3 мес, преимущественно со стороны дуги аорты.
-
Противопоказания.
Аномальное отхождение передней нисходящей коронарной артерии от правой коронарной артерии является показанием для имплантации кондуита в качестве параллельного тракта оттока правого желудочка поверх коронарной артерии. Существуют альтернативные методы, исключающие пересечение артерии: устранение инфундибулярного сужения чреспредсердным доступом и пластика заплатой выводного тракта выше и ниже коронарной артерии. В очень редких случаях возникает необходимость имплантации тонкого кондуита. При этом максимально расширяют естественный выводной тракт. Ожидается, что кондуит прослужит несколько лет и не станет причиной повторных вмешательств. Во всяком случае, их будет не больше, чем при этапном лечении с использованием межсосудистого анастомоза.
Множественные ДМЖП являются существенным дополнительным фактором риска, хотя эти дефекты можно, по крайней мере, уменьшить наложением швов. Только в очень редких случаях перегородки в виде швейцарского сыра операцию следует отсрочить, пока масса тела не увеличится и станет возможным применение катетерного устройства для обтурации дефектов.
При не сливающихся легочных артериях очень важно как можно раньше создать связь обеих легочных артерий с легочным стволом для обеспечения нормального развития центральных легочных артерий. В последующем может потребоваться баллонная ангиопластика места анастомозов. Эта процедура относительно проста и безопасна. Альтернативой раннему прямому анастомозу является отсрочка радикальной операции, которой предшествует наложение системно-легочного анастомоза с несвязанной легочной артерией. Это может привести к развитию окклюзивных изменений в легочных сосудах. Кроме того, наложение анастомоза приводит к фиброзу окружающих тканей и ухудшению условий и даже невозможности выполнения прямого анастомоза во время последующей полной коррекции, поэтому может понадобиться имплантация кондуита для создания связи изолированной легочной артерии с главным стволом.
Паллиативное хирургическое лечение
Паллиативное хирургическое лечение в настоящее время применяется в клиниках, не освоивших первичную радикальную коррекцию в раннем возрасте, а также при тяжелой гипоплазии легочных артерий. Существуют различные типы системно-легочного анастомоза, такие, как подключично-легочной анастомоз, анастомоз между нисходящей аортой и левой легочной артерией, восходящей аортой и правой легочной артерией. При использовании двух последних методов хирург обязан очень тщательно контролировать размер анастомоза: при избыточном анастомозе развивается застойная сердечная недостаточность и даже гипертензия в системе легочной артерии. Кроме того, при создании этого анастомоза велика вероятность перегиба легочной артерии, что создает технические трудности при проведении последующей радикальной коррекции. Подобные осложнения реже возникают при наложении анастомоза Blalock-Taussig. Выполнение этого анастомоза или его модификаций заключается в имплантации сосудистого протеза между подключичной и легочной артериями. В настоящее время предпочтение отдают именно этой методике. Анастомоз накладывают со стороны, противоположной дуге аорты, так как при этом вероятность перегиба соответствующей безымянной артерии меньше. Модифицированный анастомоз Blalock-Taussig можно выполнить с любой стороны. Наложение прямого анастомоза между дистальным участком подключичной артерии и легочной артерией трудновыполнимо без риска деформации легочной артерии и практически не применяется.
До настоящего времени продолжаются дебаты в отношении того, вызывает ли наложение анастомоза нарушение роста клапанного кольца легочной артерии и является ли обнаруживаемое на ангиограмме увеличение размера легочных артерий после наложения анастомоза следствием их роста или растяжения в результате повышения объема кровотока.
В некоторых центрах в качестве альтернативной паллиативной методики используется чрескожная баллонная дилатация выводного тракта правого желудочка. При последующей интраоперационной оценке серии подобных вмешательств было установлено значительное повреждение клапана легочной артерии, а также нарушение роста клапанного кольца, что вызывало необходимость выполнения трансанулярной пластики.
Полная коррекция
Время проведения окончательной радикальной операции определяется опытом, накопленным кардиохирургических центром. В настоящее время мы отдаем предпочтение ранним вмешательствам, начиная с 3-месячного возраста. У больных с благоприятной анатомией выводного тракта правого желудочка и легочных артерий радикальная операция выполняется в любое время после 3-4-месячного возраста. При более сложных анатомических условиях и после шунтирующих операций хирургическое лечение должно быть завершено у детей не старше 3-4 лет.
Радикальная операция состоит в закрытии ДМЖП заплатой, резекции элементов инфундибулярного сужения и при необходимости — трансанулярной пластики выводного тракта правого желудочка. Однако следует стараться сохранить кольцо клапана, используя два разреза — легочного ствола и правого желудочка.
В настоящее время госпитальная летальность составляет 3-5%, вне зависимости от возраста пациента.
В любой возрастной группе наличие у пациента сужения ветвей легочной артерии или их выраженной гипоплазии является основным фактором риска хирургической коррекции. Дооперационная количественная оценка размеров легочных артерий важна для предсказания величины давления в правом желудочке после коррекции порока и степени ее риска. Предложено несколько методов вычислений. McGoon предложил рассчитывать суммарное поперечное сечение правой и левой ветвей легочной артерии и соотносить его с поперечным сечением нисходящей аорты на уровне диафрагмы. Исходные данные получают по результатам ангиокардиографии. По данным автора, если указанное соотношение менее 0,5, первичная полная коррекция нецелесообразна. Если показатель превышает 1,2, давление в правом желудочке хорошо снижается. Позднее формула для расчета соотношения McGoon была модифицирована и вместо поперечных сечений в ней стали использовать диаметры соответствующих сосудов. Oku и соавторы предложили другой критерий, который выражался соотношением диаметров ствола и восходящей аорты. Если показатель меньше 3/10, радикальную операцию лучше отложить. Этот показатель практически бесполезен, так как хирургическое расширение легочного ствола является рутинным и эффективным элементом операции. Наконец, Nakata для определения сужения ветвей легочной артерии вычислял индекс, представляющий собой отношение суммарной площади поперечных сечений правой и левой ветвей легочной артерии к площади поверхности тела. Согласно исследованиям автора, в норме он равен 330±30 мм2/м2. У пациентов с тетрадой Фалло он колеблется от 100 до 250 мм2/м2. Нижней границей безопасности автор считает индекс, равный 100 мм2/м2.
Blackstone и соавторы разработали формулу, которая позволяет предсказать соотношение давлений в правом и левом желудочках в послеоперационном периоде. При максимальном устранении обструкции на уровне правого желудочка или его выводного тракта давление в желудочке зависит от упомянутого выше коэффициента McGoon, который можно определить при помощи ангиографии. Если не планируется вшивание трансанулярной заплаты, во время ангиографии определяют диаметр кольца легочной артерии, что позволяет рассчитать коэффициент повышения давления в желудочке. Kirklin и соавторы полагают, что если это соотношение не превышает 0,75, вероятность существования остаточного межжелудочкового шунта мала и кольцо легочной артерии можно оставить интактным. Было показано, что в после операции кольцо легочной артерии растет. При выраженной гипоплазии легочных артерий коэффициент соотношения давления в желудочках превышает 1,0, несмотря на выполнение трансанулярной пластики легочной артерии. В этом случае отдают предпочтение паллиативной операции, которая позволяет добиться увеличения легочных артерий перед проведением радикальной коррекции порока.
Например, Z = 0 означает, что измеренный диаметр равен среднему нормальному диаметру при соответствующей площади поверхности тела; Z = +2 — полученная величина на 2 стандартных отклонения больше, чем в среднем в норме; Z = -2 — измеренная величина на 2 стандартных отклонения меньше, чем в среднем в норме. В строгом математическом понимании iZ = +2, iZ = -2 лежат в пределах нормальных значений. Kirklin показал, что при Z = -4 и меньше выживаемость после радикальной коррекции резко падает и таким пациентам показан системно-легочный анастомоз как первый этап лечения. Таким образом, Z-фактор отражает степень отклонения от нормы той или иной анатомической структуры в морфологическом смысле и позволяет оценить изменение этих параметров со временем, независимо от роста организма.
У детей старшего возраста обязательно выполняют резекцию инфундибулярной мышцы как со стороны инфундибулярной перегородки, так и со стороны париетальной стенки. При выполнении операции детям младшего возраста инфундибулярную резекцию не проводят вообще или удаляют меньший объем мышечной ткани. При достаточно коротком и гипоплазированном инфундибулуме или при значительном сужении в месте его перехода в легочную артерию может потребоваться наложение трансанулярной заплаты. При наличии проксимального стеноза ветвей легочной артерии заплата может быть продлена на соответствующую правую или левую ветви легочной артерии. Если в области выходного тракта правого желудочка расположена широкая ветвь коронарной артерии, это усложняет устранение подклапанного стеноза легочной артерии за счет вероятного развития инфаркта миокарда, особенно в том случае, когда необходимо выполнение трансанулярной пластики легочной артерии. В такой ситуации операцию безопаснее выполнять в старшем возрасте, поэтому ее обычно откладывают до достижения ребенком определенного возраста. При наличии субартериального дефекта непременно показано выполнение трансанулярной пластики выходного тракта правого желудочка.
Анестезиологическое обеспечение катетеризации сердца, периоперационного и послеоперационного периодов
При рентгеноконтрастных исследованиях премедикацию осуществляют пентобарбиталом, морфином и скополамином. В лаборатории катетеризации больным вводят кетамин внутримышечно в дозе 4 мг/кг или внутривенно — 1-2 мг/кг. У некоторых больных полезно сочетать кетамин с фентанилом. Детям младше 1 мес или массой менее 4 кг, или при тяжелой форме порока катетеризацию целесообразно проводить в условиях эндотрахеальной интубации с применением миорелаксантов. Больных вентилируют воздухом до тех пор, пока у них не исчезнет цианоз. У больных при зондировании полостей сердца оценивают сатурацию в различных отделах сердца и на периферии.
Паллиативные операции
Анестезиологическое пособие при закрытых операциях при тетраде Фалло во многом сходно с таковым при корригирующих операциях. Больным с выраженным цианозом вводный наркоз можно проводить при помощи кетамина, фентанила, суфентанила. При менее выраженном цианозе с этой целью возможно применение ингаляционных анестетиков. Когда налажено внутривенное введение лекарств, можно использовать небольшие дозы фентанила или суфентанила. Прямое измерение АД при этих операциях не всегда применяется. Катетеризацию артерии производят при выраженном ацидозе, нестабильном периоперационном состоянии или если предвидится длительная ИВЛ после операции.
Анестезиологическое обеспечение направлено на раннюю экстубацию больного, раннюю двигательную активность после операции и раннее питание больного. Проводится мониторинг периферической сатурации кислородом. При отсутствии артериального катетера АД необходимо измерять непрямым способом через 3-5 мин. Если эффективность наложенного анастомоза вызывает сомнения, необходимо после операции установить внутриартериальный катетер для мониторинга оксигенации. У некоторых больных может развиться не купируемый отек легких из-за избыточного шунтирования. Это осложнение в основном возникает в конце операции после окончания действия анестетиков или в первые часы послеоперационного периода. В такой ситуации необходимо повторное хирургическое вмешательство и суживание анастомоза. Указанное осложнение наблюдается очень редко при анастомозе Blalock-Taussig, чаще при анастомозах Waterstone или Potts. После паллиативных операций насыщение крови кислородом увеличивается недостаточно. Вследствие сохранения право-левого сброса остается возможность возникновения воздушной эмболии в периоперационный период. Эти больные часто остаются очень сложными в раннем послеоперационном периоде.
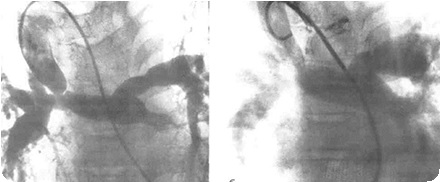
Радикальные операции
Так же, как и при выполнении паллиативных операций, вводный наркоз осуществляют введением кетамина внутримышечно, а после интубации — снотворных средств, миорелаксантов, фентанила. Общую анестезию поддерживают введением фентанила. Уделяют внимание профилактике транскатетерной воздушной эмболии. У больных с выраженным цианозом после вводного наркоза вследствие снижения периферического сосудистого сопротивления увеличивается шунт крови справа налево. В этих случаях необходима интенсивная инфузионная терапия кристаллоидными растворами. При неэффективности водной нагрузки применяют сосудосуживающие средства. В постперфузионном периоде используют допамин, добутамин. В последнее время вместо указанных симпатомиметиков применяют более эффективное сочетание малых доз адреналина с периферическими вазодилататорами.
В возрасте 1-3 мес масса ребенка составляет 4-6 кг. При такой массе удобно использовать постоянное искусственное кровообращение с бикавальной канюляцией. Восходящую аорту канюлируют обычным способом. Венозные канюли, по выбору хирурга, могут быть прямыми или изогнутыми. Обычно применяют глубокую гипотермию для лучшей защиты миокарда и уменьшения необходимости многократных доз кардиоплегии.
У детей массой 5-6 кг и старше 3 мес применяют умеренную гипотермию и многократные дозы кардиоплегии.
У детей массой менее 3,5-4 кг используют одну венозную канюлю в правом предсердии, полагаясь на компетентность трехстворчатого клапана, для предотвращения заполнения венозной магистрали воздухом. В зависимости от места прикрепления хорд трехстворчатого клапана и близости края ДМЖП к трехстворчатому клапану может возникнуть необходимость остановить перфузию приблизительно на 10 мин во время проведения швов вокруг заднего и нижнего краев дефекта. Глубокую гипотермию применяют, когда используется единственная канюля, так что кровообращение при необходимости в любой момент может быть остановлено.
У детей массой менее 2-2,5 кг стандартно применяют гипотермическую остановку кровообращения. Начальную фазу операции целесообразно выполнять в условиях постоянной перфузии с одной венозной канюлей. На этом этапе можно произвести вентрикулотомию, разделение мышечного сужения и наложение нескольких швов на дефект. Желательно завершить закрытие дефекта и начать фиксацию заплаты на выводном тракте в период остановки кровообращения. Для этого обычно требуется не более 30-40 мин.
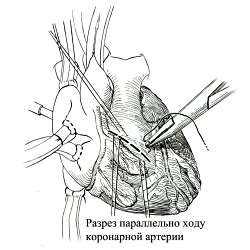
Техника коррекции тетрады Фалло
У детей раннего младенческого возраста предпочтителен доступ к внутрисердечным структурам через правую вентрикулотомию. Он имеет ряд преимуществ перед чреспредсердным доступом, так как позволяет расширить инфундибулум без агрессивной резекции мышц, которая может привести к выраженному рубцеванию эндокарда. Этот доступ обеспечивает хорошую экспозицию без угрозы травмирования трехстворчатого клапана и проводящей системы. При выборе вентрикулотомии необходимо исследовать анатомические предпосылки для её выполнения. У детей старше 6 мес мы чаще всего применяем комбинированный доступ — чреспредсердный для пластики дефекта и чрезжелудочковый для устранения обструкции выводного тракта.
Во время фазы охлаждения выделяют легочный ствол, бифуркацию и устье левой ветви. Артериальный проток, если он персистирует, перевязывают сразу после начала перфузии. Оценивают диаметры легочного ствола и клапанного кольца, и если они существенно меньше нормы, полученной по номограмме, принимают решение осуществить анулопластику.
В этот период изучают характер ветвления коронарных артерий по передней стенке правого желудочка. Разрез выполняют таким образом, чтобы избежать пересечения крупной артерии правого желудочка, которая направляется к верхушке сердца. Обычно это сделать не удается, так как артерия проходит через самое узкое место мышечного сужения инфундибулума. В этом месте часто можно видеть углубление в выводном тракте. Эта коронарная артерия кровоснабжает главным образом гипертрофированные мышцы, создающие сужение, поэтому её пересечение не имеет отрицательных последствий. Однако крайне важно сохранить крупную ветвь правой коронарной артерии, идущую к верхушке. Для этого может потребоваться выполнение косого разреза инфундибулума. При необходимости производят трансанулярный разрез, продлевая его на устье левой ветви.
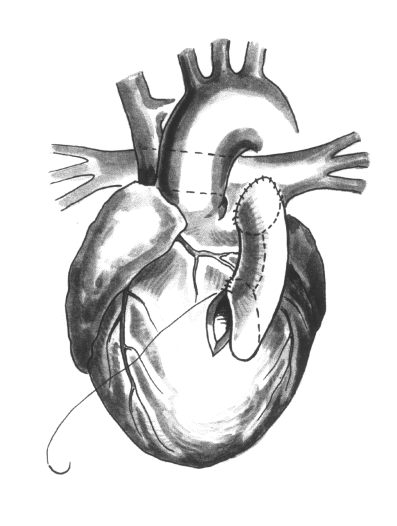
Длина разреза должна быть ограничена пределами инфундибулума. На приводимых иллюстрациях размер вентрикулярного отверстия увеличен для демонстрации внутрисердечных структур. Длина разреза зависит от длины конусной перегородки, которая может быть различной при тетраде Фалло. Если конусная перегородка гипоплазирована или отсутствует, у младенцев разрез может быть не более 5-6 мм. Во всех случаях разрез должен заканчиваться на несколько миллиметров выше места соединения модераторного пучка со свободной стенкой правого желудочка, где прикрепляется папиллярная мышца трехстворчатого клапана.
Дефект межжелудочковой перегородки расположен между париетальной и септальной ножками перегородочно-краевой трабекулы. Эти мышечные пучки обычно сливаются с конусной перегородкой и фиксируют ее в переднем положении. После пересечения места слияния париетальной и септальной ножек конусной перегородки, последняя смещается кзади заплатой на ДМЖП. Фактически хирург просто пересекает левый и правый концы конусной перегородки. Разрезы следует произвести на некотором расстоянии от места наложения швов, так как непокрытый эндотелием миокард легко прорезается.
Очень важно идентифицировать и сохранить модераторный пучок. Он функционирует как центральная опора правого желудочка, вокруг которой в систолу происходит сближение передней свободной стенки и задней перегородочной стенки. У старших детей модераторный пучок сильно гипертрофирован и создает дополнительную обструкцию выводного тракта правого желудочка. В этих случаях его следует частично, но не полностью, рассечь. На поверхности перегородки имеются дополнительные мышечные пучки, связанные с септальной ножкой, которые у старших детей также следует пересечь. У новорожденных и младенцев редко возникает необходимость иссечения мышц. Простого пересечения мышечных пучков достаточно для устранения обструкции.
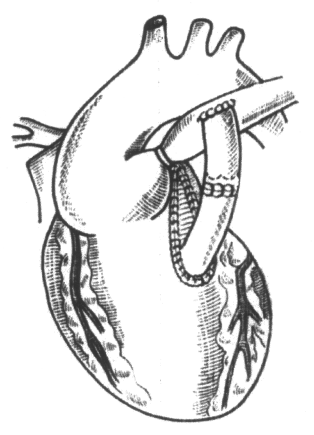
Закрытие ДМЖП
В качестве материала для заплаты используют, обработанный глютаровым альдегидом, аутоперикард. Некоторые хирурги считают, что вязаный велюр из дакрона имеет преимущество перед перикардом, так как точечные остаточные дефекты при применении перикарда встречаются чаще, чем при использовании дакрона.
Некоторые хирурги закрывают ДМЖП, фиксируя заплату отдельными П-образными швами с короткой иглой и маленькими тефлоновыми прокладками. При наложении каждого шва его полезно подтягивать, чтобы экспонировать место следующего стежка. Для удобства описания линии шва дефект можно рассматривать как циферблат: 12 ч — в месте конусной перегородки, передний край дефекта — 3 ч, нижний — 6 ч, и задний — 9 ч. Первый шов накладывают в точке 3 ч и движутся против часовой стрелки. Первые швы проводят достаточно глубоко, подтягивая их для улучшения экспозиции менее доступного верхнего края ДМЖП. На участке 2-1 ч при движении к аортальному клапану имеются гребни мышечной ткани и углубления между ними. Шов должен пройти по дну этих углублений, чтобы не образовались остаточные дефекты перегородки. По достижении спереди конусной перегородки неровности перегородки остаются позади. В этом месте поверхность перегородки гладкая. Швы можно проводить на всю толщину конусной перегородки. У наиболее маленьких детей важно учесть последующий рост этой области. Размеры тефлоновых прокладок значительно больше размеров выводного тракта, поэтому лучше использовать маленькие прокладки из перикарда для снижения вероятности обструкции выхода из желудочка. Вокруг аортального клапана входные отверстия шва делают на некотором расстоянии от кольца и необязательно в радиальной ориентации, а выходные отверстия — по его краю, так что заплата фиксируется непосредственно к фиброзной ткани кольца. Это позволяет плотно завязать шов, не прорезывая нежную мышечную ткань у маленьких детей. Линию шва проводят до точки 9 ч, стараясь не захватить основание аортальных створок. Затем продолжают линию шва по часовой стрелке. После прохождения папиллярной мышцы конуса отступают от нижнего края дефекта приблизительно на 2 мм. Пучок проводящей системы проходит вблизи нижнего и заднего края дефекта, хотя при мембранозном или приточном дефекте угроза его повреждения меньше. Тем не менее, следует соблюдать осторожность при проведении швов по нижнему и заднему краям дефекта. При наличии остатков мембранозной перегородки их полезно использовать.
При наличии фиброзной связи трехстворчатого и аортального клапанов целесообразно проводить П-образные швы с прокладками через основание септальной створки трехстворчатого клапана со стороны правого предсердия. Чрезвычайно важно избегать даже малейшего переплетения хорд трехстворчатого клапана, которые крайне тонки и нежны. Также важно не делать широкие стежки, так как складки створки трехстворчатого клапана могут нарушить его функцию.
Отдельные швы на дефекте осторожно завязывают, начиная с сегмента 4 ч-5 ч. В этом месте швы проведены достаточно глубоко и поэтому заплата плотно фиксируется к перегородке. В области проводящих путей швы завязывают с особенной осторожностью. Необходимо убедиться, что прокладки ложатся правильно и не цепляются за хорды трехстворчатого клапана.
Многие хирурги, используют непрерывный шов 5/0-6/0 проленом с иглой 8-10 мм. Преимущество непрерывного шва, на наш взгляд, состоит в более герметичной фиксации заплаты и ее точной адаптации к дефекту. При чрезжелудочковом доступе вначале накладывают матрацный шов с тефлоновой прокладкой со стороны правого предсердия через основание септальной створки трехстворчатого клапана и через заплату. Далее проводят несколько матрацных стежков на основание створки и затем непрерывный шов ведут по вентрикулоинфундибулярной складке, двигаясь в непосредственной близости от аортального клапана, чтобы избежать неровностей рельефа и остаточных отверстий между мышечными валиками. Вслед за этим линию шва прерывают и продолжают выполнять стежки другим концом нити кпереди, фиксируя заплату к септальной створке. Аккуратно проходят под хордами, пересекающими ДМЖП. Далее стежки проводят поверхностно, несколько отступая от края дефекта. При движении кпереди в шов попадает правая ножка пучка Гиса. Пластика ДМЖП завершается связыванием обоих концов нити. Заплата оттягивает наджелудочковый гребень вниз, что увеличивает размер выводного тракта.
Анатомия тетрады Фалло со стороны правого предсердия, значительно отличается от того, как она выглядит со стороны правого желудочка. Через трехстворчатый клапан хирургу открывается вид правого желудочка ниже париетального продолжения инфундибулярной перегородки. Зато вентрикулоинфундибулярная складка лучше открывается из предсердного доступа.
Для улучшения экспозиции косой разрез правого предсердия направляют сверху вниз в сторону AV-борозды. Дефект межжелудочковой перегородки расположен ниже переднесептальной комиссуры. Дефект закрывают до ампутации париетального продолжения.
Первый П-образный шов с прокладкой обычно начинают с точки 3 ч, отступя несколько миллиметров от края дефекта и продолжаем его против часовой стрелки. Шов ведут в непосредственной близости от аорты. В точке 9 ч край дефекта часто образован основанием септальной створки. В этой области шов выполняют по типу матрацного с выводными отверстиями в предсердие и затем через основание створки и край заплаты в желудочке. Вторым концом нити шов продолжают по часовой стрелке, отступая от края дефекта и не внедряясь глубоко в толщу перегородки. Когда обе линии шва сблизятся, концы нити связывают со стороны предсердия. Для улучшения экспозиции верхнего края дефекта заплату подтягивают книзу при наложении каждого следующего стежка.
Непрерывный шов технически особенно удобен доступом через предсердие, хотя мы применяем его в редких случаях чрезжелудочкового доступа к дефекту.
Реконструкция выводного тракта правого желудочка
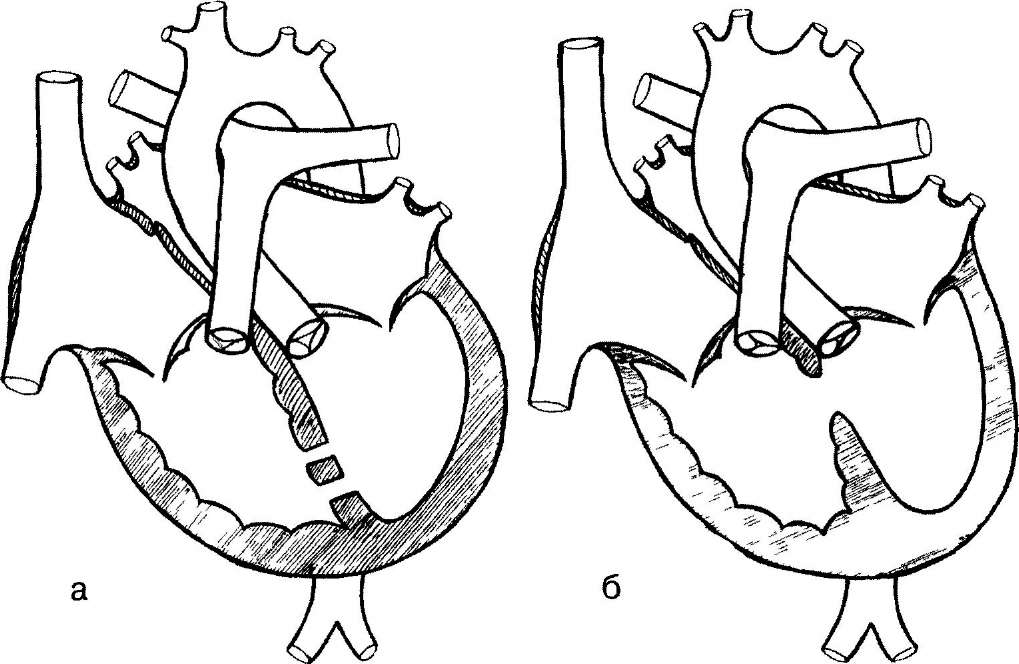
Для реконструкции выводного тракта правого желудочка лоскут перикарда замачивают в растворе глютарового альдегида. Экспозиция зависит от концентрации. При концентрации 0,9% лоскут перикарда замачивают на 20-30 мин. При более высокой концентрации раствора время экспозиции сокращают. Для пластики выводного тракта экспозиция должна быть короче, чем для ДМЖП, и достаточной, чтобы придать лоскуту минимальную жесткость. Жесткая заплата хуже адаптируется к краям дефекта, может образовывать нежелательные складки. Мы часто используем необработанный перикард. Выкраивают лоскут перикарда с округлыми, но не острыми концами. Ширина заплаты должна несколько превышать недостающую часть должного размера легочного ствола, определенного по номограмме.
Клапанное кольцо легчной артерии чаще всего сужено, однако, как правило, при наличии инфундибулярной камеры оно может иметь нормальный диаметр. Стараясь сохранить целостность клапанного кольца, производят два коротких вертикальных разреза — легочного ствола для вальвулотомии и правого желудочка для резекции элементов мышечного стеноза. Клапан при тетраде Фалло чаще всего двустворчатый. Сросшиеся комиссуры рассекают скальпелем до стенок легочной артерии. Оба разреза закрывают лоскутами перикарда.
При изолированном сужении кольца клапана производят короткий разрез легочного ствола с переходом на стенку правого желудочка. При трехстворчатой структуре клапана мы предпочитаем сохранить собственные створки, хотя они обычно утолщены и создают некоторое препятствие антеградному току крови. При резкой гипоплазии кольца рудиментарный клапан лучше полностью иссечь.
Гипоплазия легочного ствола всегда сопровождается сужением начального отдела левой ветви легочной артерии. В этих случаях трансанулярный разрез продлевают на левую ветвь с переходом на широкий дистальный участок.
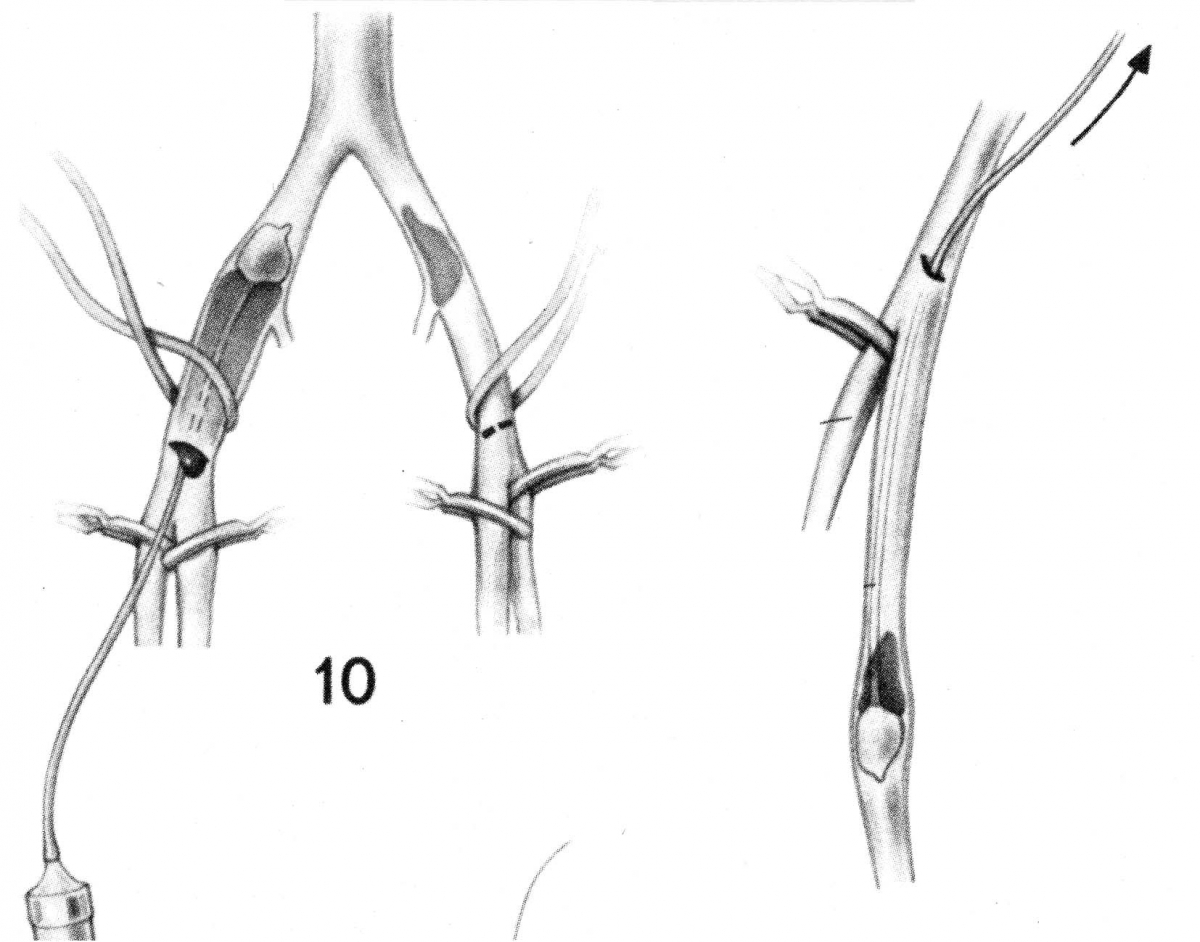
Сужение правой ветви легочной артерии можно корригировать, продлевая разрез легочного ствола далеко на правую ветвь. Учитывая особенность отхождения правой легочной артерии, заплата должна повторять Г-образную форму разреза. Мы чаще всего пользовались именно этой относительно простой техникой. Изящную технику описали Kirklin и Barratt-Boyes в своем капитальном руководстве, ставшем настольной книгой нескольких поколений кардиохирургов мира и в третий раз переизданной после его смерти.
После мобилизации восходящей аорты и отведения ее тесьмой вправо и кпереди правую ветвь отсекают от легочного ствола. Отсеченную легочную артерию рассекают вдоль по передней поверхности и расширяют перикардиальной заплатой. Реконструированную правую легочную артерию реанастомозируют в расширенное отверстие легочного ствола. Технически проще пришить заднюю стенку легочной артерии к задней полуокружности отверстия в стволе перед расширением легочной артерии перикардом.
Хирургическая техника при аномальном ветвлении коронарных артерий. В такой ситуации выполнение трансанулярной пластики невозможно. Используя два вертикальных разреза выше и ниже аномальной коронарной артерии, стараются максимально удалить ткани, создающие препятствие выходу в легочную артерию. Оба разреза закрывают заплатами из перикарда. Если это оказывается неэффективным, иногда вшивают трансанулярную заплату под мобилизованной аномальной коронарной артерией. К сожалению, этот метод ненадежен, так как натяжение артерии может существенно сузить ее просвет и привести к фатальной ишемии миокарда.
В случае неэффективности приведенных выше методов формируют наружный обходной путь, оставляя суженное клапанное кольцо интактным. Имплантируют кондуит в качестве обходного канала, параллельного естественному. При диагностированном до операции аномальном прохождении крупной коронарной артерии может быть использован заранее подготовленный легочный гомотрансплантат. Чаще всего аномальная артерия обнаруживается в ходе операции, поэтому разрез легочной артерии и вентрикулярное отверстие можно соединить трубкой, свернутой из аутоперикарда.
В тех случаях, когда перикарда для изготовления трубки было недостаточно, формируется мостик из двух пластин — синтетической и перикардиальной или двух перикардиальных.
В одной из них делается два надреза, расстояние между которыми равно расстоянию между верхним краем вентрикулярного отверстия и нижним концом разреза легочного ствола. Эту пластину пришивают вокруг отверстий в качестве задней стенки мостика. Переднюю стенку пришивают на то же место, что и при обычной пластике выводного тракта.
Остроумный прием был предложен группой авторов из Филадельфии с использованием передней стенки собственной легочной артерии. Лоскут легочной артерии изгибают книзу и пришивают к верхнему краю вентрикулярного разреза. Затем поверх этого лоскута и обоих отверстий пришивают заплату из аутоперикарда.
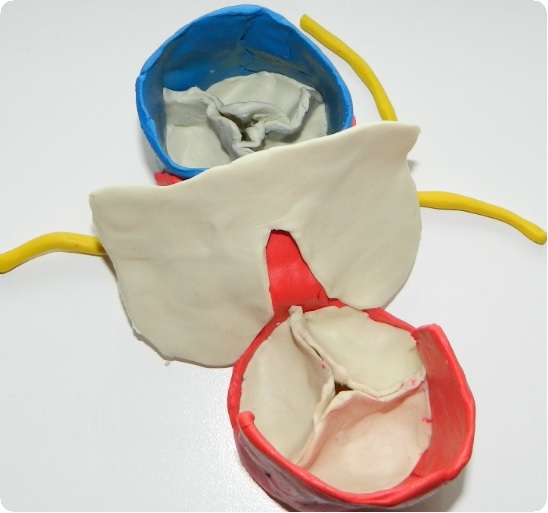
Полученный кондуит обладает потенциалом роста, что выгодно отличает его от методик, ранее применявшихся нами и другими хирургами. Следует заметить, что дооперационная диагностика аномалий коронарных артерий принципиально важна у больных, ранее перенесших вмешательства, сопровождавшиеся вскрытием полости перикарда. Во время кардиолиза они могут быть пересечены.
Отключение аппарата искусственного кровообращения
Отлучение от искусственного кровообращения не должно сопровождаться осложнениями. Обычно применяют малые дозы допамина — 5 мкг/кг/мин. Опыт, свидетельствует, что адреналин в минимальных дозах гораздо эффективнее допамина и добутамина. Если при отключении АИК возникают осложнения, это определенно указывает на наличие остаточных анатомических причин.
В первую очередь следует заподозрить обструкцию выводного тракта правого желудочка, наличие и степень которой определяют пункционным измерением давления в правом желудочке и сравнивают его с системным. Супрасистемное давление в правом желудочке — достаточная причина невозможности перевода на самостоятельное кровообращение. Давление в правом желудочке, составляющее 80-90% системного, редко бывает единственной причиной неудачи при попытке отключения аппарата. Сразу после периода искусственного кровообращения часто регистрируется динамическая обструкция выводного тракта, особенно в условиях относительной гиповолемии и вызванной катехоламинами гиперсократимости.
Интраоперационная чреспищеводная ЭхоКГ дает информацию о протяженности и выраженности обструкции, а спектральная допплерография — о градиенте давления. Однако при этом можно переоценить тяжесть обструкции, если плоскость среза приходится на самый узкий участок, в то время как остальная часть тракта оттока достаточно широка. Наличие существенного сужения является показанием для возобновления искусственного кровообращения и увеличения размера заплаты по длине и ширине, включая трансанулярную область.
Несмотря на старательное закрытие дефекта, могут остаться небольшие отверстия. Остаточные шунты проявляются повышением давления в левом предсердии и системной гипотензией. После коррекции тетрады Фалло непосредственно в послеоперационный период давление в правом предсердии обычно выше, чем в левом. Подозрение на остаточный шунт подтверждается скачком повышения насыщения крови, взятой из правого предсердия и из легочной артерии. Транспищеводная ЭхоКГ может не только подтвердить факт остаточного шунта, но и его локализацию, и размер сообщения. Она позволяет отличить просачивание крови по краю заплаты от мышечного ДМЖП. Не обнаруженные до операции дополнительные дефекты выявляются после коррекции, когда давление в желудочке становится ниже системного.
Больные с тетрадой Фалло плохо переносят остаточные дефекты по нескольким причинам. Периферические легочные артерии тонкостенны, легко растяжимы, и сосудистое сопротивление обычно не повышено. Вследствие этого возникает большой шунт слева направо с объемной перегрузкой и дилатацией левого и правого желудочков. Недостаточность клапана легочной артерии, возникшая после трансанулярной пластики, и регургитация на трехстворчатом клапане вследствие дилатации желудочка увеличивают объемную перегрузку правого желудочка. Острая объемная перегрузка особенно плохо переносится в условиях диастолической дисфункции. Последняя является следствием концентрической гипертрофии, а также отека миокарда, искусственного кровообращения и вентрикулотомии. Наконец, до операции желудочки адаптированы к перегрузке давлением, а не объемом, поэтому у ребенка с ДМЖП после эффективного устранения обструкции выводного тракта правого желудочка может быстро развиться синдром низкого сердечного выброса.
Если линия шва на выводном тракте проходит слишком близко к коронарной артерии, особенно левой передней нисходящей артерии, натяжение эпикарда может вызвать сужение ее просвета. Это проявляется изменением сегмента ST на ЭКГ и обесцвечиванием соответствующего участка миокарда. Эхокардиографические признаки гипо- и акинезии подтверждают такое подозрение. Лучшим решением в данной ситуации является возобновление искусственного кровообращения. Необходимо распустить шов, прилегающий к коронарной артерии, и заново наложить его изнутри желудочка. Полезно использовать прокладки на эндокардиальной поверхности свободной стенки желудочка, чтобы уменьшить натяжение в области коронарной артерии.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии