Лечение аномалии Эбштейна. Причины заболевания. Последствия.
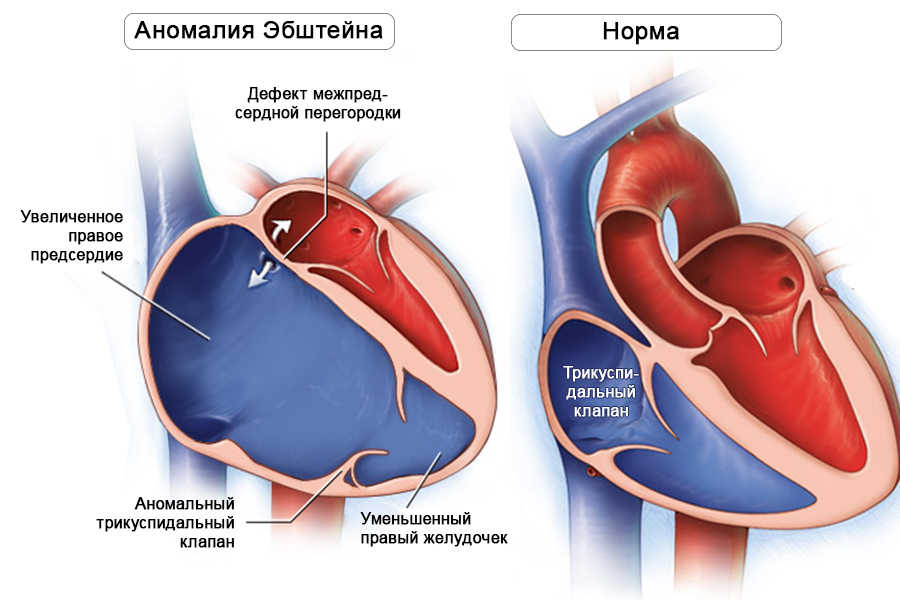
Во внутриутробном периоде чаще диагностируются тяжелые формы аномалии Эбштейна с выраженной кардиомегалией и тяжелой трикуспидальной недостаточностью. Согласно многоцентровым исследованиям, большинство детей умирают вследствие прерывания беременности или спонтанно в фетальном и неонатальном периоде. Факторы риска смерти в неонатальном и послеродовом периодах различны. У плода критическим фактором является недостаточная объёмная нагрузка левого желудочка при рестриктивном овальном окне.
При ЭхоКГ-исследовании обнаруживают водянку плода или тахикардию. Sharland представил описание 54 случаев аномалии Эбштейна, диагностированной пренатально. В 23 случаях была идентифицирована обструкция выводного тракта правого желудочка, в 1 – атрезия аорты и в 4 – корригированная транспозиция с ДМЖП. Двадцать четыре семьи приняли решение о прерывании беременности, в 6 случаях произошла спонтанная дородовая смерть, 8 детей умерли в неонатальном периоде и 2 – в младенческом возрасте. Таким образом, из этого количества выжили только 14 детей.
Russo и соавторы проследили судьбу 42 младенцев, у которых диагноз был поставлен в течение первых 6 дней жизни. К 14-му дню остались живыми 69%, к 1 году – 52% и к 5 годам – только 37% детей. На раннюю смертность влияли отсутствие или гипоплазия трабекулярной части правого желудочка, маленькая и приросшая передняя створка трехстворчатого клапана и сопутствующие пороки.
Yetman и соавторы представили исходы естественного течения 46 цианотичных новорожденных. Функциональная атрезия легочной артерии была обнаружена у 54% и анатомическая атрезия – у 24% больных. Общая смертность в этой группе составила 70%, а среди 50 ацианотичных детей – 14%. Выживаемость по Kaplan-Meier составила 61% к 1 нед. жизни, 48% – к 1 мес., 36% – к 1 и 5 годам и 30% – к 20 годам. Существенными предвестниками неизбежной смерти были снижение функции левого желудочка и функциональная или анатомическая атрезия легочной артерии. Таким же грозным признаком является измеренное на ЭхоКГ отношение суммарной площади правого предсердия и площади атриализованной части правого желудочка к площади функционирующего правого и левого желудочков, составившее более 1,0.
У новорожденных и младенцев с невыраженной формой аномалии Эбштейна естественное течение относительно благоприятное. Watson одним из первых провел обзор естественного течения аномалии Эбштейна. В этом международном совместном исследовании описана судьба 505 пациентов из 61 центра и 28 стран, из них:
-
35 были в возрасте до 1 года;
-
403 – в возрасте между 1 и 25 годами;
-
67 – старше 25 лет.
У 72% младенцев была сердечная недостаточность. В возрастной группе 1 год-25 лет 71% пациентов и в группе старше 25 лет 60% пациентов принадлежали к I-II классу NYHA. Высокая начальная смертность наблюдалась в течение первых нескольких месяцев жизни; в более старшем возрасте она стабилизировалась на уровне 13%. Половина больных умерли от сердечной недостаточности и 20% – внезапно, по-видимому, от аритмии.
Многоцентровый обзор опубликовали Celermajer и соавторы. Естественное течение аномалии Эбштейна было прослежено в сроки от 1 года до 34 лет у 220 пациентов. Из них хирургическое лечение потребовалось 39% больным. Актуарная выживаемость среди всех родившихся живыми составила 67% к 1 году и 59% к 10 годам. Умерли 58 больных, в 7 случаях беременность прервана и 155 больных были живы при последнем осмотре. На первом году жизни умерло 36% больных, в течение второго года – 4%, между 2 и 10 годами – 1% и между 10 и 40 годами – 1,4%. Беременность была прервана в 7 случаях из 21, в 5 случаях наступила внутриутробная и в 6 – постнатальная смерть. Только 3 детей выжили. Повышенную угрозу для жизни представляли более тяжелая форма порока по данным ЭхоКГ, кардиоторакальный индекс более 60%, выраженная обструкция выводного тракта и порок, обнаруженный до родов. У новорожденных синюшность исчезала по мере снижения ЛСС, однако в последующем цианоз рецидивировал и через 2-18 лет после рождения развивалась сердечная недостаточность. Почти у половины больных были признаки дисфункции левого желудочка. Недостаточность кровообращения и недостаточность левого желудочка имеют крайне неблагоприятный прогноз.
У 34% пациентов имели место нарушения ритма и у 5,9% – синдром предвозбуждения без симптоматики.
По данным Gentles и соавторов, у детей, переживших первое полугодие, такой же прогноз, как и у взрослых. У многих пациентов заболевание протекает благоприятно на протяжении всей жизни. Май наблюдал больного, у которого симптомы появились только в возрасте 77 лет и он умер в 85-летнем возрасте. Еще об одном 85-летнем пациенте, у которого отсутствовали какие бы то ни было симптомы, сообщили Seward и соавторы. Аномалия у него была обнаружена случайно при ЭхоКГ-обследовании.
В литературе есть сообщения о нормальных родах у неоперированных больных. Так, Китаг и соавторы наблюдали 3 нецианотичных женщин, у которых было 6 неосложненных беременностей и успешные роды. Radford и соавторы сообщили о 6 женщинах с нормальной беременностью, родивших 12 детей. Никаких осложнений со стороны сердца во время беременности они не наблюдали. Интересно, что 8 беременностей эти женщины перенесли, не зная о своем заболевании.
Даже в случаях бессимптомного течения заболевания нередки внезапные смерти. При появлении симптомов у благополучных пациентов выраженность и тяжесть клинических проявлений могут быстро прогрессировать.
Для аномалии Эбштейна характерен широкий спектр гемодинамических нарушений и аритмий в различных возрастных группах, поэтому не существует догматических алгоритмов лечения и принимаются индивидуальные решения.
Хирургическое лечение аномалии: историческая справка
Хирургические методы лечения применяются в последние 40 лет. В 1950-х годах практиковали создание межсистемных анастомозов для увеличения легочного кровотока. Они не были достаточно эффективными. Лучшие результаты были получены при наложении кавопульмонального анастомоза по Glenn. В 1958 г. Hunter и Lillehei попытались перемещать септальную и заднюю створки трехстворчатого клапана, однако без очевидного успеха. В 1962 г. Barnard и Schrire успешно протезировали трехстворчатый клапан. Этот пациент был жив и находился в хорошем состоянии при плановом обследовании через 19 лет после операции. В 1969 г. Hardy и Roe сообщили об успешной реконструкции трехстворчатого клапана.
В зависимости от анатомии в настоящее время применяется протезирование клапана механическим или биологическим протезом или пластическая реконструкция.
Усовершенствуя пионерские разработки своих предшественников, Danielson и соавторы в клинике Mayo разработали пластическую реконструкцию, основанную на создании моностворчатого клапана из передней расширенной створки трехстворчатого клапана. Если задняя и перегородочная створки имеют адекватные размеры, иногда удается сохранить трехстворчатую или двустворчатую структуру.
С 1972 по 1991 гг. авторы выполнили 189 операций, 60 % из которых составляла пластическая реконструкция и 40% – протезирование клапана с госпитальной летальностью 6% и отдаленной летальностью 5,6%. Выжившие пациенты принадлежали к I-II классу NYHA.
Крупной вехой в истории пластических вмешательств при аномалии Эбштейна стал опубликованный в 1988 г. Carpentier универсальный метод, лишенный недостатков ранее предложенных операций.
Специалисты из клиники Mayo разработали критерии отбора пациентов для хирургического лечения:
-
I-II функциональный класс NYHA;
-
I-II функциональный класс при кардиоторакальном индексе, превышающем 0,65;
-
выраженный цианоз и полицитемия;
-
парадоксальные эмболии даже при I-II классе NYHA;
-
наличие дополнительных проводящих AV-путей с устойчивыми к лечению приступами тахикардии.
На риск естественной смерти влияют установление диагноза в детстве и сопутствующие ВПС, особенно обструкция выводного отдела правого желудочка, поэтому таким больным показано более раннее оперативное вмешательство.
Решение об операциях у младенцев с тяжелой застойной сердечной недостаточностью, малым объемом легких вследствие внутриутробной компрессии гигантским сердцем и цианозом следует принимать осмотрительно в каждом конкретном случае. Несмотря на то что описаны отдельные успешные операции у грудных детей, очень тяжелые больные первых лет жизни, как правило, не переносят реконструктивных операций по Danielson и Carpentier. Для этой категории пациентов предложена конверсия аномалии Эбштейна в атрезию правого AV-отверстия созданием аортолегочного анастомоза и последующей коррекцией гемодинамики по Fontan. В арсенале лечения больных III и IV функциональных классов зарезервирована трансплантация сердца.
Результаты хирургического лечения больных с выраженной кардиомегалией неудовлетворительные, поэтому следует предпринимать операцию даже во II функциональном классе раньше, чем кардиоторакальный индекс достигнет 0,65.
Пациенты с угрожающими для жизни аритмиями являются кандидатами на операцию вне зависимости от тяжести порока.
Хирургическая техника аномалии Эбштейна
Операции выполняют через стандартную на всю длину или частичную срединную стернотомию. Для закрытия дефекта иссекают лоскут перикарда. Лоскут по выбору хирурга может быть обработан глютаровым альдегидом. Обычно правое предсердие сильно расширено, правый желудочек дилатирован. Атриализированная камера хорошо определяется снаружи у острого края и вдоль нижней границы сердца. Левый желудочек смещен влево и изогнут вокруг правого желудочка подобно кривому огурцу.
Операцию проводят в условиях искусственного кровообращения, умеренной гипотермии и кардиоплегической релаксации сердца.
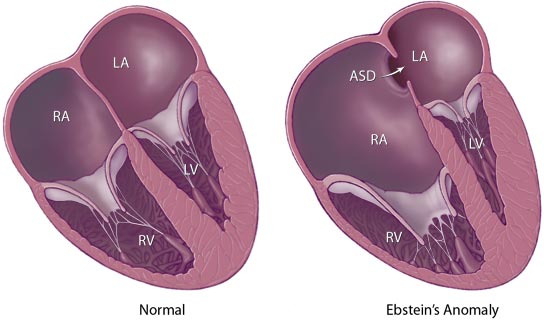
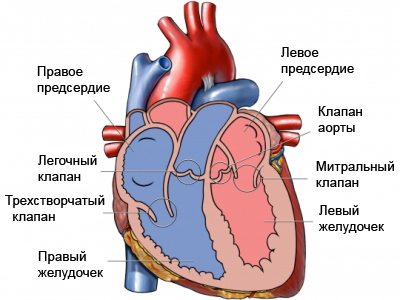
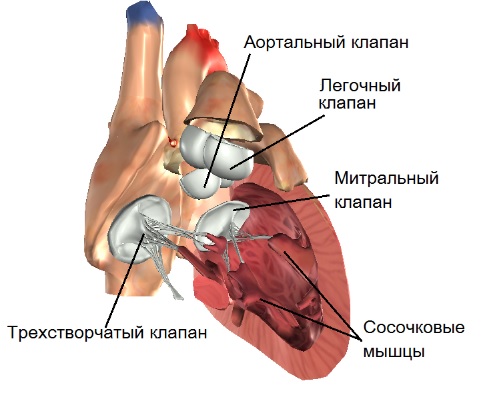
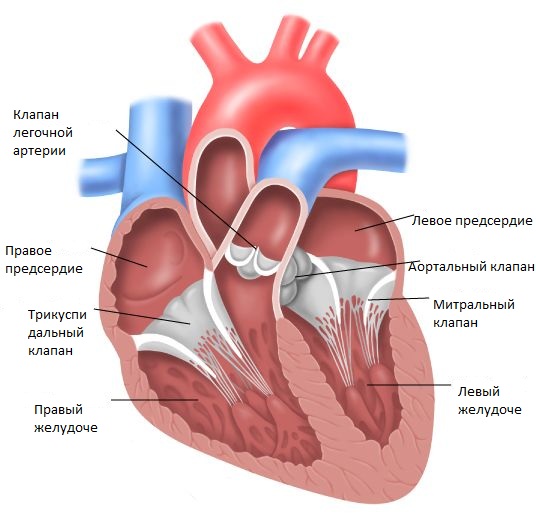
Внутрисердечная анатомия очень индивидуальна, однако характерные признаки аномалии Эбштейна легко обнаруживаются у каждого пациента. Анатомическое кольцо трехстворчатого клапана значительно расширено и основание перегородочной створки смещено в сторону полости правого желудочка. Задняя и передняя створки анатомически непостоянны. Задняя створка также смещена, в результате образуется «атриализированная камера». Передняя створка в большинстве случаев самая большая. Она может быть абсолютно или частично подвижной и полностью фиксированной к прилежащей свободной стенке правого желудочка различным количеством фиброзных пучков, которые ограничивают её мобильность.
В некоторых случаях задняя створка может быть достаточно большой и подвижной. По размерам и подвижности она сравнима с передней створкой, которая может быть расщепленной или фенестрированной. Изредка встречается четвертая небольшая дополнительная створка, крепящаяся в переднеперегородочной комиссуре.
Декомпрессию левых отделов сердца осуществляют через овальное окно или правую верхнюю полую вену с помощью отсосного наконечника или катетера.
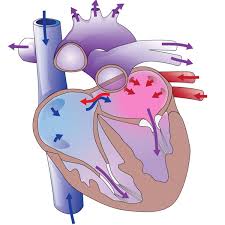
Типы хирургических вмешательств
Методы хирургического лечения аномалии Эбштейна включают протезирование трехстворчатого клапана, пластические операции и гемодинамические методы коррекции. Реконструкция трехстворчатого клапана предпочтительнее протезирования. Она позволяет избежать нарушения функции протеза, необходимости антикоагуляции и репротезирования клапана у детей по мере роста.
Хорошие функциональные результаты дают возможность расширить показания к пластической реконструкции клапана в случаях, когда предполагалось протезирование. В зависимости от предпочтений различных центров трикуспидальная вальвулопластика осуществима у 40-98% пациентов, с частотой повторных вмешательств 3-15%. Предложено множество методик и их модификаций, основными из них являются 5 методов разных авторов:
-
Hardy;
-
Danielson;
-
Carpentier;
-
Quaegebeur;
-
Hetzer.
В зависимости от способа пликации атриализированной камеры операции можно разделить на 3 типа: поперечная пликация, продольная пликация и методика без пликации.
Протезирование трехстворчатого клапана
К протезированию клапана прибегают при невозможности его реконструкции. Показаниями к протезированию являются дефицит клапанной ткани и тип D по Carpentier.
Стандартная имплантация протеза без пликации атриализированной камеры
Створки и хордальный аппарат не иссекают для сохранения функции правого желудочка. При наличии обструкции выводного тракта правого желудочка тканью створки в последней производят радиальные надрезы, чтобы открыть выход в легочную артерию. Проводят отдельные швы с тефлоновыми прокладками через истинное кольцо трехстворчатого клапана и манжету протеза. Важно избежать прошивания области прохождения пучка Гиса, для чего швы следует накладывать на перегородке ниже естественного кольца, а также не проводить швы между коронарным синусом и кольцом трехстворчатого клапана. Протез размещают по истинному кольцу клапана. После завязывания швов манжета протеза лежит на кольце трехстворчатого клапана. Атриализированную камеру не собирают в складки и оставляют ниже протеза.
Стандартная имплантация протеза с облитерацией атриализированной камеры
Если атриализированная камера значительно расширена и объём функционирующего желудочка нормальный, протезирование клапана дополняют пликацией атриализированной камеры. Отдельные матрацные швы с тефлоновыми прокладками проводят друг к другу через ложное кольцо у оснований задней и септальной створок, а затем через истинное кольцо и манжету протеза. При завязывании швов атриализованная камера облитерируется. Створки трехстворчатого клапана не иссекают.
При маленьком желудочке атриализированную часть лучше сохранить в насосной камере, увеличивая её объем.
Модифицированная техника протезирования клапана
Для предупреждения повреждения проводящей системы линию швов проводят позади АV-узла и вокруг коронарного синуса, как рекомендуют Barnard и Schrire. При этом протез клапана лежит на предсердной стороне коронарного синуса, который дренируется в правый желудочек. Атриализированную камеру оставляют интактной. Если выполняют пликацию атриализированной камеры, её собирают в складку отдельными швами, чтобы избежать ушивания коронарного синуса.
Возникновения блокады не всегда удается избежать, поэтому некоторым пациентам приходится имплантировать водитель ритма.
По вопросу выбора типа протеза не существует единого мнения. Решение согласовывают с пациентом, которого информируют о преимуществах и недостатках обоих типов протезов. В целом все протезы не являются идеальными для физиологических условий правой половины сердца. Использование механических протезов даже при хорошо контролируемой антикоагулянтной терапии сопровождается повышенным риском развития тромбоза.
Возможность тромбоза протеза определяется не только дисциплинированностью больных при приеме антикоагулянтных средств, но и конструкцией протеза, течением основной патологии. Тромбоэмболическим осложнениям способствуют нарушения ритма. В то же время, как показали наши наблюдения, ряд пациентов находятся в удовлетворительном состоянии спустя 40-45 лет после протезирования трехстворчатого клапана.
Биологические протезы обладают рядом преимуществ:
-
низким профилем;
-
центральным потоком;
-
отсутствием тромбоэмболических осложнений.
В правом желудочке они не подвержены большим гемодинамическим нагрузкам, поэтому в пределах 10-15 лет дисфункция биопротезов происходит не чаще чем в 5-20% случаев. Однако биологические протезы уступают механическим в продолжительности функционирования, особенно у детей, вследствие усиленной кальцификации. Причиной этого феномена является высокое содержание фосфатов в плазме у детей, в отличие от взрослых.
Инфекция и бактериальный эндокардит представляют угрозу для любого типа протезов.
Протезирование клапанов у детей до 5 лет в большинстве клиник сопровождается неоправданно высокой летальность: при протезировании клапанов у детей до 5 лет она составляет 57% и у детей до 2 лет – 73%. Показатель летальности при протезировании у детей старше 5 лет составляет 35% и остается высоким вплоть до 12-летнего возраста.
Согласно совокупным данным о 129 операциях протезирования трехстворчатого клапана из нескольких центров, у 61% детей операция была выполнена по поводу аномалии Эбштейна. Средняя летальность составила 24,4%.
Реконструкция трехстворчатого клапана
Реконструкция трехстворчатого клапана с поперечной пликацией
Метод Hunter, Lillehei и Hardy предусматривает использование подвижной передней створки как основного запирающего элемента клапана. Это достигается транслокацией смещенных перегородочной и задней створок до нормального уровня. Для облитерации атриализированной части проводят отдельные матрацные швы с тефлоновыми прокладками вдоль желудочкового края атриализированной камеры и через истинное кольцо трехстворчатого клапана. При завязывании швов заднюю и перегородочную створки подтягивают к истинному кольцу клапана. Атриализированная камера собирается в складку и облитерируется в поперечном направлении параллельно кольцу клапана. Этот приём перемещает свободный край передней створки к истинному кольцу трехстворчатого клапана. При этом передняя створка смыкается с атриализированной перегородкой. Danielson и Fuster дополнили эту технику задней анулопластикой для уменьшения диаметра клапанного кольца. Заднюю шовную анулопластику выполняют на уровне коронарного синуса, чтобы не повредить проводящий пучок. При использовании кольца Carpentier в анулопластике нет необходимости.
Проверяют компетентность клапана с помощью гидропробы – введения солевого раствора в правый желудочек. После коррекции правый AV-клапан функционирует как одностворчатый.
Плицирующие швы накладывают таким образом, чтобы не прошить и не деформировать заднюю межжелудочковую и значимые ветви правой коронарной артерии. После завершения пликации убеждаются, что ни одна из больших коронарных артерий не попала в шов. Облитерация атриализированной части правого желудочка является неизбежным приемом для транслокации смещенных створок. Хотя авторы оправдывают облитерацию части желудочковой стенки гемодинамической эффективностью, они не приводят каких-либо функциональных аргументов, за исключением хороших клинических результатов.
Создание одностворчатого клапана по Hardy-Danielson подразумевает наличие увеличенной цельной передней створки, не фиксированной к стенке желудочка. Отсутствие этого условия существенно ухудшает результат операции или делает невозможным ее выполнение. Дефекты, перфорации и фенестрации передней створки могут быть ушиты. Однако при фиксации свободного края створки к правому желудочку, а также при отсутствии хорд и папиллярных мышц пластичную реконструкцию трехстворчатого клапана этим методом осуществить невозможно. Недостатком операции является также деформация правого желудочка. Таким образом, возможности использования этой операции ограничены благоприятными вариантами аномалии.
Реконструкция трехстворчатого клапана с продольной пликацией
Этот метод является универсальным, он эффективен во всех случаях, когда реконструкция трехстворчатого клапана в принципе возможна. Метод Carpentier предусматривает отсечение передней и задней створок от места прикрепления к кольцу, пересечение фиброзных тяжей между створками и стенкой правого желудочка, продольную пликацию атриализированной камеры и фиксацию отсеченных створок к истинному кольцу над облитерированной камерой.
Разрез начинают от переднеперегородочной комиссуры. Участок передней створки на этом уровне оставляют нетронутым. Отделенные от основания створки мобилизуют путем пересечения дополнительных трабекул, фиброзных тяжей и сращений со стенкой желудочка. Если межхордальные пространства облитерированы, их перфорируют. Для снижения натяжения папиллярных мышц, которое может стать причиной ухудшения замыкания клапана, возникает необходимость пересечения и реимплантации папиллярных мышц передней створки на боковую стенку правого желудочка или на более высокое место на межжелудочковой перегородке.
Атриализированную камеру облитерируют, проводя швы перпендикулярно к клапанному кольцу. Пликацию выполняют отдельными матрацными швами с прокладками или обвивным швом, усиленным отдельными стежками. Следует избегать перфорации стенки миокарда и повреждения коронарных артерий.
Переднюю и заднюю створки смещают по часовой стрелке и пришивают непрерывным 5/0 проленовым швом к новому, меньшему кольцу. Стежки должны проходить вне зоны АV-узла. Опасной зоной является септальная часть кольца, следующая за отверстием коронарного синуса, поэтому линию шва следует остановить на уровне коронарного синуса. После фиксации мобилизованной передней створки к кольцу она функционирует как моностворчатый клапан и перекрывает все АV-отверстие. Кольцо трехстворчатого клапана уменьшается за счет пликации атриализированной камеры, а передняя створка занимает всю длину сегмента кольца, исходно занятого передней и задней створками.
Для стабилизации клапанного кольца его укрепляют опорным синтетическим кольцом. Это позволяет уменьшить диаметр АV-отверстия и улучшить компетентность клапана. У детей кольцо не должно быть полностью замкнутым и не является необходимым у пациентов с типом А порока.
Операция Carpentier имеет целый ряд преимуществ, в частности, она возвращает трехстворчатый клапан в нормальную позицию, тем самым увеличивая полость правого желудочка. Поскольку атриализированная часть желудочка собирается в складку продольно, она воссоздает нормальную длину правого желудочка и исключает из сокращения истонченную атриализированную часть.
Quaegebeur видоизменил метод Carpentier, дополнив его двумя приемами. Вместо синтетического кольца для сохранения формы и уменьшения размера клапанного кольца он предложил шовную анулопластику вдоль задней створки. Благодаря этому перемещенные створки не подвергаются чрезмерному натяжению и поэтому нет необходимости в пересечении и транслокации папиллярной мышцы. Шов задней анулопластики не должен следовать далее коронарного синуса.
Реконструкция трехстворчатого клапана без облитерации атриализированной камеры
Эта техника реконструирует клапанный механизм на уровне истинного клапанного кольца путём использования наиболее подвижной створки как основного запирающего компонента, но без пликации атриализированной камеры. Метод Hetzer позволяет достичь достаточной компетенции трехстворчатого клапана даже в случаях, когда были ремоделированы только задняя створка или часть передней створки.
Условием для выполнения операции является наличие хорошо развитой и подвижной передней створки. Фиброзные пучки, ограничивающие мобильность створки, пересекают. Расширенное кольцо трехстворчатого клапана уменьшают путём облитерации задней части отверстия 4-6 матрацными 3/0 полипропиленовыми швами, укрепленными прокладками из полоски аутоперикарда или тефлонного фетра. Диаметр нового АV-отверстия должен быть не менее 2,5 см. Для создания желаемого размера отверстия накладывают пробный шов. Этот шов проводят через истинное кольцо клапана в области передней створки и затем через противоположную точку на перегородке. Он разделяет исходное отверстие клапана на две части: переднюю, которая станет новым отверстием, и заднюю, которая будет облитерирована. Чтобы убедиться в хорошем закрытии нового отверстия передней створки, проводят гидропробу. Остальные швы накладывают последовательно до полной облитерации задней части клапанного отверстия. Швы проводят через истинное кольцо трехстворчатого клапана, за исключением области перегородки. В этой области для предупреждения травмы АV-узла линия шва проходит по миокарду атриализированной камеры непосредственно под истинным кольцом. Атриализованную камеру оставляют интактной.
После завязывания швов задняя часть трехстворчатого отверстия становится облитерированной. В результате передняя створка приближается к перегородке.
При контрольной гидропробе убеждаются в плотном соприкосновении края передней створки с атриализированной перегородкой. Атриализированная камера, таким образом, включается в сокращающуюся полость правого желудочка.
В редких случаях для устранения остаточной регургитации матрацным швом дополнительно суживают клапанное отверстие в области переднезадней комиссуры.
-
Расщепленная передняя створка.
Иногда целостность передней створки нарушена расщеплением или глубокими щелями. Створка может быть фиксирована хордами к стенке правого желудочка. При этом варианте анатомии передней створки формируют двойной правый АV-клапан, для чего два матрацных 3/0 пропиленовых шва, укрепленных тефлоновыми прокладками, проводят через середину передней части кольца в области расщепления и через расположенную напротив атриализированную перегородку чуть ниже истинной септальной части кольца. После завязывания швов передняя часть кольца соединяется с перегородкой, разделяя клапан на два отверстия. Две отдельные части передней створки смыкаются с противоположной перегородкой. Компетентность клапана проверяют гидропробой. Атриализированная камера входит в состав полости сокращающегося правого желудочка.
-
Значение атриализированной камеры.
Hardy, Danielson, Carpentier, Quaegebeur считают необходимым облитерировать или хотя бы уменьшить эту камеру по разным причинам. С одной стороны, под действием давления в правом желудочке она может оказывать отрицательное действие на энергетику желудочка, аналогичное эффекту аневризмы левого желудочка. Кроме того, стаз крови в несокращающемся мешке может способствовать тромбообразованию, поэтому пликация атриализированной камеры может улучшить функцию правого желудочка и устранить характерные нарушения ритма. С другой стороны, поперечная пликация при выраженных типах пороков В и С может создать большое натяжение швов и тканей с ещё не выясненным воздействием на уже измененную перегородку и левый желудочек.
В противоположность поперечной пликации, продольная пликация не вызывает деформации желудочка, не изменяет расстояния между верхушкой и основанием правого желудочка.
Большинство приверженцев протезирования трехстворчатого клапана оставляют атриализированную камеру нетронутой и не наблюдают отрицательных последствий.
Реконструкция клапана по Hetzer не предусматривает облитерации или уменьшения этой камеры и не приводит к дальнейшему расширению правого желудочка и к другим нежелательным последствиям. Наоборот, вовлечение атриализированной части в состав сокращающейся камеры правого желудочка способствует улучшению его диастолического наполнения, что может стимулировать развитие миокарда стенки атриализированной камеры и тем самым увеличивать вклад в сокращение правого желудочка. Однако эта проблема остается открытой для дальнейшего исследования.
Хирургический выбор при тяжелых формах порока
У пациентов с тяжелыми формами аномалии Эбштейна любые виды анатомической коррекции сопровождаются высоким хирургическим риском, если не признать факта наличия функционально единственного желудочка. Такие пациенты подлежат гемодинамической коррекции по Fontan. При сниженной функции правого желудочка целесообразно применить комбинацию реконструкции клапана с кавопульмональным анастомозом как вариант полуторажелудочковой коррекции.
Хирургическое лечение младенцев бросает вызов всем кардиохирургам вследствие тяжести порока, незрелости ткани клапана, функциональной легочной атрезии из-за повышенного ЛСС и тяжелой недостаточности трехстворчатого клапана. По причине отсутствия антеградного кровотока из правого желудочка в легочную артерию эти младенцы остаются зависимыми от проходимости артериального протока. Пациенты находятся в состоянии выраженной сердечно-легочной недостаточности, с цианозом и метаболическим ацидозом. Больные нуждаются в жизнеспасающем паллиативном хирургическом вмешательстве для последующей хирургической коррекции или трансплантации сердца. Опубликованы единичные успешные попытки анулопластики трехстворчатого клапана у младенцев. Результаты протезирования трехстворчатого клапана в этом возрасте пока неудовлетворительные. Отсрочить анатомическую или гемодинамическую коррекцию позволяет наложение системно-легочного анастомоза, выполняемого в течение первых недель жизни. Начиная с 3-4 мес. следует отдавать предпочтение более благоприятному с энергетической точки зрения двунаправленному кавопульмональному анастомозу. Эти вмешательства увеличивают легочный кровоток и уменьшают выраженность цианоза.
Создание одножелудочкового кровообращения у младенцев
При очевидных показаниях к гемодинамической коррекции, в качестве первого этапа у тяжелых больных в грудном возрасте выполняют процедуру исключения правого желудочка из кровообращения путем закрытия AV-отверстия заплатой с одновременным расширением межпредсердного сообщения и созданием системно-легочного шунта. Трехстворчатый клапан закрывают лоскутом из аутоперикарда непрерывным швом. Линию шва начинают на уровне переднеперегородочной комиссуры и продолжают по часовой стрелке вдоль клапанного кольца. На уровне задней створки шов покидает истинное кольцо и обходит коронарный синус, оставляя его под заплатой. Создают или расширяют межпредсердное сообщение вниз в сторону нижнего края овальной ямки и вверх в сторону верхней полой вены для свободного смешивания крови. Уменьшают объем правого предсердия путем иссечения части переднебоковой стенки. Ушивают правое предсердие. Во время фазы согревания создают центральный анастомоз между восходящей аортой и легочным стволом с помощью сосудистого протеза из Gore-Tex диаметром 4 мм. Пациента отлучают от искусственного кровообращения с необходимой поддержкой.
Сформированное таким образом одножелудочковое кровообращение подлежит в дальнейшем полной коррекции гемодинамики по Fontan.
По данным Лазоришинца, в Национальном институте сердечно-сосудистой хирургии им. Амосова АМН Украины из 210 операций реконструкция клапана составила 68,9%, протезирование – 22,8%, гемодинамические паллиативные операции – 8,7%.

Дополнительные процедуры после протезирования или реконструкции клапана
Овальное окно закрывают непрерывным швом, большой ДМПП – заплатой из аутоперикарда.
Коррекция сопутствующих врожденных пороков
Коррекция сопутствующих аномалий корригируют обычным образом перед реконструкцией трехстворчатого клапана или после неё.
Лечение предсердных аритмий
Если разрушение аномальных проводящих путей или дополнительных проводящих путей при синдроме Wolff-Parkinson-White) не произведено до операции при электрофизиологическом исследовании, эту процедуру выполняют во время хирургического вмешательства. Одновременно с коррекцией порока может быть выполнена процедура Cox-Maze для устранения хронической или пароксизмальной мерцательной аритмии и фибрилляции предсердий. Процедуру Maze выполняют или хирургически или с использованием радиочастотной катетерной абляции.
Закрытие правого предсердия
Перед ушиванием разреза гигантского правого предсердия резецируют существенную часть его стенки. Её можно также свернуть в валик непрерывным швом 4/0 проленом.
Контрольное интраоперационное эхокардиографическое исследование
После отлучения от искусственного кровообращения проводят чреспищеводное ЭхоКГ-исследование для оценки компетентности клапана, наличия остаточного шунта и функции левого и правого желудочков.
Интра- и послеоперационное ведение
После отключения от аппарата искусственного кровообращения обычно требуется лечение инотропными средствами и в редких случаях механическая поддержка внутриаортальной баллонной контрапульсацией. Для улучшения функции правого желудочка полезно применение средств для снижения ЛСС.
Результаты хирургического лечения
По сводным данным, до 1976 г. непосредственная летальность после протезирования трехстворчатого клапана у больных с аномалией Эбштейна составляла 53%, в несколько раз превышая смертность при естественном течении. За период с 1976 по 1983 гг. при осуществлении 153 операций протезирования, в зарубежных клиниках летальность снизилась до 21,5%. Об улучшении результатов протезирования трехстворчатого клапана свидетельствовали данные работ Амосова и соавторов, Соловьева и соавторов, Ситара, Бураковского и соавторов, Barbero-Marcial и соавторов, Bove и соавторов, Shigenobu и соавторов, Westaby и соавторов, Nawa и соавторов. В связи с этим число протезирований клапана постоянно росло. Danielson и соавторы сообщали о результатах 69 протезирований с госпитальной летальностью 6%.
В настоящее время ранняя летальность варьирует в различных группах пациентов от 2,9 до 8% и зависит от хирургической эпохи и избранного метода лечения. Так, по данным Лазоришинца, госпитальная летальность после реконструктивных операций составила 5,5%, а после протезирования трехстворчатого клапана – 18%. Выживаемость к 5-му году после реконструктивных операций составила 94,5%, а после протезирования клапана – 59,8%. Почти у всех больных после операции наступает существенное улучшение состояния и большинство из них относят к I-II классу NYHA. Обычно уменьшаются размеры сердца и частота аритмий. Клапансохраняющие операции в функциональном отношении превосходят протезирование клапана.

Chavaud проанализировал летальные исходы в серии из 111 операций и выделил подгруппу пациентов с акинетическим правым желудочком, умерших в течение первых суток. После этого в аналогичных случаях данный центр стал применять разгрузку правого желудочка с помощью кавопульмонального анастомоза. В указанной подгруппе актуарная выживаемость к первому году после операции составила 88,5%, к 5, 10 и 15 годам – 85%.
Специфическими осложнениями отдаленного периода являются полная AV-блокада, предсердные и желудочковые аритмии, остаточная трикуспидальная недостаточность или стеноз после реконструкции клапана и нарушение функции протеза.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии