Хирургическое лечение ожирения: этапы, методы, последствия, прогноз
Специфические противопоказания к бариатрическим операциям при диабете: вторичный диабет; положительные антитела к глутаматдекарбоксилазе или к островковым клеткам поджелудочной железы (ICA); уровень С-пептида <1 нг/мл или отсутствие реакции C-пептида на пищевую провокацию.
Эффективность хирургического лечения определяют:
-
показателем, характеризующим снижение избыточной массы тела:
-
воздействием операции на течение ассоциированных С ожирением заболеваний;
-
изменениями качества жизни. Применяется балльная система Moorehead-Ardelt-II.
Особенности выполнения хирургических методов лечения
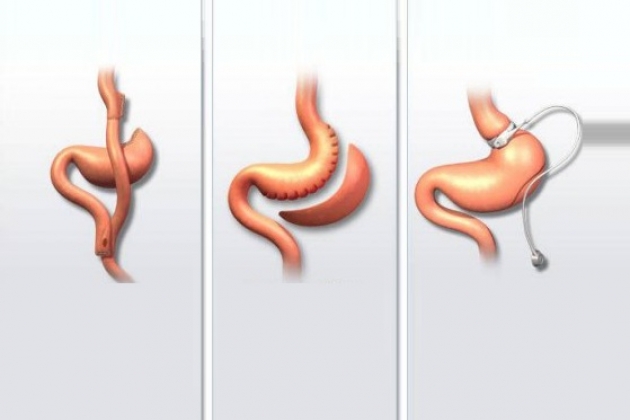
Бандажирование желудка
Операция известна с начала 1980 годов, была популярной в Европе в 1990 годах, в последние годы уступает место другим оперативным вмешательствам. Регулируемую модель бандажа предложил Кигтак В 1986 г. Обеспечивает снижение ИМГ на 50-60%, эффективность при сверхожирении непредсказуема. Может применяться как у подростков, так и у лиц пожилого возраста. При бандажировании с помощью силиконовой манжеты, оснащённой внутренней мембраной, формируется малая часть желудка объёмом не более 15 мл в области субкардии. Манжета с помощью тонкой трубки соединяется с подкожным портом, через который манжета инъекционно наполняется физраствором. Заполнение системы вызывает уменьшение диаметра выходного отдела из малой части желудка, что ограничивает объём принимаемой пищи.
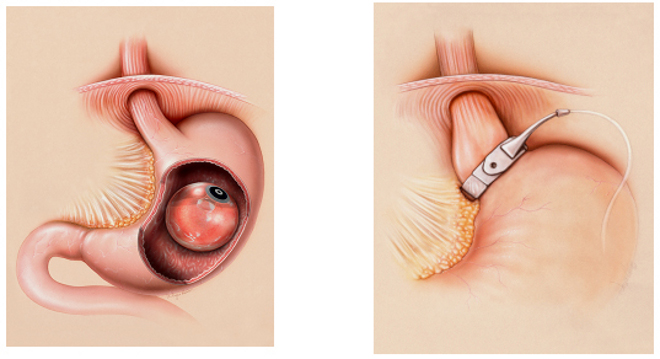
Методика бандажирования желудка. Операцию выполняют лапароскопически из 3-4 троакарных проколов, возможен однопортовый доступ. Этапы операции: формирование тупым путём позадижелудочного тоннеля от бессосудистого участка печёночно-желудочной связки (pars flaccida) по направлению к углу Гиса; проведение манжеты через сформированный тоннель и застегивание замка; выведение соединительной трубки на переднюю брюшную стенку; соединение с портом в области мечевидного отростка грудины либо левой прямой мышцы живота. Госпитализация на 1-2 дня, возможно лечение в стационаре одного дня.
Послеоперационный период. Дробный приём жидкости со следующих после операции суток, жидкое питание в течение первой недели. Заполнение системы (регулировку) проводит только специалист, начиная с 6-8 нед. после имплантации; первое заполнение и далее по необходимости – под рентгеновским контролем. Инструктаж пациентов в отношении режима питания, симптомов недостаточного либо избыточного заполнения системы. При отсутствии проходимости жидкости – экстренное обращение в клинику и удаление наполнителя. Применение регулируемого бандажирования желудка затруднено у лиц, проживающих в отдалённых регионах. При рентгенологическом контроле оценивают расположение бандажа, состояние пищевода, диаметр выходного соустья, эвакуацию из малой части желудка. При недозаполнении системы наблюдается недостаточная потеря массы тела.
Осложнения в раннем послеоперационном периоде очень редки, поздние встречаются достаточно часто. При нагноении порта показана ЭГДС для исключения пролежня стенки и попадания бандажа в просвет желудка. Слиппадж-синдром (синдром «соскальзывания») проявляется развитием полной непроходимости на уровне бандажа, рвотой, обезвоживанием, электролитными нарушениями, возможен болевой синдром. При рентгенологическом контроле определяют смещение угла стояния бандажа, дилатацию малой части желудка, отсутствие проходимости контрастного вещества на уровне бандажа.
Лечение: полное удаление наполнителя из системы, по мере восстановления проходимости и стихания воспалительных явлений – последующее заполнение системы, возможна плановая репозиция бандажа. При стойкой непроходимости – экстренная операция: удаление либо репозиция бандажа. Возможно развитие некроза стенки желудка по мере длительного сдавления внутри манжеты. Дилатация пищевода и его S-образная деформация развиваются при длительном переполнении системы. Отмечают рвоту, симптомы рефлюкс-эзофагита с возможной регургитацией в дыхательные пути во время сна и астмоидными приступами, в запущенных случаях – обезвоживание, развитие аспирационной пневмонии.
«Техногенные» осложнения БЖ: нарушения целостности системы (протечка манжеты, повреждение и инфицирование порта, отсоединение, перегибы и повреждения соединительной трубки). Ситуационно может потребоваться небольшая операция (устранение перегиба, резекция соединительной трубки, замена порта) либо удаление или замена всей системы бандажа, Пролежень стенки и попадание бандажа в просвет желудка (в 2-8% случаев) обычно проявляется дискомфортом в эпигастрии, гипертермией, набором массы тела, иногда – меленой, экссудативным плевритом, нагноением порта. Достоверный диагноз ставится при ЭГДС. Попадание бандажа в просвет желудка – показание к его удалению эндоскопическим либо лапароскопическим путем, Через 2-3 мес. показана повторная бариатрическая операция, поскольку удаление системы бандажа или её полная десуфляция приводят к рецидиву ожирения. Одномоментная операция по удалению пенетрировавшего в просвет желудка бандажа с проведением продольной резекции желудка или билиопанкреатического шунтирования (БПШ) описана ранее.
Продольная резекция желудка
Продольная резекция желудка (рукавная гастрэктомия, Sleeve-Gastrectomy) предложена в 1999 г. Gagner поначалу как первый этап лапароскопической операции билиопанкреатического отведения у лиц со сверхожирением и высоким хирургическим риском. В последние годы становится наиболее популярной бариатрическая операция, но первоначально как самостоятельная операция применялась лишь у лиц с тяжёлыми сопутствующими заболеваниями (в частности, при циррозе печени), пожилого возраста, а также у пациентов с относительно небольшим избытком массы тела,
Методика вмешательства. Выполняют обычно лапароскопически через 4-5 проколов, из лапаротомного доступа – при сочетании с абдоминопластикой, вмешательствами по поводу вентральных грыж, при сверхожирении как первый этап билиопанкреатического отведения.
Этапы операции: полная мобилизация большой кривизины от привратника до угла Гиса; поэтапное рассечение желудка эндостеплером со стороны антрального отдела по направлению к углу Гиса над зондом 32-38 F, установленным по малой кривизне; удаление примерно 4/5 желудка в зоне большой кривизны с оставлением минимально возможного объёма желудочной трубки (60-120 мл) по малой кривизне; укрепление шва желудка (перитонизация серозно-мышечными швами либо специальным синтетическим покрытием – buttress-material). При продольной резекции желудок имеет форму равномерной узкой трубки, соразмерной ширине пищевода.
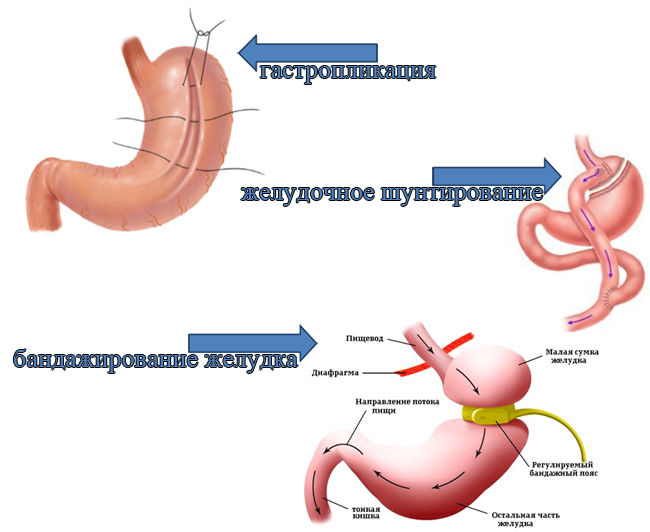
Механизмы снижения веса: ограничение количества потребляемой пищи, удаление грелинпродуцирующей зоны, возможен инкретиновый эффект за счёт быстрой эвакуации в ДПК. Преимущества продольной резекции желудка: предсказуемая потеря массы тела на первом этапе (по данным авторов, 73% к 2 годам и до 58% — к 5 годам наблюдения), отсутствие инородного материала в организме, физиологичность при сохранении основных сфинктеров желудка и пассажа пищи, отсутствие необходимости в пожизненной заместительной терапии, сравнительно несложная конверсия в гастрошунтирование и билиопанкреатическое отведение при необходимости. Отдалённые (10-летние и более) результаты продольной резекции желудка и устойчивость достигаемого эффекта при СД 2-го типа к настоящему времени неизвестны.
Послеоперационный период
Длительность госпитализации – 2-3 сут. Недопущение пищевых и водных перегрузок в течение первых 2-3 нед, антибиотики – 2-3 дня, антикоагулянты – 3-4 нед, ингибиторы протонной помпы – 2-3 мес. При наличии симптомов рефлюкс-эзофагита возможна пролонгированная терапия. УЗИ-наблюдение в связи с возможностью развития ЖКБ. С 3-й недели — витаминно-минеральная поддержка (мультивитамины, кальций с витамином D, ежемесячные инъекции витамина В12, препараты железа), длительность определяется результатами биохимического контроля.
Осложнения. В раннем послеоперационном периоде: несостоятельность шва желудка, кровотечение, перигастральные абсцессы, стеноз следование на 4-е сутки после продольной резекции желудка. Проявления: боль, не соответствующая срокам послеоперационного периода, гипертермия до 38-39 °С, лейкоцитоз, примесь желудочного содержимого по дренажу, часто – экссудативный плеврит слева. Рентгенологическое исследование с водорастворимым контрастным веществом peros (бариевая взвесь противопоказана!) и проба с метиленовым синим (при наличии дренажа) подтверждают диагноз. На обзорной рентгенограмме и при КТ возможно выявление уровней и скоплений жидкости (затёков). Варианты лечения: адекватное дренирование зоны несостоятельности и возможных затёков; ушивание зоны несостоятельности (не всегда эффективно, особенно в верхней части желудка); конверсия в гастрошунтирование с ликвидацией зоны несостоятельности шва в ходе операции.
Необходимы назогастральная декомпрессия, микроеюностомия или назоеюнальный зонд для питания, парентеральное питание с постепенным переводом на обычный приём пищи.
В отношении методов закрытия желудочных свищей единой тактики не выработано. Возможно стентирование желудочной трубки, Т-образное дренирование желудка в зоне «протечки», применение вакуум-аспирационных эндоскопических методов, пломбировка (заклеивание) свища. При длительно существующем свище в зоне «каскада» возможно наложение анастомоза с выключенной по Ру петлей тонкой кишки. При стенозах желудочной трубки применяют эндоскопическую дилатацию, серомиотомию в зоне стеноза, гастрошунтирование в обход стенозированного участка.
Метаболические осложнения после продольной резекции желудка редки. Железодефицитная анемия – 16%, В12-дефицитная анемия менее вероятна.
Повторные операции: при дилатации желудочной трубки – ререзекция желудка. Конверсию в гастрошунтирование (предпочтительна при рефлюкс-эзофагите) или дополнение билиопанкреатическим шунтированием выполняют при недостаточном снижении массы тела, рецидиве ожирения.
Гастрошунтирование
Операция гастрошунтирования (ГШ), или шунтирование желудка (gastric bypass), известна в разных модификациях с 1966 Г. (Е.Е. Mason и С. Ito). В результате ГШ большая часть желудка, вся ДПК и начальный отдел тощей кишки выключаются из пассажа пищи. Рестриктивный компонент ГШ может быть усилен наложением синтетической ленты или кольца на малую часть желудка. Мальабсорбтивный компонент определяется уровнем наложения гастроэнтероанастомоза.
Методика вмешательства. В большинстве случаев ГШ выполняют лапароскопически. Этапы операции: с помощью сшивателей вдоль малой кривизны в области субкардии изолируют малую часть желудка объёмом 20-30 мл; накладывают гастроэнтероанастомоз диаметром до 10-13 мм между малой частью желудка и петлёй тонкой кишки, выключенной по Ру или без выключения. Гастроэнтероанастомоз выполняют с помощью циркулярного сшивателя, линейного степлера либо с применением ручного шва. Петлю тонкой кишки можно проводить как впереди-, так и позадиободочно; требуется тщательное ушивание брыжеечных дефектов в окне мезоколон, пространстве Петерсона, брыжейке тонкой кишки.
Разновидности ГШ. В зависимости от уровня наложения межкишечного анастомоза по Ру используют несколько следующих вариантов вмешательства.
-
Стандартный, или классический, вариант (regular R-en-Y Gastric bypass). При этом межкишечный анастомоз располагают в 30-60 см от связки Трейтца, протяжённость выключенной по Ру петли тонкой кишки составляет 50-70 см.
-
ГШ на длинной петле, выключенной по Ру – 150 см (long-limb Gastric bypass).
-
Дистальное ГШ (distal Gastric Bypass) – межкишечный анастомоз располагают в 75-100 см от баугиниевой заслонки, длина алиментарной петли, выключенной по Ру, составляет 200-250 см. Перемещение анастомоза в дистальном направлении улучшает результат операции, но одновременно повышает вероятность метаболических осложнений (мальабсорбции белков, анемии и проявлений дефицита жирорастворимых витаминов (A, D, Е, К).
После ГШ необходим систематический пожизненный приём минеральных и витаминных добавок – поливитаминов, препаратов кальция (кальций-Б3) в суточной дозе 1000 мг, ежемесячные инъекции витамина В12, сульфата железа в суточной дозе 325 мг. С профилактической целью, особенно курящим пациентам, может потребоваться назначение противоязвенных препаратов.
Методика мини-ГШ (mini-gastric bypass, omega-loop gastric bypass) предложена в 2000 г. R Ruttledge с целью упрощения ГШ в лапароскопическом варианте. С помощью эндокатетера вдоль малой кривизны выделяют узкий длинный желудочный канал, полностью изолируемый от остальной части желудка. При мини-ГШ малую часть желудка анастомозируют непосредственно с петлёй тонкой кишки на расстоянии примерно в 200 см от связки Трейтца без межкишечных анастомозов. Имеется вероятность билиопанкреатического рефлюкса из тонкой кишки.
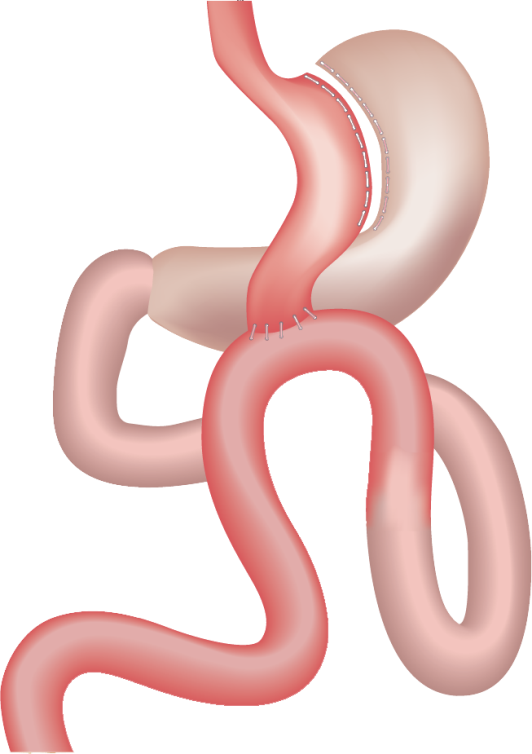
В малую часть желудка с развитием рефлюкс-гастрита и эзофагита, для предупреждения которого рекомендуют «подвешивать» приводящую петлю тонкой кишки к малой части желудка отдельными швами. Мини-ГШ находит применение при лечении СД 2-го типа у больных с ИМТ менее 35 кг/м2.
Эффективность. Потеря избыточной массы тела после ГШ составляет от 66 до 80% с возможностью её восстановления в отдалённые сроки, особенно при злоупотреблении жирной пищей и алкоголем. При рецидиве ожирения может быть выполнено эндоскопическое сужение гастроэнтероанастомоза, бандажирование и/или ререзекция малой части желудка, перемещение межкишечного анастомоза уровнем ниже, т. е. конверсия стандартного типа ГШ в дистальный. ГШ обладает мощным антидиабетическим эффектом, вероятность компенсации СД 2-го типа после ГШ приближается к 80%. В16-18% случаев после ГШ, особенно у больных СД 2-го типа, возможно развитие клинически значимых гипогликемии (незидиобластоз).
Осложнения. Послеоперационная летальность при ГШ обычно не превышает 0,5-1%, приемлемая частота осложнений в пределах 5-10%. Возможны следующие хирургические осложнения, а также осложнения, связанные с мальабсорбцией кальция, железа, витаминов, если пациент отказывается от приёма необходимых добавок.
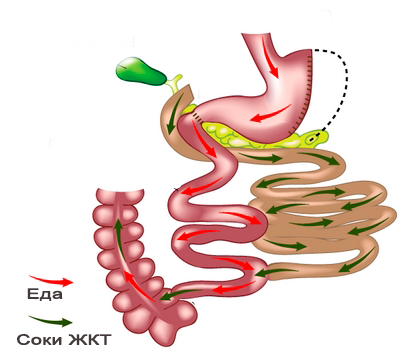
Билиопанкреатическое шунтирование
Операция БПШ может выполняться как открытым способом, так и лапароскопически. Чаще используется термин билиопанкреатическое отведение – biliopancreatic diversion. Впервые применена в клинике в 1979 Г. N. Scopinaro. Относится к комбинированным, но, главным образом, к мальабсорбтивным операциям. Рестриктивный компонент – субтотальная резекция желудка (при операции Scopinaro – дистальная, при Hess-Marceau – продольная) с оставлением культи желудка объёмом до 250 мл. Мальабсорбтивный компонент БПШ: реконструкция тонкой кишки с целью уменьшения всасывания жиров и крахмалов. Кишечный тракт при БПШ разделяют на 3 части.
-
Алиментарную петлю длиной 200-250 см – участок подвздошной кишки, анастомозируемый с культей желудка (или ДПК при модификации Hess-Marceau), по которой осуществляется транзит пищевого комка до межкишечного анастомоза.
-
Билиопанкреатическую петлю, т. е. выключенную из пассажа пищи ДПК, а также практически всю тощую и часть подвздошной кишки. По этой петле осуществляется отведение желчи и панкреатического сока в дистальный отдел подвздошной кишки.
-
Общую петлю – участок терминального отдела подвздошной кишки протяжённостью 50-100 см от межкишечного анастомоза до илеоцекального угла, где химус смешивается с основными пищеварительными соками и происходит всасывание жиров и сложных углеводов.
Рестриктивный компонент операции обеспечивает первоначальное снижение массы тела, селективная мальабсорбция жиров и сложных углеводов обеспечивает стабильное и долговременное её снижение на уровне 75% и более от дооперационной.

Специфические (не зависимые от снижения массы тела) эффекты БПШ: достижение нормохолестеринемии (100%) и стойкой ремиссии СД 2-го типа (95-98%). Неполная компенсация СД может наблюдаться в редких случаях при наличии секреторной недостаточности бета-клеток (латентном аутоиммунном диабете взрослых, вторичном диабете, СД 1-го типа), определяемой по базальному и стимулированному уровню С-пептида (<1 нг/л — сомнительный прогноз компенсации СД). За счёт свободного режима питания применение БПШ возможно у пациентов с трудно контролируемым пищевым поведением, в том числе при синдроме Прадера-Вилли.
БПШ в модификации Hess-Marceau (Biliopancreatic Diversion/ Duodenal Switch) впервые произвели в 1988 г. D.S. Hess И D.W Hess в США.
Преимущества этого метода: сохранение привратника, снижение до минимума частоты демпинг-синдрома и пептических язв в зоне дуоденоилеоанастомоза. Этапы операции: продольная резекция желудка с удалением его большой кривизны и сохранением привратника; пересечение ДПК в 2-3 см ниже привратника; пересечение тонкой кишки в 320-350 см от баугиниевой заслонки; анастомоз каудального конца тонкой кишки с начальным отделом ДПК; межкишечный анастомоз орального конца пересечённой тонкой кишки с подвздошной кишкой в 75-100 см от баугиниевой заслонки. Важно точное измерение петель тонкой кишки в растянутом состоянии по противобрыжеечному краю: оптимальная длина общей петли 80-100 см, алиментарной петли – 230-250 см, билиопанкреатическая петля – оставшийся отрезок тонкой кишки. Важно адекватное ушивание мезентериальных «окон». Холецистэктомию и аппендэктомию рассматривают как составные элементы операции. Пожизненная заместительная терапия обязательна после БПШ: поливитамины, набор жирорастворимых витаминов (A, D, Е, К), препараты кальция с витамином, сульфат железа (325 МГ/. сут), витамин В12. Противоязвенная терапия 2-3 мес. после операции, при необходимости – и далее.
Побочные эффекты и осложнения. В первые 2-6 мес. возможны общая слабость, выраженное отвращение к пище, особенно белковой; кашицеобразный стул с неприятным запахом до 3-6 раз в день, метеоризм, временное выпадение волос, проктиты, обострения геморроя (10%), эпизоды почечной колики (3%), акне. Злоупотребление алкоголем предрасполагает к циррозу печени. Возможны отклонения в анализах крови: анемии, гипопротеинемия, повышение активности аспартатаминотрансферазы и аланин- аминотрансферазы. Повышение уровня щелочной фосфатазы, паратгормона (вторичный гиперпаратиреоидизм), а также снижение содержания кальция и витамина В в крови могут свидетельствовать о напряжённом состоянии кальциевого обмена и требуют своевременной коррекции. Устранение послеоперационных грыж (выявлены у 13% больных) целесообразно одновременно с абдоминопластикой после стабилизации массы тела. В случае необходимости возможны симультанные операции по удлинению или укорочению функционирующей тонкой кишки.
В дополнение к механизмам действия при СД 2-го типа, свойственным и другим операциям, при БПШ особую роль в ликвидации инсулинорезистентности играет селективная мальабсорбция жиров и крахмалов, способствующая снижению концентрации жирных кислот в системе воротной вены и липотоксичности.
Другие варианты БПШ. Модификация Larrad ( 1989): дистальная резекция до 4/5 желудка, малая (до 50-70 см) длина билиопанкреатической и общей петель, протяжённая алиментарная петля с целью оптимальной абсорбции белков. Модификация G. Noya и соавт:. БПШ без резекции желудка, реконструкция тонкой кишки по аналогии с операцией Seopinaro. Применялась при умеренном избытке массы тела в сочетании с гиперхолестеринемией и/или СД 2-го типа. Сохранение желудка обусловливает ульцерогенное действие операции, особенно у курящих пациентов. Модификация Ю.И. Яшкова (2001): добавление Duodenal Switch к ранее сделанной ВГП с целью улучшения результата рестриктивной операции. Модификация SADI's (Single Anastomosis Duodeno-Ileal), предложенная A. Torres (2007) – упрощённый вариант Duodenal Switch, при котором после выполнения продольной резекции желудка проксимальный отдел ДПК анастомозируется с подвздошной кишкой на расстоянии 250 см от илеоцекального угла без дополнительных межкишечных анастомозов.
Общие принципы ведения больных после бариатрических операций
Ранняя (в течение 3-4 ч. после операции) мобилизация пациентов, превентивная антибактериальная (2-3 сут) и антикоагулянтная (3-4 нед) терапия, эластическая компрессия ног, ингибиторы желудочной секреции (2-3 мес). На 2-4-е сутки после операции – рентгеноконтрастное исследование с водорастворимым контрастным веществом. Послеоперационное наблюдение осуществляют по обычному алгоритму для бариатрических пациентов (см. выше) с проведением общеклинических и биохимических анализов крови.
Основные правила питания после всех бариатрических операций:
-
Есть в медленном темпе, растягивая приём пищи по времени на 30-40 мин.
-
Тщательно пережёвывать пищу, делая 30-35 жевательных движений, прежде чем пища будет проглочена.
-
При появлении ощущения наполнения желудка необходимо останавливаться.
-
Не допускать появления рвоты во время еды и тем более не привыкать к ней.
-
Избегать приёма грубоволокнистой пищи (жёсткое мясо, зелень в неизмельчённом виде, инжир, хурма и т. д.), а также приёма лекарств в виде крупных таблеток и капсул.
-
Не принимать жидкость одновременно с приёмом пищи. Пить рекомендуется либо за 30-40 мин до еды, либо через 30-40 мин после неё.
-
Ограничить приём высококалорийной пищи в жидком виде (мороженое, сметана, шоколад, алкоголь и т.п.), а также контролировать общее количество принимаемой жидкости.
Специфические осложнения, возможные после бариатрических операций
Послеоперационные грыжи – при открытых операциях, ЖКБ, кратковременная алопеция, анорексия с избыточной потерей массы тела (редко), гипопротеинемия и дефицит жирорастворимых витаминов (А, D, Е, К), более характерны для дистального ГШ и БПШ. Полинейропатии, в тяжёлых случаях – энцефалопатия Вернике-Корсакова, связанная с дефицитом витамина Вг возникает у больных с частыми рвотами. Лечение – парентеральное назначение больших доз тиамина. Рабдомиолиз – раздавливание ягодичных или поясничных мышц, возможно, с развитием острой почечной недостаточности – наблюдается при длительном нахождении тучного пациента на операционном столе. Профилактика – мониторирование уровня КФК, мягкие прокладки, смена положения тела на столе, при повышении КФК свыше 5000 – переливание раствора соды, маннитола, контроль азотистых шлаков крови. В случаях развития почечной недостаточности – гемодиализ, ультрагемофильтрация.
Вместо заключения
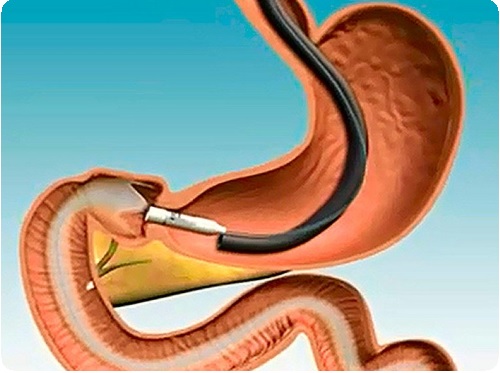
Малоинвазивные технологии, находящиеся в стадии разработки и клинического изучения: гастропликация – уменьшение объёма желудка путём инвагинации большой кривизны на всём протяжении; электростимуляция желудка (Cigaina V., 1995) – снижение массы тела посредством воздействия на моторику желудка электрическими импульсами от подкожного пейсмекера. Endobarrier – синтетический «рукав», имплантируемый эндоскопически и фиксируемый к области привратника с целью изоляции контакта пищи со слизистой оболочкой двенадцатиперстной и начального отдела тощей кишки. Цель – прекращение постпрандиальных сигналов со стороны ДПК, а также достижение мальабсорбции в зоне «рукава».
Международная федерация хирургии ожирения и метаболических нарушений (IFSO) – организация учреждённая в 1995 г. и к 2014 г. насчитывавшая 58 стран. Состоит из четырёх отделений (Chapters); Североамериканского, Южно- и Латиноамериканского, Европейского и Азиатско-Тихоокеанского. Россия, представленная Обществом бариатрических хирургов, является коллективным членом IFSO с 2000 г. Ежегодно под эгидой IFSO проводятся международные конгрессы по бариатрической и метаболической хирургии. Печатные издания; журнал Obesity Surgery (Хирургия ожирения) – официальный печатный орган IFSO; журнал SOARD (издается Американским Обществом бариатрических хирургов); журнал «Ожирение и метаболизм» (издаётся в России).
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии