Ближайший послеоперационный период. Послеоперационное ведение новорожденных
Лечение педиатрического пациента в ближайшем послеоперационном периоде, который перенес кардиоторакальную операцию, является важным этапом в общей последовательности анестезиологического и хирургического обеспечения. Несмотря на то, что основное влияние на результат определяется ходом операции, послеоперационное обеспечение также является важным фактором. Как члену операционной бригады, анестезиологу необходимо понимать и быть вовлеченным в ведение ближайшего послеоперационного периода. Детальное изложение принципов послеоперационного ведения педиатрических пациентов после кардиохирургических вмешательств находится за пределами этой главы. Однако чтобы предоставить анестезиологу фундаментальную осведомленность, хирург дает несколько общих руководящих принципов и подходов.

Послеоперационный период может быть охарактеризован серией физиологических и фармакологических изменений, поскольку организм восстанавливается после аномальных биологических состояний, вызванных искусственным кровообращением и кардиохирургическим вмешательством. В течение этого периода последствия операции, любые базовые нарушения, эффекты гипотермического искусственного кровообращения и специальных техник, таких как DHCA, могут создавать специфические проблемы. В ближайшем послеоперационном периоде ненормальное восстановление и специфические проблемы должны своевременно распознаваться и вестись соответствующим образом. К счастью, большинство пациентов, обуславливая низкую заболеваемость и смертность, сами в состоянии компенсировать изменения, вызванные нарушениями физиологии из-за хирургической коррекции и последствий искусственного кровообращения, касающиеся состояний редуцированной патофизиологической нагрузки.
По этой причине руководящим принципом ведения послеоперационного пациента является понимание как нормального, так и патологического процесса восстановления после анестезии и кардиохирургического вмешательства. Ближайший послеоперационный период даже при нормальном восстановлении является периодом постоянного физиологического сдвига из-за остаточных фармакологических эффектов анестетиков и продолжающихся физиологических изменений, вторичных по отношению к резкой перестройке гемодинамических условий нагрузки, хирургической травме и экстракорпоральному кровообращению. Анестезия и операция оказывают влияние не только на состояние сознания пациента, но также на:
-
сердечно-сосудистую;
-
дыхательную;
-
почечную и печеночную функции;
-
жидкостный и электролитный баланс;
-
иммунологические защитные механизмы.
Несмотря на все эти изменения, послеоперационное ведение должно быть предсказуемым и стандартизированным для большинства пациентов, переносящих вмешательства на сердце.

В целом, можно выделить четыре временных фазы послеоперационного ведения кардиологического пациента:
-
транспортировка в отделение интенсивной терапии (ИТ);
-
стабилизация в отделении ИТ;
-
отлучение от инотропной и вентиляционной поддержки;
-
мобилизация отеков.
Пациенты проходят через эти фазы с разной скоростью, которая зависит от таких факторов, как основной патологический процесс, дооперационное состояние здоровья, последствия хирургического вмешательства, длительность искусственного кровообращения, наличие или отсутствие интраоперационных осложнений. Одной из важнейших функций команды ИТ является выявление у пациентов послеоперационных осложнений, которые восстанавливаются ненормально, и обеспечение им активного лечения. Поскольку физиологический сдвиг после кардиохирургического вмешательства является весьма существенным, но самостоятельно купирующимся в ходе нормального восстановления, распознавание патологических процессов может оказаться затруднительным. В данных обстоятельствах унифицированный, мультидисциплинарный подход с участием опытных врачей и сестер способствует выявлению любых отклонений в ходе восстановительного процесса. Такие нарушения часто являются показанием для более тщательного наблюдения, использования расширенного инвазивного мониторинга, фармакологической интервенции и усиленной сердечно-легочной технической поддержки. Осложнения послеоперационного периода включают:
-
гиповолемию;
-
остаточный структурный кардиальный дефект;
-
право- и левожелудочковую недостаточность;
-
гипердинамическое состояние циркуляции;
-
легочную артериальную гипертензию;
-
тампонаду сердца;
-
нарушения ритма;
-
остановку сердца;
-
дыхательную недостаточность;
-
олигурию;
-
судороги;
-
дисфункцию головного мозга.
Выявление этих отклонений от нормального течения восстановительного периода и их настойчивое лечение является чрезвычайно важным.
Важным разделом, где анестезиолог может помочь выздоровлению кардиохирургического пациента, является контроль над болью. Боль и седация находятся среди наиболее часто встречающихся проблем, требующих интенсивной терапии. Многие факторы оказывают влияние на начало, распространенность и тяжесть послеоперационных болей. Ослабление стрессового ответа в ближайшем послеоперационном периоде с использованием инфузии мощных опиоидов снижает заболеваемость у тяжелобольных детей раннего возраста. Ослабление послеоперационной боли может обеспечиваться препаратами, вводимыми дооперационно, а также интраоперационно в процессе ведения анестезии с использованием сильнодействующих опиоидов. Пациентам, не получавшим опиоиды на дооперационном этапе или в ходе операции, будут требоваться аналгетики в ближайшем послеоперационном периоде, как только элиминируется ингаляционный анестетик. Большинство случаев послеоперационных болей могут контролироваться назначением небольших внутривенных доз опиоидов, обычно морфина. Это важно у пациента, отлучаемого от вентиляционной поддержки в ходе раннего послеоперационного периода. Пациенты, которые интубированы и находятся на искусственной вентиляции всю ночь, должны получать адекватную седацию и обезболивание до начала отлучения от вентиляционной поддержки. Обычно это осуществляется постоянной инфузией бензодиазепина и опиоида. В послеоперационном периоде постоянная инфузия седативных препаратов и аналгетиков приводит к более стойкому и надежному контролю боли. После отлучения от искусственной вентиляции пациент одновременно отлучается от седации и аналгетиков. В этих обстоятельствах внимательное титрование опиоидов часто приводит к быстрому обезболиванию. Показано, что у пациентов с реактивной легочной артериальной гипертензией опиоиды предупреждают развитие ее кризов.
У детей после торакотомии для послеоперационного обезболивания может использоваться регионарная анестезия. Этот метод позволяет избежать опиоид-индуцированного угнетения дыхания при внутривенном введении этих препаратов. Назначение опиоидов в эпидуральное пространство является очень эффективным подходом для лечения боли. Эта методика используется у детей для послеоперационного контроля боли посредством доставки препарата в эпидуральное пространство через каудальный доступ в виде однократного введения или в небольшой каудальный катетер. Морфин или гидроморфон обеспечивают эффективную аналгезию длительностью от 6 до 12 ч, без значимого угнетения дыхания. Морфин для каудального введения в дозе от 0,05 до 0,075 мг/кг, разведенный стерильным физиологическим раствором до общего объема 1,25 мл/кг, используется с хорошим эффектом. Для детей, которые экстубируются в раннем послеоперационном периоде, для послеоперационного обезболивания, по-видимому, наилучшим образом подходит использование регионарной анестезии. Относительными противопоказаниями для использования этой методики являются гемодинамическая нестабильность и наличие патологического коагуляционного профиля с продолжающимся активным кровотечением. При использовании регионарной техники можно ожидать лучшей артериальной оксигенации, более быстрого отлучения от искусственной вентиляции и уменьшения частоты послеоперационных дыхательных осложнений. У пациентов, не имеющих катетера в мочевом пузыре, часто происходит задержка мочи. Как правило, это не требует лечения.

Дети, требующие расширенной торакотомии или билатеральной торакостернотомии (т.н. «раковина моллюска» - clamshell), заслуживают рассмотрения вопроса об использовании у них грудной эпидуральной аналгезии. Данная методика значительно уменьшает угнетение дыхания и нарушения легочной механики, которые связаны с введением большого количества опиоидов, которые потребуются для обеспечения адекватной аналгезии при крайне болезненных доступах. При необходимости системной гепаринизации в послеоперационном периоде мы, как правило, будем откладывать установку этих катетеров до нейтрализации эффектов гепарина. У пациентов после коррекции коарктации аорты из левосторонней торакотомии мы устанавливаем каудальный или эпидуральный катетер после появления двигательной функции в нижних конечностях. Пациентам после сердечно-легочной трансплантации грудной эпидуральный катетер устанавливается сразу в послеоперационном периоде, когда пациенту прекращается введение внутривенных препаратов, которые будут неблагоприятно влиять на его способность дышать в ближайшее время от планируемой экстубации. Обычно такие пациенты нуждаются в грудном эпидуральном катетере в течение нескольких дней.
Послеоперационные нейрофизиологические нарушения
Поскольку показатели хирургической летальности улучшились, неврологические нарушения у новорожденных и младенцев с врожденными пороками сердца представляются все более и более значимыми. Хотя ранние послеоперационные осложнения со стороны ЦНС, такие как инсульт или судороги, встречаются у небольшого процента новорожденных с врожденными пороками сердца, важность более тонких неврологических нарушений при длительном наблюдении становится все более очевидной.
Эти показатели могут включать небольшие и значимые двигательные нарушения, задержки развития речи, нарушения визуально-двигательных и визуальных пространственных функций, нарушения, связанные с дефицитом внимания, расстройством обучения, недееспособность. Наличие «врожденного заболевания головного мозга» у пациентов с врожденными пороками сердца представляет сложную задачу в отношении улучшения отдаленных неврологических исходов. Многие новорожденные с ВПС имеют врожденные структурные отклонения головного мозга, хромосомные нарушения или и то, и другое, а также физиологические нарушения, которые могут ухудшать развитие головного мозга. На ультрасонографии аномалии головного мозга были выявлены у одной пятой доношенных младенцев, подвергшихся кардиохирургическим вмешательствам, а половина аномалий имелась на дооперационном этапе.

В послеоперационном периоде вторичное неврологическое повреждение может быть связано с постперфузионными изменениями мозговой ауторегуляции и дополнительным гипоксически-ишемическим инсультом, судорогами и другими проблемами, связанными с длительным нахождением в интенсивной терапии. В дополнение к пренатальным и модифицируемым факторам наследственные факторы и факторы внешней среды, как известно, также важны. К сожалению, модифицируемые периоперационные факторы могут меньше объяснять изменчивость в отдаленных результатах, чем специфические показатели пациента. Новое послеоперационное неврологическое повреждение может быть выявлено клинически более чем у 10% детей раннего возраста и более чем у 50% при использовании более чувствительных визуализирующих методов диагностики, таких как МРТ. Поскольку новое неврологическое повреждение может произойти в различные моменты времени в течение госпитализации новорожденного, периоперационное внимание является чрезвычайно важным для снижения известных факторов риска. Механизмы повреждения ЦНС у младенцев, подвергающихся кардиохирургическим вмешательствам, включают гипоксию и ишемию, эмболию, воздействие активных форм кислородных радикалов и воспалительную микроваскулопатию. На дооперационном этапе основное внимание должно быть направлено на предотвращение гипоксическо-ишемического повреждения и тромбоэмболических инсультов. Модифицируемые интраоперационные факторы, связанные с повреждением ЦНС, включают изменения рН и гематокрита в ходе искусственного кровообращения, региональную мозговую перфузию и использование DHCA, но не ограничиваются ими. Неблагоприятные эффекты искусственного кровообращения могут быть более выраженными у детей раннего возраста по сравнению с детьми старшего возраста или взрослыми из-за незрелости у них органных функций и тканей, а также из-за размеров контура искусственного кровообращения относительно размера их тела. В области интраоперационной профилактики неврологического повреждения было проведено значительное число исследований. В продолжающихся изменениях технологий и в новых методах лечения, активно исследовалось искусственное кровообращение и другие методы поддержки.
Механические вспомогательные устройства
За последние десятилетия выживаемость детей с врожденными пороками сердца, а также с легочными заболеваниями, улучшилась благодаря усовершенствованному дооперационному ведению, хирургической технике, анестезиологическому пособию, лекарственной терапии и послеоперационному ведению. Несмотря на эти достижения, пациенты все еще могут требовать лечения как острой, так и хронической сердечной недостаточности, устойчивой к лекарственной терапии. Механическая поддержка в виде ЭКМО или желудочковых ассистирующих устройств (ventricular assist devices – VADs) может оказаться необходимой. Примеры состояний, которые могут потребовать поддержки, включают:
-
невозможность отлучения от искусственного кровообращения;
-
внезапную остановку сердца;
-
злокачественную аритмию;
-
ухудшение функции миокарда, которая вторична по отношению к основному врожденному пороку или связана с приобретенной кардиомиопатией.
Однако, к счастью, количество таких случаев невелико. Так, менее 2% пациентов после перфузии требуют подобного вмешательства. Механическая поддержка может быть использована как метод лечения по восстановлению функции желудочка, в качестве моста к трансплантации или для поддержки сердца с ограниченным функциональным резервом, требующим инвазивных методов диагностики или лечения (например, синдром Вильямса с тяжелым надклапанным стенозом легочной артерии или аорты). Как при любом методе лечения, противопоказания должны быть исключены до того, как приступают к использованию механического ассистирующего устройства. Такими противопоказаниями являются:
-
крайняя степень недоношенности;
-
тяжелая и необратимая полиорганная недостаточность;
-
инкурабельная опухоль;
-
исходная неврологическая девастация.
Анестезиологическое пособие при использовании ЭКМО является поддерживающим и имеет ограниченные возможности для оказания помощи в случаях возникновении реанимационных мероприятий и при кровотечении, которое связано с кардиохирургическим вмешательством и продолжалось во время перехода на ЭКМО. Как только при помощи ЭКМО достигается полная поддержка, искусственная вентиляция продолжается, но с более редкой частотой, порядка 10 дыханий в мин, с пиковым давлением 20 см вод. ст., с РЕЕР от 5 до 10 см вод. ст. и с FiO2, сниженным примерно до 40%. Такие настройки вентилятора будут способствовать предупреждению ателектазов с управлением СО2 и О2 за счет потока крови через мембрану оксигенатора. Этот принцип поддержки имеет существенные отличия от пациентов, которым устанавливается желудочковое ассистирующее устройство (VAD – ventricular assist device). Здесь анестезиолог продолжает вести пациента как при обычной процедуре отлучения от искусственного кровообращения. Очевидно, что в этой методике существуют и отличия. Если установлено системное желудочковое ассистирующее устройство, особое внимание должно уделяться желудочку, прокачивающему кровь в легочный сосудистый бассейн, так как недостаточность этого желудочка будет иметь катастрофические последствия. Следовательно, лечение, направленное на разгрузку этого легочного желудочка, является жизненно важным и будет включать инодилаторы в виде ингибиторов фосфодиэстеразы, инотропную поддержку и, возможно, даже ингаляцию оксида азота для снижения легочного сосудистого сопротивления и содействия антеградному току крови. Для эффективного функционирования VAD совместно с перфузиологом должна оцениваться и поддерживаться внутрисосудистая нагрузка объемом и, таким образом, адекватная разгрузка ассистируемого желудочка. Пристальное внимание к состоянию легочной функции также является жизненно важным. Необходимо использовать адекватную легочную санацию, маневр мобилизации дыхательного объема (recruitment maneuver) и соответствующие вентиляционные параметры. Как будет упомянуто позднее, кровотечение является потенциально возможным при имплантации VAD, и, следовательно, должна быть спланирована четкая стратегия лечения в виде антифибринолитиков, достаточного количества крови и препаратов крови, и даже возможность использования активированных факторов свертывания (например, фактор VII).
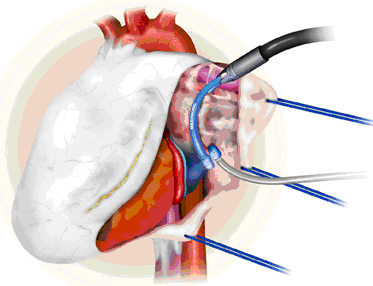
Имеется ряд отличий, которые могут быть отмечены между упомянутыми вспомогательными устройствами. Возможность кровотечения существует во время установки обоих устройств, однако, из клинической практики кажется, что в связи с протяженной диссекцией и необходимостью достаточно большой вентрикулотомии имплантация VAD (и особенно бивентрикулярного VAD) является более трудной. Однако требования антикоагуляции в поддержании активированного времени свертывания в пределах 180-200 с для ЭКМО также могут приводить к продолжающемуся и значительному кровотечению, особенно если она применяется у тех пациентов, которые требуют поддержки в ближайшем послеоперационном периоде. Использование контура ЭКМО с мембранным оксигенатором требует постоянной внутривенной антикоагуляции с поддержанием активированного времени свертывания крови (activated clotting time – АСТ) в вышеупомянутых пределах. Исключая ближайший послеоперационный период, пациенты с системой VAD могут быть переведены на оральные препараты. Для таких пациентов рекомендуется терапия, состоящая из двух частей.
-
Антитромбоцитарная терапия, включающая аспирин или клопидогрель.
-
Вторая часть терапии включает использование антикоагулянтов варфарина (кумадин) или подкожное введение низкомолекулярного гепарина.
Как упоминалось ранее, эти методы используются в качестве промежуточного этапа к трансплантации, в связи с чем большое значение имеет влияние антигенов донора. В исследовании Stiller и соавт., сравнивавших объем использованных препаратов крови, было показано, что пациенты, у которых устанавливался VAD, он был меньше в течение 8 дней после его установки. Существенно указанное авторами то, что эта разница сохранялась даже тогда, когда поддержка была начата одновременно с окончанием операции.
Существуют три потенциальных недостатка при использовании системы VAD. При его использовании отсутствует возможность легочной поддержки, а это ограничивает его применение рамками пациентов, у которых легочная функция не нарушена. В случае необходимости бивентрикулярной поддержки пациенту потребуются два отдельных устройства VAD, требующие установки четырех канюль, что у новорожденных детей может быть технически трудно выполнимым. Третьим недостатком является то, что установка VAD не может быть выполнена в экстренной ситуации или у постели больного, как это возможно при использовании ЭКМО.
Важными преимуществами VAD систем является возможность пациентов передвигаться, пока они находятся на поддержке, а также то, что VAD поддержка может продолжаться в течение нескольких месяцев в сравнении лишь с неделями при ЭКМО. Другим важным преимуществом перед ЭКМО является то, что этим пациентам в дальнейшем не потребуется дренирование левого предсердия. У пациентов с ЭКМО это достигается установкой дренажа в левое предсердие во время стернотомии или баллонной предсердной септостомии, для выполнения которой может требоваться перевод ребенка в катетеризационную лабораторию с вероятностью развития осложнений, связанных с транспортировкой пациента на системе ЭКМО.

Несмотря на успешные реанимационные мероприятия и помещение пациентов на механические вспомогательные устройства, осложнения и летальность у них остаются высокими, с худшими результатами при ЭКМО. Летальность при ЭКМО в 1990-е гг. составляла порядка 47%, не имея значимого улучшения выживаемости в сериях, которые были опубликованны в ранние 2000-е гг. Напротив, выживаемость пациентов на VAD оказывается выше, достигая 80% в пределах цитируемых изданий, среди доживших до трансплантации или успешно отлученных от поддержки. По данным Blume и соавторов, было, однако, отмечено, что пациенты с ассоциированными врожденными пороками сердца, которые младше по возрасту и меньше по весу, имеют более высокую летальность в сравнении с пациентами, болеющими молниеносными формами миокардитов и кардиомиопатиями. Параллельно с данными выживаемости, следующим наиболее важным показателем является неврологический исход, который представляется лучшим в группе VAD. Факторами риска для неблагоприятного неврологического исхода в очередной раз отмечены низкая масса тела и длительность DHCA, оба из которых ставят пациентов на ЭКМО в неблагоприятные условия выживания, поскольку пациенты с ЭКМО по возрасту и весу будут меньше и многим из тех, кто переносит DHCA при коррекции врожденных пороков, будет требоваться экстренная поддержка ЭКМО для отлучения от искусственного кровообращения или в ближайшем послеоперационном периоде.
обращая внимание на предикторы выживаемости при лечении оказалось, что одной общей переменной, которая может прогнозировать выживаемость, является восстановление желудочковой функции между 3 и 5 днями после начала экстракорпоральной поддержки; и если требуется поддержка в течение более длительного времени, осложнения и летальность возрастают. Как отмечено ранее, обе методики были успешно использованы в качестве моста для трансплантации, при этом пациенты с системой VAD к моменту трансплантации имеют выживаемость более 80%, тогда как пациенты с ЭКМО демонстрируют выживаемость менее 60%. Эти данные, однако, могут быть искаженными, поскольку ЭКМО чаще используется у детей раннего возраста и у пациентов с более сложными врожденными пороками сердца, при этом известно, что оба этих фактора увеличивают летальность среди пациентов с VAD. При использовании обеих методик важными причинами осложнений и летальности у пациентов являются:
-
цереброваскулярные проблемы, вызванные геморрагическими или эмболическими причинами;
-
проблемы, связанные с экстракорпоральным контуром (например, тромбоз контура);
-
почечная недостаточность, требующая гемофильтрации;
-
сепсис;
-
продолжающееся кровотечение и полиорганная недостаточность.
Хотя эти методики часто сравниваются параллельно друг с другом, обе они занимают исключительное место в оказании помощи детям с сердечной недостаточностью. ЭКМО обладает большим преимуществом в том, что может быть применена быстро в экстренных случаях у пациентов любого возраста и комплекции. В прошлом вес являлся лимитирующим фактором для имплантации систем VAD у педиатрических пациентов. Система «the Berlin Heart VAD» доступна для использования даже у новорожденных. Система применялась в Европе в течение более 10 лет и имеет объем насоса от 10 до 80 мл. В настоящее время в США устройство доступно только для экстренного благотворительного использования. Однако очевидно, что эти две методики, несомненно, могут дополнять друг друга, используя ЭКМО в острых ситуациях, и как только пациент физиологически стабилизирован, но все еще требует поддержки, может использоваться система VAD, которая должна обеспечить ее в течение длительного периода.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии