Активная и пассивная иммунизация: этапы, показания, противопоказания
Термины «вакцинация» и «вакцина» появились после работ Э. Дженнера, который более 200 лет назад доказал, что введение человеку жидкости, взятой из очагов кожных поражений коров, инфицированных коровьей оспой, защищает людей от высококонтагиозной и смертельной болезни — оспы. Процесс, описанный Э.Дженером, стал называться «вакцинацией» (от лат. vacca — корова), а вещество, используемое для вакцинации, стали называть вакциной. Коровья оспа (вирус вакцинии) вызывает защитный иммунный ответ относительно вируса оспы, поскольку оба эти вируса обладают одинаковыми антигенными эпитопами, вызывающими защитный иммунный ответ.
Рекомендуемая иммунизация
В последние годы в схему вакцинации детей раннего возраста (первая доза в возрасте 2 мес) была добавлена вакцина из конъюгата анатоксина дифтерийного полисахарида Haemophilus influenzae типа b. Он является основной причиной менингита у неиммунизированных детей. Использование этой вакцины привело к резкому снижению числа инфекций, вызванных Н. influenzae типа b у вакцинированных детей. Недавно было одобрено применение гептавалентной пневмококковой вакцины для предотвращения у детей инфекционных заболеваний, таких как средний отит.
Вакцинация отдельных групп населения
В дополнение к обычной схеме иммунизации, некоторые индивидуумы проходят дополнительную вакцинацию. Вирус гриппа (инактивированный) применяют у людей старше 60 лет, детей и взрослых с сердечно-легочными нарушениями. Вакцина против гепатита В (вирусный белок, произведенный с помощью технологии рекомбинантных ДНК) вводится работникам здравоохранения и лицам, оказывающим экстренную помощь, которые контактируют с человеческой кровью. Вирус гепатита А (инактивированный) был разрешен для применения у детей и взрослых. Аденовирусные вакцины используются для предотвращения вспышек респираторных инфекций у новобранцев. Вакцина против сибирской язвы применяется среди военного персонала ввиду опасности воздействия спор Bacillus anthracis при использовании их в качестве биологического оружия. Вакцинация от оспы уже не рекомендуется для гражданских лиц, но все еще проводится отдельным контингентам военнослужащих. Однако в настоящее время идут серьезные дебаты о возможности более широкого применения данной вакцины, учитывая возросшую опасность применения оспы в качестве биологического оружия.
В отдельных популяциях также используются некоторые вакцины против бактериальных инфекций. Содержащая несколько антигенных типов капсулярных полисахаридов поливалентная вакцина от Streptococcus pneumoniae вводится людям с сердечно-легочными нарушениями, с поврежденной или хирургически удаленной селезенкой, а также больным серповидно-клеточной анемией, почечной недостаточностью, алкогольным циррозом или сахарным диабетом. Эти люди обладают ограниченной способностью развития антительной/комплементарной/фагоцитарной активности, необходимой для борьбы с инкапсулированными бактериями, такими как S. pneumoniae. К сожалению, эта вакцина не так эффективна у людей из группы риска заболевания пневмококковой пневмонией, как у здоровых лиц, поскольку дефекты иммунитета препятствуют выработке сильного ответа со стороны антител. Вакцина от Neisseria meningitidis (несколько серологических групп капсулированных полисахаридов) применяется среди новобранцев и детей в регионах, где повышен риск заболевания. Эта вакцина также рекомендуется для использования среди молодежи, проживающей в общежитиях колледжей и находящейся в группе повышенного риска развития менингококкового менингита. В настоящее время для применения в целях защиты от Salmonella typhi, вызывающей брюшной тиф, доступны как живая аттенуированная, так и полисахаридная вакцины. В связи с ограниченной эффективностью или потребностью некоторые вакцины рекомендуется использовать только при строго определенных обстоятельствах.
Основные механизмы защиты
Значимость первичного и вторичного ответов
Быстрота реакции памяти при повторной встрече организма с антигеном обеспечивает защиту на случай будущих повторных контактов с инфицирующим агентом. Эта реакция памяти имеет отношение, по крайней мере, к двум способам иммунопрофилактики. Первый из них может быть особенно важен в случаях с инфекциями, имеющими относительно длинным инкубационным периодом (более 7 сут). У человека, инфицированного агентом А, который вызывает заболевание после инкубационного периода 3 сут, первичный иммунный ответ возникает некоторое время (например, 7-14 сут) спустя после развития инфекции. При втором контакте с агентом А у человека может также развиться заболевание, поскольку реакция памяти может оказаться недостаточно быстрой для подавления этого агента Человек, инфицированный агентом В, вызывающим заболевание после инкубационного периода 14 сут, выработает первичный ответ (например, 7-14 сут после развития инфекции). При повторном контакте с агентом В реакция памяти, развившаяся в течение 7 сут, будет эффективна для уменьшения тяжести или предотвращения заболевания с инкубационным периодом 14 суток.
Вторым важным фактором реакции памяти является величина, которой достигает иммунный ответ. В примерах, приведенных ранее, агент А, который вызывает заболевание через 3 сут, может не привести к развитию заболевания после повторного контакта, если сохраняется достаточно высокий уровень антител. Такого уровня можно достичь намеренно серией иммунизаций (особенно при применении неживых антигенов). Таким образом, обычной практикой стало применение нескольких инъекций столбнячного анатоксина (в виде АДС) на протяжении 6 мес. при иммунизации детей. Такие первоначальные инъекции приводят к выработке вторичных реакций памяти, которые существенно повышают концентрацию антитоксина до защитных уровней, сохраняющихся в сыворотке крови в течение 10-20 лет.
Возраст и время иммунизации
На механизмы, участвующие в защите, может повлиять ряд факторов, таких как характер питания, наличие заболевания (которое влияет на уровень содержания глобулинов и клеточно-опосредованный иммунитет) и возраст. Время иммунизации у детей в основном определяется тем фактом, что эффективность определенных вакцин зависит от возраста ребенка.
В утробе матери человеческий плод в норме обычно хорошо защищен от большинства инфекционных агентов, хотя определенные патогены (например, вирус краснухи Toxoplasma gondii) могут инфицировать мать и серьезно повредить плоду. Материнский иммунитет защищает плод путем перехватывания и удаления инфекционных агентов до того, как они достигают матки; он также защищает новорожденных посредством трансплацентарных антител или антител, поступающих из молочных желез.
У плода и новорожденного плохо развиты лимфоидные органы за исключением тимуса, размер которого ко времени рождения является самым большим по отношению к размеру тела. Плод способен синтезировать в основном IgM, которые появляются после 6 мес. беременности. Уровень IgM постепенно увеличивается, составляя примерно 10% уровня взрослого человека к моменту рождения.
Примерно на 2-м месяце беременности у плода обнаруживают IgG, но этот IgG материнского происхождения. Его уровень значительно повышается примерно на 4-м месяце беременности и сильно возрастает в последнем триместре. На момент рождения концентрация IgG слегка превышает концентрацию IgG у матери. Таким образом, плод снабжается материнскими IgG, которые могут обеспечить антитоксическую, противовирусную и в некоторой степени антибактериальную защиту. Уровень этих материнских антител постепенно понижается, как только ребенок начинает синтезировать свои собственные антитела. Ко 2-3-му месяцу жизни общий уровень IgG составляет менее 50 %, имевшегося при рождении.
У новорожденных иммунный ответ, например против некоторых инфекционных агентов (Toxoplasma gondii, Listeria monocytogenes, вирус простого герпеса), недостаточно хорошо проявляется по ряду характеристик, если решающее значение имеет клеточно-опосредованный иммунитет. При этом новорожденный может вырабатывать антитела к различным антигенам, таким как парентерально вводимый анатоксин, инактивированный вирус полиомиелита, антигены гепатита В и др. Однако применение вакцины против коклюша вскоре после рождения не только не индуцирует защитный ответ, но и вызывает измененный ответ на вакцину, если ее повторно используют в детстве. Таким образом, за исключением вакцины против гепатита В, которая применяется вскоре после рождения, в большинстве индустриальных стран первоначальное применение вакцин откладывается до того времени, пока ребенку не исполнится 2 мес. Однако ВОЗ рекомендует начинать иммунизацию в развивающихся странах несколько раньше (в возрасте 6 недель).
Пока материнские антитела способны обеспечивать новорожденному защиту от различных инфекционных агентов, они также могут уменьшать ответ на антиген. Например, пока у годовалого ребенка есть достаточное количество материнских антител против кори, они могут вмешиваться в активный ответ со стороны ребенка на вакцину, поэтому вакцинация обычно откладывается хотя бы до достижения годовалого возраста.
Дети в возрасте менее 2 лет обычно не способны вырабатывать достаточно антител в ответ на введение бактериальных капсулярных полисахаридов, таких как у Haemophilus influenzae типа b, различных серогрупп Neisseria meningitidis и серотипов Streptococcus pneumoniae. Было высказано предположение, что такая неспособность обусловлена тем, что дети раннего возраста не отвечают на Т-независимые антигены, несмотря на их способность (при нахождении в матке) вырабатывать lgM. Химическая связь полисахарида с Т-зависимыми антигенами (например, анатоксином дифтерии) или белком наружной мембраны N. meningitidis улучшила иммуногенные свойства таким образом, что дети моложе 2 лет стали реагировать на полисахариды. В настоящее время доступна эффективная конъюгированная вакцина против Н. influenzae, и вызываемая этим патогеном инфекция практически не возникает у вакцинированных детей. На сегодняшний день стало обычным и применение гептовалентной вакцины против S.pneumoniae, содержащей полисахариды пневмококков наиболее распространенных при детских инфекциях серотипов.

В возрастной группе старше 60 лет тоже отмечается уменьшение способности к развитию первичного ответа на некоторые антигены, такие как у вакцины против вируса гриппа. Однако организм пожилых людей сохраняет способность к вторичному ответу на антигены, с которыми он до этого встречался. Организм здорового пожилого человека также хорошо реагирует на бактериальные полисахариды, поэтому применение пневмококковой полисахаридной вакцины обычно может индуцировать выработку антител до уровня, обеспечивающего защиту от возбудителя. Другие группы людей, особенно подверженных развитию пневмококковой пневмонии, также должны быть иммунизированы. Группы людей с повышенной восприимчивостью к инкапсулированному респираторному патогену — Streptococcus pneumoniae, а также те, у кого велик риск контакта с возбудителем (например, работники домов престарелых и медицинский персонал), тоже должны проходить вакцинацию против вируса гриппа.
Необходимые меры предосторожности
Место введения антигена
Обычным местом парентерального (внутрикожного, подкожного или внутримышечного) введения вакцины у взрослых людей является рука, в частности дельтовидная мышца. Детям вакцину обычно вводят в бедро. Исследования показали, что почти оптимальный ответ на введение вакцины против гепатита В получается при инъекции в ягодичную мышцу, а не в руку. Парентеральное введение инактивированной вакцины против полиомиелита может вызвать более сильный ответ со стороны антител в сыворотке крови, чем применение аттенуированной вакцины через рот, однако реакция на последнюю, приводящая, в том числе, к выработке секреторного IgA, также обеспечивает адекватную защиту. Применение аттенуированной вакцины против полиомиелита перорально было приостановлено, поскольку живой вирус может в исключительно редких случаях вызвать заболевание.
Некоторые вакцины способны обеспечить более высокий гуморальный ответ при введении через респираторный тракт, чем при применении в виде инъекции (например, аттенуированная вакцина против кори). Однако введение через респираторный тракт продолжают использовать только при исследованиях.
Опасности
Некоторые вакцины таят в себе опасности. Вакцины, произведенные из аттенуированных возбудителей (например, кори, свинки, краснухи, полиомиелита (для орального введения) и бацилл Кальметта-Герена), обладают потенциальной способностью вызывать прогрессирующее заболевание у пациентов с нарушенным иммунитетом или больных, подвергающихся иммуносупрессивной терапии. В редких случаях вирусы полиомиелита III типа возвращали себе вирулентные свойства в кишечнике вакцинированного индивидуума, что приводило к развитию паралитического полиомиелита. Опасения по поводу возможности развития паралитического полиомиелита при применении данной вакцины привели к тому, что для вакцинации от полиомиелита в США в настоящее время рекомендована вакцина из инактивированного вируса. Этот пример иллюстрирует необходимость неусыпного внимания при мониторинге распространенности определенного заболевания в конкретной популяции и сопоставления риска развития заболевания с риском проведения вакцинации. Хотя вакцины обычно обладают очень низкой токсичностью, их применяют у большого числа лиц; если распространенность заболевания снижена, риск вакцинации может оказаться более значительным. Отсюда возникает парадоксальная ситуация: посредством эффективной вакцины распространенность заболевания уменьшается до такого уровня, что редкие осложнения, связанные с вакцинацией, встречаются в данной популяции чаще, чем само заболевание. При таком положении опасения населения относительно вакцинации могут привести к уменьшению числа ее сторонников.
Нельзя проводить вакцинацию беременным женщинам живыми аттенуированными микроорганизмами, потому что плоду может быть нанесено повреждение. (При вакцинации от краснухи вирионы достигали плода, хотя какого-либо повреждающего воздействия не наблюдалось.) Противопоказано применять живые аттенуированные вакцины у пациентов с серьезными нарушениями иммунитета. Они могут оказаться не способными противостоять ослабленным патогенам, находящимся в вакцине. В связи с устранением возбудителя оспы вакцинация против нее не проводится (исключением являются некоторые воинские контингенты). Однако, как уже указывалось, опасения по поводу возможного применения вируса оспы в качестве биологического оружия привели к дебатам по вопросу о необходимости проведения всеобщей вакцинации. В настоящее время планируется вакцинация только тех лиц, которые потенциально могут подвергнуться биологической атаке; также обсуждается создание резерва вакцины для профилактического использования после контакта с возбудителем. Аргументом против повсеместного использования вакцины является и то, что инокуляция вируса вакцинии несет в себе серьезный риск не только для лиц с нарушениями иммунитета, но и для индивидуумов с определенными кожными поражениями. Следует избегать контакта между вакцинированными и уязвимыми для вируса лицами, пока не исчезнут повреждения, вызванные вакцинацией.
Обычными (особенно у взрослых женщин), но преходящими осложнениями после вакцинации от краснухи являются артрит и артралгия. Применение одной из инактивированных вакцин, убитой Bordetella pertussis, входящей в вакцину АДС, было связано с некоторыми серьезными побочными эффектами, такими как энцефалопатия у детей. Хотя серьезные побочные эффекты были относительно редки и преимущества вакцины от коклюша перевешивали любой предполагаемый риск иммунизации, убитая бактериальная вакцина была заменена бесклеточной, содержащей инактивированный токсин и один или более антигенных компонента (например, филаментозный гемагглютинин и фимбрии). Бесклеточная вакцина против коклюша, сохраняя эффективность, имеет гораздо меньше побочных эффектов, чем предыдущая.
Столбнячный и дифтерийный анатоксины могут вызвать местные реакции гиперчувствительности. Поскольку адекватная первичная серия иммунизаций, проведенных в детстве, вызывает иммунитет, сохраняющийся около 10 лет, использование бустерных инъекций столбнячного анатоксина должно определяться с учетом характера повреждения и сведений о проводившейся иммунизации. В связи с повышенной чувствительностью к дифтерийному анатоксину у подростков и взрослых необходимо использовать меньшие дозы анатоксина, чем при вакцинации детей. Поскольку вирус гриппа культивируется на куриных эмбрионах, аллергия на куриный белок является противопоказанием для вакцинации против данного вируса. Цельновирионная вакцина против гриппа, используемая у взрослых, дает побочные эффекты у детей, поэтому для вакцинации детей младше 13 лет рекомендуется субъединичная вакцина против вируса. Некоторые вакцины содержат консерванты, такие как ртутьсодержащее соединение — тимеросал (мертиолат), или антибиотики, такие как неомицин или стрептомицин, к которым у индивидуума может быть аллергия.
Пассивная иммунизация
Пассивная иммунизация происходит через перенос антител или иммунных клеток одному индивидууму от другого, уже непосредственно встречавшегося с антигеном и выработавшего иммунный ответ. Она отличается от активной иммунизации тем, что при ней не полагаются на способность иммунной системы организма выработать соответствующий ответ. Таким образом, пассивная иммунизация с помощью антител приводит к немедленному получению организмом антител для защиты от патогенов. Она может происходить естественным образом, как в случае передачи антител через плаценту или молозиво, так и терапевтическим, когда антитела вводят в качестве профилактики или лечебного средства от инфекционных заболеваний.
Пассивная иммунизация посредством переноса антител через плаценту
Развивающийся плод пассивно иммунизируется с помощью материнских IgG в результате переноса антител через плаценту. Эти тела есть у него в момент рождения. Они защищают новорожденного от инфекций, для которых достаточно наличия IgG и к которым у его матери имеется иммунитет. Например, передача антител к токсинам (столбнячному, дифтерийному), вирусам (кори, полиомиелита, свинки и т.д.), а также некоторым бактериям (Haemophilus influenzae или Streptococcus agalactiae группы В) может обеспечить защиту ребенку в первые месяцы жизни. Таким образом, адекватная активная иммунизация матери является простым и эффективным средством обеспечения пассивной защиты плоду и новорожденному. (Однако некоторые недоношенные новорожденные могут не получить материнских антител в той же мере, как младенцы, рожденные в срок.) Вакцинация анатоксином может вызвать ответ со стороны IgG, которые проходят через плаценту и обеспечивают защиту плоду и новорожденному. Такая защита исключительно важна в тех районах земного шара, где загрязненная окружающая среда может привести к tetanus neonatorum (тетанус у новорожденного, возникающий обычно вследствие инфицирования пуповины).
Пассивная иммунизация через молозиво
Человеческое молоко содержит ряд факторов, которые могут повлиять на ответ организма кормящегося молоком младенца на возбудителей инфекций. Некоторые из них являются естественными селективными факторами и влияют на кишечную микрофлору, а именно способствуют росту необходимых бактерий и действуют как неспецифические ингибиторы для некоторых микробов. На микрофлору также может повлиять действие:
-
лизоцима;
-
лактоферрина;
-
интерферона;
-
лейкоцитов (макрофагов, Т-клеток, В-клеток и гранулоцитов).
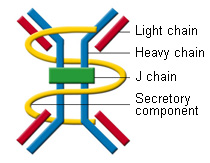
Антитела (IgA) обнаруживаются в грудном молоке, причем их концентрация выше в молозиве (первое молоко), появляющемся непосредственно после родов. Выработка антител является результатом действия В-клеток, которые стимулируются кишечными антигенами и мигрируют в молочную железу, где вырабатывают иммуноглобулины (этеромаммарная система). Таким образом, микроорганизмы, колонизирующие или инфицирующие пищеварительный тракт матери, могут приводить к выработке антител молозива, которые осуществляют защиту слизистых оболочек кормящегося материнским молоком ребенка от патогенов, поступающих через кишечный тракт. Было показано наличие антител к энтеропатогенам Escherichia coli, Salmonella typhi, штаммам Shegella, вирусам полиомиелита, Коксаки и эховирусам. Кормление новорожденных с низкой массой тела, не получающих материнское молоко, смесью IgA (73 %) и IgG (26 %), взятых из сыворотки крови человека, защищает их от некротизирующего энтероколита. В молозиве также были обнаружены антитела к непищевым патогенам, например, антитоксины к столбняку и дифтерии, а также антистрептококковому гемолизину.
Т-лимфоииты, чувствительные к туберкулину, также передаются новорожденному через молозиво, но роль таких клеток в пассивной передаче клеточно-опосредованного иммунитета неясна.
Пассивная терапия с помощью антител и сывороточная терапия
Назначение препаратов специфических антител было одним из первых методов эффективной антимикробной терапии. Антитела против определенных патогенов вырабатывают у животных, таких как лошади и кролики (гетерологичные антитела), и назначают людям в качестве сывороточной терапии для лечения различных инфекций. Сыворотка людей, излечившихся от инфекций, богата антителами; ее также можно использовать для пассивной терапии с помощью антител (гомологичные антитела). В последние годы для пассивной терапии инфекционных заболеваний с помощью антител использовали некоторые моноклональные антитела, произведенные в лаборатории. В настоящее время исследования в этой области расширились, и, похоже, в недалеком будущем возникнут новые методы лечения, основанные на применении антител.
Активным агентом при сывороточной терапии является специфическое антитело. До начала эры антибиотиков (до 1935 г.) сывороточная терапия часто была единственным доступным методом лечения инфекций. Ее использовали для лечения дифтерии, столбняка, пневмококковой пневмонии, менингококкового менингита, скарлатины и других серьезных инфекций. Например, во время Первой мировой войны для лечения раненых британских солдат применяли противостолбнячный антитоксин, который получали от лошадей. Результатом стало быстрое снижение частоты случаев возникновения столбняка. Этот опыт позволил определить минимальную концентрацию антитоксина, необходимую для обеспечения защиты, и показал, что период защиты у человека был достаточно краток. Гетерологичные лошадиные антитела у людей разводятся, подвергаются катаболизму, формируют иммунные комплексы и удаляются. Наоборот, гомологичные человеческие антитела, концентрация которых в сыворотке крови достигает максимума примерно 2 суток спустя после подкожной инъекции, разводятся, подвергаются катаболизму и достигают половины максимальной концентрации примерно через 23 суток (период полураспада человеческих IgGb, IgG2 и IgG4 — 23 сут; IgG3 — 7 сут). Таким образом, защитная концентрация человеческих антител в крови сохраняется значительно дольше лошадиных антител. Гетерологичные антитела, такие как лошадиные, способны вызывать, по крайней мере, два вида реакций гиперчувствительности:
-
I типа (немедленную, анафилаксия);
-
III типа (сывороточная болезнь от иммунных комплексов).
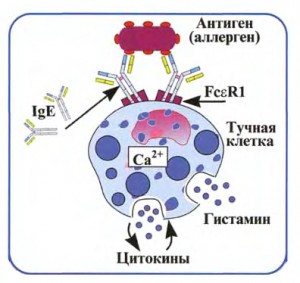
Если другое лечение недоступно, у индивидуума с I типом чувствительности можно использовать гетерологичную антисыворотку, вводя чужеродную сыворотку и постепенно увеличивая ее количество на протяжении нескольких часов. Некоторые препараты гетерологичных антител (например, лошадиный дифтерийный антитоксин и антилимфонитарную сыворотку (antilimphocyte serum — ALS)) до сих пор используют для лечения людей. За последние годы благодаря достижениям в технологии гибридом и рекомбинантных ДНК мы получили возможность синтезировать человеческие иммуноглобулины для лечения и больше не зависим от животных источников антител для лечения людей. Человеческие антитела обладают значительно более длинным периодом полураспада и пониженной токсичностью.
Моноклональные и поликлональные препараты
Технология гибридом, позволяющая производить моноклональные антитела, была открыта в 1975 г.. Поликлональные препараты получают в результате ответа со стороны антител на иммунизацию или выздоровления организма от инфекции. В целом антитела к специфическому агенту являются только небольшой фракцией всех антител в поликлональном препарате. Более того, поликлональные препараты обычно содержат антитела к многочисленным антигенам и включают антитела различных изотипов. Препараты моноклональных антител отличаются от препаратов поликлональных антител тем, что моноклональные антитела обладают одной специфичностью и одним изотипом. В результате активность препаратов моноклональных антител значительно выше по отношению к общему количеству белка, присутствующего в поликлональных препаратах. Другим преимуществом моноклональных препаратов является то, что они неизменны от партии к партии, что характерно для поликлональных препаратов, количественно и качественно зависящих от иммунного ответа, определяющего их действенность. Однако поликлональные препараты обладают преимуществом: в состав таких препаратов входят антитела различной специфичности и разных изотипов, поэтому они более разнообразны биологически. За последние 5 лет для клинического использования была лицензирована, по крайней мере, дюжина моноклональных антител. Большинство из них были разработаны для лечения рака; однако в настоящее время лицензируется моноклональное тело для использования в целях предотвращения инфекций, вызываемых респираторными синцитиальными вирусами у маленьких детей. Некоторые препараты моноклональных и поликлональных антител в настоящее время применяют для лечения людей.
Изготовление иммунного сывороточного глобулина человека и его свойства
Иммуноглобулин сыворотки человека стали применять в начале XX в. Тогда сыворотку от пациентов, излечившихся от кори, вводили контактировавшим с больными детям, симптомы у которых не успели развиться. Другие попытки применения иммуноглобулина в 1916 г. и позднее показали, что раннее применение сыворотки, полученной от людей, излечившихся от кори, может предотвратить появление клинически выраженной болезни. В 1933 г. было также обнаружено, что источником антител против кори может быть человеческая плацента. Проблемой использования сыворотки для пассивной терапии является то, что в большом ее объеме содержится относительно небольшое количество антител. В начале 1940-х гг. Р. Кох с сотрудниками открыли метод выделения фракции гаммаглобулина (у-глобулин) из человеческой сыворотки путем преципитации с помощью холодного этанола. Этот метод, названный фракционированием Коха, представляет собой легко осуществимый и безопасный способ получения гомологичных человеческих антител для клинического использования.
Плазму собирают от здоровых доноров или получают из плаценты. Плазму или сыворотку нескольких доноров собирают в пул. Полученный препарат называется иммунным сывороточным глобулином (immune serum globulin — ISG) или нормальным человеческим иммуноглобулином (human normal immunoglobulin — HNI). Если плазму или сыворотку берут у доноров, предварительно специально отобранных после иммунизации или введения бустерных доз антигена, а также у выздоровевших от определенной инфекции, специфический препарат иммуноглобулина обозначается соответствующим образом:
-
противостолбнячный иммуноглобулин (tetanus immuneglobulin — TIG);
-
иммуноглобулин против гепатита В (hepatitis В immuneglobulin — HBIG);
-
иммуноглобулин против варицеллы-зостер (вируса группы герпеса) (varicella-zoster immuneglobulin — VZIG);
-
иммуноглобулин против бешенства (rabies immuneglobulin — RIG).
Большое количество иммуноглобулина можно получить с помощью плазмафереза с последующим возвращением клеток крови донору. Фракцию, содержащую иммуноглобулины, получают посредством преципитации с помощью холодного этанола. Полученный препарат:
-
теоретически свободен от вирусов, таких как вирус гепатита и ВИЧ;
-
содержит антитела IgG, концентрация которых повышена примерно в 25 раз;
-
сохраняет стабильность в течение нескольких лет;
-
может обеспечить пиковые уровни содержания в крови приблизительно через 2 сут после внутримышечной инъекции.
Безопасные при внутривенном введении препараты (intravenous immunoglobulin — IVIG или intravenous gammaglobulin — IVGG; в русском переводе — внутривенный иммуноглобулин — ВВИГ) готовят при помощи преципитации холодным этанолом с последующей обработкой несколькими методами:
-
фракционированием с помощью полиэтиленгликоля или обмена ионами;
-
подкислением до pH 4,0-4,5;
-
воздействием пепсином или трипсином;
-
стабилизацией с помощью мальтозы, сахарозы, глюкозы или глицина.
Такая стабилизация уменьшает агрегацию глобулинов, которая может спровоцировать анафилактические реакции. В указанных внутривенных препаратах содержится IgG от 1/4 до 1/3 от количества, применяемого в препаратах для внутримышечного введения. В этих препаратах отмечаются только следы IgA и IgM.
Показания к применению иммуноглобулина
Антитела к RhD-антигену (Rhogam) вводят резус-отрицательным матерям в течение 72 ч после родов (перинатальный период) для предотвращения их иммунизации фетальными резус-положительными эритроцитами, которая может повлиять на последующие беременности. Введение Rhogam обеспечивает защиту, содействуя удалению фетальных Rh+- клеток, с которыми мать контактирует во время родов, и таким образом устраняет сенсибилизацию резус-отрицательных матерей резус-положительными антигенами. Антитоксин TIG используется для обеспечения пассивной защиты при некоторых ранениях или в случаях, когда адекватная активная иммунизация с помощью противостолбнячного анатоксина не проводилась. Больным лейкозом, которые особенно чувствительны к вирусу варицелла-зостер, а также беременным женщинам и новорожденным, контактировавшим с заболевшими или инфицированными вирусом ветряной оспы, вводится VZIG. Иммуноглобулин против цитомегаловируса человека (CMV-ВВИГ) вводится профилактически реципиентам трансплантатов почек или костного мозга. Индивидуумам, покусанным животными, у которых есть подозрение на наличие вируса бешенства, вводят RIG, одновременно осуществляя активную иммунизацию человеческой диплоидной клеточной вакциной против бешенства (человеческий RIG имеется не везде, и в некоторых районах могут потребоваться лошадиные антитела). Препарат HBIG можно вводить новорожденному, у матери которого имеются признаки заражения гепатитом В, а также медицинским работникам после случайного укола иглой для подкожного введения или индивидууму после полового контакта с больным гепатитом В. (Против гепатита В можно также использовать ISG). Иммунный глобулин против вакцинии вводится больным экземой или людям с подавленным иммунитетом, имеющим тесный контакт с теми, кто проходил вакцинацию от ветряной оспы живой аттенуированной вакциной. У таких лиц с подавленным иммунитетом аттенуированные вакцины могут вызвать прогрессирующие деструктивные заболевания.
В некоторых случаях в связи со своими противомикробными свойствами используется ВВИГ. Также его успешно применяют против инфекций, вызванных стрептококками типа В, у недоношенных детей, при хроническом менингоэнцефалите, вызванном эховирусами, и болезни Кавасаки (заболевание неясной этиологии). Внутривенное введение может снизить инфекционную заболеваемость у больных раком крови, таких как В-клеточный лимфолейкоз и множественная миелома. Постоянное введение ВВИГ оказалось полезным у детей с подавленным иммунитетом и недоношенных новорожденных. При гипогаммаглобулинемии и первичном иммунодефиците необходимо повторно вводить ISG. Терапевтическую ценность при различных аутоиммунных заболеваниях представляет и ВВИГ. Например, при иммунной идиопатической тромбоцитопенической пурпуре ВВИГ предположительно блокирует Fc-peцепторы на фагоцитарных клетках и препятствует фагоцитозу и разрушению тромбоцитов, покрытых аутоантителами. С различной степенью успеха ВВИГ использовали и при других иммунных цитопениях.
Предосторожности при иммунотерапии
Отличные от ВВИГ препараты нужно вводить внутримышечно. Внутривенное введение противопоказано в связи с возможностью анафилактической реакции. Это, по-видимому, обусловлено агрегатами иммуноглобулинов, сформировавшихся во время их разделения на фракции во время преципитации, проводимой с помощью этанола. Эти агрегаты активируют комплемент с получением анафилатоксинов (IgGb IgG2, lgG3, IgM — по классическому пути, a IgG и IgA — по альтернативному пути) или прямо перекрестно связывают Fc-рецепторы, приводя к высвобождению медиаторов воспаления. Применение безопасного для внутривенного введения ВВИГ получило широкое распространение особенно в тех случаях, когда необходимы повторные инъекции (агаммаглобулинемия).
Одним из особых противопоказаний для введения препаратов иммуноглобулина является наличие врожденного дефицита IgA. Поскольку у таких больных отсутствует IgA, они распознают его как чужеродный белок и отвечают на него производством антител, в том числе антител IgE, что может приводить к последующей анафилактической реакции. Препараты ВВИГ, содержащие только следы IgA, вызывают меньше проблем.
Колониестимулирующие факторы
Колониестимулирующие факторы (КСФ), являются цитокинами, стимулирующими развитие и созревание всех лейкоцитов. Гранулоцитарный (Г-КСФ), гранулоцитарно-макрофагальный (ГМ-КСФ) и макрофагальный (М-КСФ) колониестимулирующие факторы были клонированы с помощью технологии рекомбинантных ДНК и теперь доступны для клинического применения. Эти КСФ доказали свою пользу, ускоряя восстановление клеток костного мозга у пациентов, у которых при лечении рака или пересадке органов подавлялись миелоидные клетки. У таких пациентов истощение нейтрофилов (нейтропения) является основным фактором, предрасполагающим к развитию тяжелых инфекций. Сокращая период нейтропении, КСФ уменьшает частоту появления тяжелых инфекций у этих пациентов. Такие КСФ улучшают также функцию лейкоцитов; есть предварительная обнадеживающая информация, что эти белки могут быть полезны в процессе иммунотерапии для усиления защиты организма от различных патогенов.
Некоторые другие цитокины являются мощными активаторами иммунной системы: весьма интересно изучить, как их можно применять в качестве средства дополнительной терапии при лечении инфекционных болезней. Также мощным активатором функции макрофагов является IFNy. Было показано, что он уменьшает частоту развития тяжелых инфекций у пациентов с врожденным дисфагоцитозом (нарушение переваривания фагоцитированных бактерий ПМЯ-лейкоцитами). Интерферон-у дал обнадеживающие результаты в качестве средства дополнительной терапии при некоторых инфекциях, таких как инфекция, вызванная резистентными к лекарствам штаммами Mycobacterium tuberculosis, и редкие грибковые инфекции.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии