Заместительная почечная терапия. Показанием для начала заместительной почечной терапии является
При лечении диуретиками и при использовании методов заместительной почечной терапии процессы удаления ионов натрия и молекул воды неразрывно связаны. Диуретики способствуют выделению натрия с мочой, тогда как диализ может приводить к гипо- или гипертензии, в зависимости от его влияния на диффузию и удаление различных молекул, включая мочевину и другие электролиты.
Медленная постоянная (продолжительная) ультрафильтрация (МПУФ) приводит к удалению жидкости путем ультрафильтрации (УФ), которая вследствие эффекта Доннана минимально отличается от воды плазмы крови. УФ в результате МПУФ – это изоосмотический и изонатриемический процесс, так как концентрация натрия в удаленном ультрафильтрате связана с его концентрацией в плазме крови.
Состав ультрафильтрата, получаемого в результате постоянной (продолжительной) вено-венозной гемофильтрации (ПВВГФ), а также посредством просто гемофильтрации (ГФ), в целом идентичен составу воды плазмы крови, однако на содержание натрия в ультрафильтрате в значительной мере влияет его концентрация в замещающем растворе.
При ПВВГФ возможно удаление натрия, не связанное с изменением водного сектора. Таким образом, можно наблюдать реальные изменения общего натрия в организме. Этот эффект на натрий не может быть достигнут ни одним другим методом.
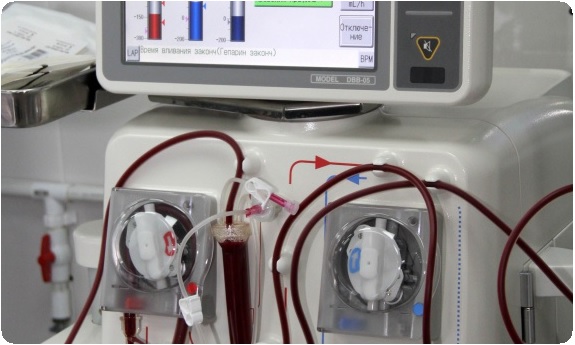
На сегодняшний день доказан эффект поддержания дозы заместительной почечной терапии по крайней мере 35 мл/кг/час – spKt/V 1,4 для ПВВГФ постоянной веновенозной гемодиафильтрации (ПВВГДФ) или ежедневного интермиттирующего гемодиализа (ИГД).
Имеются доказательства того, что при хорошей оптимизации экстракорпорального контура антикоагулянты являются относительно незначимым компонентом: фактически у пациентов с риском кровотечения (например, с удлиненным временем свертывания крови и тромбоцитопенией) заместительная почечная терапия может безопасно осуществляться без использования любых антикоагулянтов.
Исследование UNLOAD является первым рандомизированным сравнением монотерапии внутривенными диуретиками против ультрафильтрации как альтернативной терапии у пациентов с гиперволемией. Принципиальные результаты этого исследования касались пациентов с гиперволемией вследствие застойной сердечной недостаточности. Доказано, что ультрафильтрация приводит к более эффективному выведению из организма избытка жидкости по сравнению с внутривенными диуретиками в дозах, использованных в исследовании. Объем удаленной при ультрафильтрации жидкости коррелировал со значительным снижением частоты последующих госпитализаций и уменьшением их длительности, а также с меньшим количеством внеплановых посещений медицинских учреждений по поводу застойной сердечной недостаточности (ЗСН). Положительные эффекты от короткого курса ультрафильтрации, наблюдаемые в течение более 90 дней, были достигнуты без существенных побочных эффектов.
В настоящий момент стало возможным получать ультрачистый замещающий раствор непосредственно в отделениях интенсивной терапии (ОРИТ), диализные процедуры с его использованием существенно дешевле, чем постоянные методы заместительной почечной терапии, стало возможным использовать большие объемы замещающей жидкости за более короткий период. Выбор методов лечения практически не ограничен: можно выбрать 3-х или 4-х часовой интермиттирующий гемодиализ (ИГД) со стандартными параметрами или постоянные методы заместительной почечной терапии со скоростью потока эффлюента 35 мл/кг/ч. Альтернативой может быть медленный низкоэффективный ежедневный диализ (SLEDD) со скоростью потока крови и диализата 150 мл/мин, длительностью 8 ч в день или SLEDD в течение 12 ч на протяжении всего ночного периода в качестве альтернативы.
Острое почечное повреждение (ОПП) – это сложное заболевание, которое не имеет на данный момент четко сформулированного и признанного большинством определения. Заместительная почечная терапия (ЗПТ) – это основной метод в комплексном лечении синдрома ОПП. Несмотря на то, что существует множество различных стратегий экстракорпоральных методов детоксикации, конкретный стандарт ведения ОПП остается неопределенным. Доказательства преимуществ одних методов лечения над другими с точки зрения эффективности и исходов лечения отсутствуют. Наилучшее время начала и завершения ЗПТ остается спорным. В этой статье мы сделаем обзор синдрома ОПП и представим теоретические и практические основы для назначения ЗПТ с целью помочь анестезиологам и специалистам отделений реанимации и интенсивной терапии (ОРИТ) в понимании неотложной нефрологии.
Эпидемиология синдрома острого почечного повреждения (ОПП)
Последние международные многоцентровые проспективные эпидемиологические исследования ОПП проводились на пациентах ОРИТ3, которым либо проводилась заместительная почечная терапия, либо они соответствовали хотя бы одному, предварительно сформулированному, критерию ОПП – олигурия (темп диуреза менее 200 мл/12 ч) или значимая азотемия (азот мочевины крови > 30 ммоль/л). Данные были собраны из 54 госпиталей в 23 странах. Из 29 269 пациентов в критическом состоянии, поступивших в лечебное учреждение в период проведения исследования, у 1 738 (5,7%) развивалось ОПП во время нахождения в реанимации, из них 1 260 (4,3%) получали ЗПТ. Общая госпитальная летальность составила 60,3%. Наиболее частым фактором, способствовавшим развитию ОПП, являлся септический шок (47,5%). Приблизительно 30% пациентов при поступлении уже имели дисфункцию почек. При выписке из лечебного учреждения 86,2% выживших пациентов не требовали диализа. Независимыми факторами риска госпитальной летальности являлись:
-
применение вазопрессоров;
-
ИВЛ;
-
септический шок;
-
кардиогенный шок;
-
гепаторенальный синдром.
Предварительная оценка смертности показывает, что в целом госпитальная летальность пациентов с ОПП остается высокой и этот показатель не изменялся в течение последних 30 лет. Объяснением этому может служить тот факт, что 30 лет назад лечение пациентов с ОПП преимущественно производилось ОРИТ, им не требовалась или не проводилась ИВЛ и они были на 20-30 лет моложе тех пациентов, которые наблюдаются сейчас. Исходы лечения в основном оценивались ретроспективно и только в университетских центрах. Современные данные свидетельствуют о том, что происходит утяжеление контингента пациентов с ОПП, оцененное по увеличению общего балла по шкалам оценки тяжести состояния, однако увеличения летальности не наблюдается, скорее, она даже незначительно снизилась. Также значимо уменьшились продолжительность лечения с точки зрения необходимости проведения диализа, длительность пребывания в ОРИТ и длительность пребывания в больнице. Методы заместительной почечной терапии также претерпели значительные изменения. Но, несмотря на эти достижения, по предварительной оценке, 50-60% летальных исходов в стационаре связано с ОПП, что свидетельствует о том, что проводимая терапия остается неадекватной.
В современной системе здравоохранения пациентам с ОПП доступна острая заместительная почечная терапия. Было подсчитано, что количество пациентов с ОПП, нуждающихся в экстракорпоральных методах детоксикации, составляет 11 человек на 100 000 населения в год. Ежегодная летальность составляет 7,3 на 100 000 пациентов. Более высокие показатели смертности у мужчин в возрасте старше 65 лет. Восстановление функции почек происходит у 78% выживших в течение 1 года; и хотя значительное количество пациентов с тяжелым ОПП умрет, у большинства выживших в течение года отсутствует потребность в дальнейшем проведении процедур ЗПТ. Увеличивающееся число острых диализных процедур в ОРИТ привело в течение последних 10 лет к развитию новой специализированной ветви нефрологии – нефрологии критических состояний. ОПП требует междисциплинарного подхода со стороны реаниматологов и нефрологов, объединения их профессиональных компетенций. При назначении заместительной почечной терапии, определении дозы диализа, необходимой ультрафильтрации (УФ) и стратегии использования антикоагулянтов должны быть приняты во внимание баланс жидкости, дозы вазопрессоров, параметры ИВЛ и газы артериальной крови, включая коэффициент PaO2/FiO. Теоретические и технические аспекты нефрологии критических состояний также являются необходимыми компонентами обучения реаниматолога.

История заместительной почечной терапии
С момента первого описания постоянной артериовенозной гемофильтрации (ПАВГФ) в 1977 г. Peter Kramer и колл. заместительная почечная терапия постепенно вошла в отделение реанимации и интенсивной терапии и эволюционировала от «терапии отчаяния» при ОПП до обычной, широко используемой, полностью независимой формы искусственной поддержки функции почек у пациентов в критическом состоянии. В старых устройствах для ПАВГФ ток крови пациента не регулировался и зависел от спонтанного артериовенозного градиента давления. Следовательно, ультрафильтрация целиком зависела от имеющегося градиента трансмембранного давления (ТМД). Ультрафильтрация могла быть ничтожна, при низких значениях среднего артериального давления или увеличении внутреннего сопротивления экстракорпорального контура. Тем не менее, ПАВГФ обычно обеспечивала очень медленное, продолжительное удаление жидкости и стабильность концентрации растворенных веществ, вследствие чего отсутствовали пиковые концентрации продуктов метаболизма. Увеличение распространенности метода ПАВГФ привело к созданию полностью оснащенных команд специалистов, которые работали в ОРИТ независимо от отделений диализа.
Преимущество ПАВГФ заключалось в отсутствии обычных связанных с гемодиализом проблем, таких как гипотензия, быстрое перемещение жидкости между секторами, нарастающий отек мозга и быстрое уменьшение осмолярности плазмы. Однако ограничение этого метода – наличие артериального и венозного доступа одновременно.
Клиренс растворенных веществ при ПАВГФ ограничивался низким уровнем ультрафильтрации и чисто конвекционным механизмом действия этого метода. Поэтому у пациентов с низким средним артериальным давлением могут наблюдаться самые низкие клиренсы выводимых веществ и ранний тромбоз экстракорпорального контура. Максимально достижимый клиренс при ПАВГФ приблизительно равен 20 мл/мин, что явно недостаточно у тяжелых пациентов с выраженным катаболизмом.
Чтобы преодолеть эти технические ограничения, связанные с ПАВГФ, были разработаны новые фильтры с увеличенными площадью поперечного сечения и внутренним диаметром полого волокна, что позволило уменьшить их длину, для обеспечения более низкого сопротивления кровотоку.
Эти изменения привели к улучшению показателей ультрафильтрации, которые можно получить с использованием данной технологии. Также использовались устройства с параллельным расположением высоко биосовместимых мембран, имеющие низкое сопротивление току крови, обеспечивающие более высокую скорость потока крови при одинаковом артериовенозном градиенте давления. Они были оснащены вторым портом в компартменте фильтрата для осуществления противоточного диализа (постоянный артериовенозный гемодиализ – ПАВГФ), что несколько отличается от простой конвекционной фильтрации.
Однако наиболее важной инновацией было добавление в экстракорпоральный контур перистальтического насоса. Это новшество (добавление насоса в контур ПВВГФ) и создало диализную машину для ОРИТ, независимо от опыта и компетенций специалистов по диализу. Скорость потока крови сейчас программируется и обеспечивается с достаточной точностью. Новые постоянные вено-венозные процедуры требуют измерения отрицательного давления и сигналов тревоги в артериальной линии перед насосом крови, также как и измерений уровней положительного давления и сигналов тревоги в линии возврата крови. Для предотвращения воздушной эмболии стала необходима воздушная ловушка на линии возврата (она не требовалась при ПАВГФ, где положительное давление было на всем протяжении контура). Более интенсивный кровоток, создаваемый перистальтическим насосом, привел к более высоким фильтрации и клиренсам. Появилась необходимость добавить роликовый насос в линию замещающего раствора экстракорпорального контура и внешние весы для обеспечения точной оценки баланса жидкости во время лечения. Позднее стало очевидно, что идеальный экстракорпоральный контур должен иметь возможность постоянного измерения давления на входе и выходе из катетера, на входе и выходе из фильтра, в портах ультрафильтрата и диализата. Эта информация в настоящее время интегрирована с адекватными сигналами тревоги, что позволяет персоналу ОРИТ обеспечивать контроль эффективности работы фильтра и целостности экстракорпорального контура, выявлять потенциальные источники тромбоза и обеспечивать безопасность пациента.
Другими инновациями, которые помогли созданию метода ПВВГФ, как вида заместительной почечной терапии для ОРИТ, является создание стандартизованных диализных растворов для ОРИТ и двухпросветных катетеров, которые могут быть установлены в одну вену, что привело к существенному сокращению числа осложнений, связанных с установкой больших артериальных канюль.
Показания для начала и окончания заместительной почечной терапии
Не существует единого мнения по поводу показаний для начала заместительной почечной терапии. Ряд показаний, поддерживаемый многими авторами, включает азотемию, анурию и осложнения ОПП:
-
отек легких;
-
тяжелую перегрузку жидкостью;
-
гиперкалиемию;
-
декомпенсированный метаболический ацидоз.
К сожалению, когда заместительная терапия начата, не существует общепринятого биохимического или клинического маркера, на основании которого можно сделать вывод о ее достаточности. Повседневная клиническая практика предполагает «адекватный» контроль баланса жидкости и обеспечение в плазме крови концентрации мочевины ниже 5 ммоль/л, а креатинина – ниже 175 мкмоль/л, и нормальных показателей электролитного баланса.
Процедура и время отлучения пациента от ЗПТ слабо освещены в литературе. Большинство специалистов рекомендует индивидуально подходить к вопросу о потребности в проведении ЗПТ при достижении у пациентов стабильной гемодинамики или снижении потребности в вазопрессорах, или уменьшении степени тяжести состояния. Этот процесс может быть индивидуализирован с учетом увеличения темпа диуреза и способности поддерживать баланс жидкости без ЗПТ.
Методы и методики
Все виды заместительной почечной терапии основываются на очищении крови посредством прохождения метаболитов через полупроницаемую мембрану. Кровь проходит внутри полого волокна из пористого биосовместимого синтетического материала. При этом широкий спектр веществ (вода, мочевина, водорастворимые низко-, средне- и высокомолекулярные соединения), содержащихся в крови, проходит через мембрану посредством диффузии (растворенные вещества) и конвекции (вода и растворенные в ней вещества).
При наличии одного признака ЗПТ рекомендована, двух – настоятельно рекомендована, трех – обязательна веществ из области с большей концентрацией в область с меньшей концентрацией. Другими факторами, влияющими на эффективность процесса диффузии через полупроницаемую мембрану, являются площадь поверхности мембраны, температура крови и коэффициент диффузии. Диализ происходит, когда направление потока диализата противоположно направлению потока крови, что является условием максимальной эффективности диффузии, вследствие того, что концентрация удаляемых веществ в диализате ниже в сравнении с кровью.
В процессе конвекции движение растворенных веществ через полупроницаемую мембрану связано с ультрафильтрацией (перемещением воды через мембрану). Другими словами, растворитель (вода плазмы) перемещается через мембрану под действием трансмембранного давления (ТМД) путем ультрафильтрации. Вместе с водой переносятся и растворенные в ней вещества. Это происходит, если пористость мембраны позволяет им проникать через нее из крови.
Гидростатическое давление со стороны крови зависит от скорости потока крови (Qb). Чем больше скорость потока крови, тем больше трансмембранное давление. В современном оборудовании для ЗПТ ультрафильтрация контролируется с помощью насоса, который регулирует скорость ультрафильтрации. При перфузии крови мембрана волокон «загрязняется», и для поддержания постоянной скорости ультрафильтрации может потребоваться создание отрицательного давления с противоположной стороны мембраны. Молекулы, от которых кровь очищается в процессе конвекции, механически проталкиваются через мембрану, однако интенсивность этого процесса ограничивается белковым слоем, который образуется на мембране и прогрессивно увеличивается во время лечения, блокируя поры волокон при конвекционных процедурах. Образование «вторичной мембраны» на одной из сторон мембраны снижает диффузию вследствие уменьшения «эффективного» градиента концентрации на поверхности. Главную роль в удалении высокомолекулярных токсинов играет адсорбционная способность мембраны. Однако адсорбционная емкость мембраны обычно исчерпывается в течение первых часов проведения ЗПТ. Поэтому процессы диффузии и конвекции являются наиболее важными для эффективной ЗПТ.
В процессе ультрафильтрации вода плазмы крови и растворенные в ней вещества фильтруются из крови, при этом гидростатическое давление внутри фильтра падает, а онкотическое давление вследствие гемоконцентрации и увеличения гематокрита возрастает. Часть воды плазмы, которая удаляется из крови при ультрафильтрации, называется фильтрационной фракцией. Величина фильтрационной фракции должна поддерживаться в пределах от 20% до 25% для предотвращения чрезмерной гемоконцентрации внутри капилляров диализатора и достижения критической точки, когда онкотическое давление сравняется с трансмембранным (ТМД) и процесс фильтрации остановится. Наконец, замена удаленной воды плазмы замещающими электролитными растворами завершает процесс гемофильтрации (ГФ). Замещающая жидкость может добавляться после фильтра, и тогда этот процесс называется гемофильтрацией с постдилюцией. Кроме этого, инфузия замещающих растворов может производиться перед фильтром, тогда имеет место гемофильтрация с предилюцией. Хотя ГФ с постдилюцией позволяет получить клиренс по мочевине, эквивалентный количеству удаляемого фильтрата (например, 2000 мл/ч), введение замещающего раствора до фильтра обеспечивает более длительную работу мембраны и экстракорпорального контура в целом, снижая гемоконцентрацию и выраженность блокирования пор крупными белками. Традиционная гемофильтрация проводится на высокопроницаемых мембранах с площадью поверхности около 1 м2, стерилизованных паром, с точкой отсечения (cut-off) 30 кД. Разница между объемом полученной вследствие ультрафильтрации воды плазмы и объемом реинфузированного замещающего раствора дает нам чистую ультрафильтрацию (net UF), которая характеризует объем жидкости, удаленный из пациента. Объем чистой ультрафильтрации устанавливается по показаниям индивидуально для каждого пациента и может изменяться в пределах от 1 л/ч и более (например, при отеке легкого или застойной сердечной недостаточности, резистентной к диуретикам) до нуля (пациенты с сепсисом, катаболическим синдромом с повышенным уровнем креатинина). Скорость чистой ультрафильтрации при проведении диализа должна быть такой, чтобы обеспечить, как минимум, нулевой баланс жидкости в процессе диффузии и не допустить движения жидкости в кровь.
Выбор дозы и метода заместительной почечной терапии
Подобно любым другим методам лечения, использующимся в ОРИТ, диализ следует назначать в соответствующем объеме. Нефрологи оценивают адекватность проводимой заместительной терапии, измеряя эффективность удаления некоторых маркерных растворенных веществ, таких как креатинин. Такая оценка имеет два основных недостатка.
Первый – маркерное вещество не может дать и не дает представления обо всех накапливаемых при ОПН веществах из-за разности их кинетики и объема распределения. Следовательно, удаление креатинина в процессе проведения заместительной терапии не обязательно будет соответствовать удалению других субстанций. И это утверждение верно для пациентов как с ХПН, так и с ОПН. Тем не менее, несмотря на эти ограничения, значительный объем данных свидетельствует, что оценка дозы диализа по одному маркеру имеет большое клиническое значение и связана с исходами лечения.
В процессе проведения заместительной терапии клиренсы креатинина и мочевины зависят от скорости потока крови (Qb), скорости фильтрации (Qf) при гемофильтрации или скорости потока диализата (Qd) при диализе, молекулярного веса удаляемых веществ, типа и размера диализатора. Скорость потока крови (Qb) при проведении ЗПТ может изменяться и зависит, главным образом, от сосудистого доступа и технических возможностей оборудования, используемого в ОРИТ. Скорость фильтрации (Qf) при использовании конвективных технологий жестко связана со скоростью потока крови. Фильтрационная фракция (профильтровавшаяся через мембрану часть плазмы крови) не лимитируется скоростью потока диализата (Qd), но когда соотношение Qd/Qb > 0,3, диализат не полностью насыщается диффундирующими из крови субстанциями. При ультрафильтрации молекулы растворенного вещества, например, мочевина и креатинин, продавливаются через поры мембраны. Эффективность этого процесса зависит от коэффициента просеивания (SC) мембраны для фильтрующихся молекул.
Поэтому, независимо от диффузии, существует линейная зависимость клиренса (К) и скорости фильтрации (Qf), а коэффициент просеивания (SC) определяется свойствами растворенного вещества. При диффузии линейная зависимость скорости потока диализата (Qd) и скорости потока крови (Qb) теряется, когда Qd/Qb >. Проще говоря, при постоянных низкоэффективных методах ЗПТ доза диализа имеет прямую зависимость от скорости ультрафильтрации (Qf) или скорости потока диализата (Qd) и не зависит от свойств, удаляемых из крови молекул.
При постоянных методах ЗПТ в ОРИТ целью является достижение клиренса по мочевине не менее 2 л/ч. Имеются доказательства, что клиренс 35 мл/ кг/ч (т.е. 2,8 л/ч у пациента весом 70 кг) более оптимален. Оценка эффективности хронического диализа у пациентов с терминальной ХПН производится с помощью фракционного клиренса по определенному веществу, Kt/V, где К – клиренс во время процедуры диализа, t – продолжительность процедуры, V – объем распределения. Kt/V является общепринятым параметром адекватности диализа для небольших молекул и коррелирует со среднесрочной (несколько лет) выживаемостью пациентов на хроническом гемодиализе. В качестве основного маркера, определяющего дозу диализа при терминальной ХПН, обычно используют мочевину. Показатель Kt/V по мочевине должен быть не менее.
Пример: пациент массой 70 кг получает гемофильтрацию в режиме постдилюции со скоростью получения фильтрата 2,8 л/ч, с нулевым балансом жидкости, продолжительностью 20 ч в сутки. При ГФ с постдилюцией концентрация мочевины в фильтрате равна ее концентрации в плазме крови, поэтому клиренс по мочевине равен скорости ультрафильтрации. Т.е. Kurea = 47 мл/мин (2,8 л/час= 2800 мл/60 мин). Длительность процедуры (t) 1200 мин (60 мин х 20 ч). Объем распределения мочевины у данного пациента 42 000 мл (мочевина растворена во всей воде тела, которая составляет 60% от массы тела - 60% от 70 кг составляет 42л - 42 000 мл). Упрощая выражение, получаем: Kt/Vurea = 47 х 1200/42000 =.
Применение Kt/V к пациентам с ОПП не имеет убедительных доказательств. Хотя применение Kt/V в качестве параметра оценки дозы диализа у больных с ОПП теоретически интересно, но существует мнение, что из-за особенностей, свойственных ОПП, страдает точность оценки. Эти особенности включают в себя неустойчивость параметров метаболизма, неточность в определении объема распределения мочевины, высокий уровень катаболизма белков, лабильность объемов жидкостей и наличие остаточной функции почек, которая может сильно меняться в течение курса ЗПТ в ОРИТ. В дополнение к этому свой вклад в нарушение равновесия концентрации растворенных молекул в жидких средах тканей и органов могут вносить гипотензия и необходимость назначения вазопрессоров.
Эти наблюдения ярко демонстрируют имеющиеся в настоящее время несоответствия подходов и парадигм, используемых у пациентов с терминальной ХПН, и в лечении пациентов с ОПП в ОРИТ.
Они также показывают, что, в отличие от области хронического гемодиализа, только значительное увеличение дозы диализа (например, переход от выполнения диализа через день к ежедневному диализу) может действительно обеспечить «другую» по эффективности терапию ОПП. Менее радикальные изменения такие как увеличение расчетного Kt/V с 1,0 до 1,2, могут быть легко оспорены ошибкой вычислений в каждом конкретном случае и не обеспечивают необходимую дозу диализа.
Задачи терапевтического ведения больных с ОПП, которые могут быть решены или решаются изменением «дозы» ЗПТ, это не только просто контроль за концентрацией небольших водорастворимых молекул, подобных мочевине. Важное значение также имеет контроль:
-
кислотно-основного состояния;
-
тоничности;
-
уровня калия, магния, кальция, фосфатов;
-
внутрисосудистого и внесосудистых объемов жидкости;

температуры, а также расширение возможностей инфузионно-трансфузионной терапии. Примером может служить использование ЗПТ у больных с коагулопатическими кровотечениями после кардиохирургических операций или при печеночной недостаточности. ЗПТ делает возможным быстрое введение больших объемов свежезамороженной плазмы (СЗП), криопреципитата и тромбоцитов без опасности перегрузки жидкостью, т.к. за час может быть удалено от 1,0 до 1,5 л ультрафильтрата. Другой пример – пациент с правожелудочковой недостаточностью, ОПП и ОРДС, который получает протективную вентиляцию легких, но у которого наблюдаются гиперкапния и ацидоз. ЗПТ позволит круглосуточно контролировать КОС, нормализовать pH, улучшить функцию легких, правых и левых отделов сердца, обеспечивая оптимальный волемический статус, и, возможно, снизить давление в легочной артерии. Еще один пример – это использование ЗПТ для контроля уровня калия у пациентов с рабдомиолизом. Очевидно, что ЗПТ может применяться гораздо шире, чем просто как средство выведения какого-либо вещества.
Верно ли, что увеличение дозы диализа улучшает результаты лечения?
Гипотеза о том, что увеличение дозы диализа может быть полезно при лечении больных в критических состояниях, имеющих ОПП, исследовалась несколькими авторами. Brause с колл. использовали ПВВГФ и обнаружили, что более высокое значение Kt/V (0,8 по сравнению с 0,53) коррелирует с улучшением контроля за уремией и КОС. Никаких других клинически значимых результатов при этом получено не было. Исследователи клиники в Кливленде ретроспективно за 7 лет проанализировали результаты лечения 844 пациентов с ОПП, потребовавших применения постоянных методов ЗПТ или интермиттирующего ГД. Когда пациенты были разделены на группы по степени тяжести заболевания, обнаружилось, что доза диализа не имела влияния на результаты лечения у самых легких и самых тяжелых пациентов, однако у пациентов средней тяжести увеличение дозы ЗПТ увеличивало выживаемость. Значение Kt/V > 1,0 было связано с увеличением выживаемости. Но поскольку это исследование было ретроспективным, таким образом, был апостериорный уклон выбора. Поэтому достоверность этих наблюдений остается спорной.
По данным другого недавнего исследования исходы лечения улучшались при использовании ежедневного диализа по сравнению с диализом через день. Ежедневный ГД статистически значимо улучшил выживаемость (72% против 54%, P=0,01), лучше контролировал уремию, сопровождался меньшим количеством эпизодов гипотензии и привел к более быстрому разрешению ОПП. Однако это исследование тоже имело ограничения, влияющие на результаты: более тяжелые, гемодинамически нестабильные больные исключались из исследования, и им назначалась постоянная ЗПТ. Более того, у пациентов, получавших традиционный интермиттирующий (прерывистый) гемодиализ (ИГД), доза диализа была недостаточной. Наконец, выявленные различия могут быть объяснены тем, что пациенты, получавшие ИГД через день, значительно отличались по объему удаляемой жидкости и частоте связанной с ГД гипотензии, а возможно, и другими аспектами «дозирования», отличными от контроля за растворенными веществами (неадекватный или эпизодический контроль объемов). Все эти соображения наводят на мысль о том, что вопросы, связанные с дозированием прерывистого ГД, и его влияние на результаты лечения необходимо еще исследовать.
В рандомизированном контролируемом исследовании, посвященном изучению влияния на исходы различных доз постоянной ЗПТ у 425 пациентов с ОПП, выяснилось, что выживаемость пациентов, получивших ПВВГФ в дозе 35 мл/кг/ч или 45 мл/кг/ч, была выше, чем в группе пациентов с дозой ПВВГФ 25 мл/кг/ч. Однако точно повторить протокол, используемый в исследовании, мешает большое количество технических и/или клинических трудностей. Опрос, проведенный в некотором количестве отделений ОРИТ по всему миру, показал, что только единицы из них обеспечивают должную интенсивность проведения постоянной ЗПТ. Uchino c колл. установили, что средняя, не скорректированная на вес доза постоянных методов ЗПТ составляла 2000 мл/ч, а скорректированная – 20,4 мл/кг/ч. Только 11,7% пациентов получали лечение в скорректированной дозе более 35 мл/кг/ч.
В исследовании, проведенном Ronco и колл., была использована ПВВГФ с постдилюцией, в то время как в настоящее время в клинической практике применяется также постоянный вено-венозный гемодиализ (ПВВГД – CVVHD) и постоянная вено-венозная гемодиафильтрация (ПВВГДФ – CVVHDF). Кроме этого, исследование Ronco и его группы проводилось в течение 6 лет в единственном центре, не описано, как контролировалась уремия, исследование не было слепым, частота сепсиса была меньше, чем описано в литературе. Следовательно, необходимо провести подтверждающее исследование.
В другом проспективном рандомизированном исследовании, проведенном Bouman и колл., пациенты были разделены на 3 различные группы:
-
у одной использовалась ранняя высокообъемная гемофильтрация (72-96 л/сут);
-
у другой – ранняя низкообъемная гемофильтрация (24-36 л/сут);
-
у третьей – поздняя низкообъемная гемофильтрация (24-36 л/сут).
Исследователи не увидели никакой разницы в восстановлении функции почек и 28-дневной выживаемости. К сожалению, установленные дозы терапии не были стандартизованы в соответствии с массой тела, что предполагает наличие больших различий в дозе ЗПТ. Кроме того, количество пациентов в исследованных группах было мало, и частота сепсиса была ниже, чем в других популяциях пациентов с ОПП.

Недавно Saudan с колл. обобщили данные о 371 пациенте с ОПП (102 – проводилась ПВВГФ, 104 – ПВВГДФ). При ПВВГФ предписанная доза составляла 25 мл/кг/ч, при ПВВГДФ – 24 мл/кг/ч. Средняя доза диализа у пациентов в группе с ПВВГДФ составляла 18 мл/кг/ч. У пациентов, получивших ПВВГДФ, снижение уровня креатинина и мочевины в течение 48 ч после начала лечения было достоверно более выраженным по сравнению с группой пациентов, у которых использовалась только ПВВГФ (50% против 40%, P<0,009 и 46% против 38%, P<0,014, соответственно). Значения 28-дневной и 90-дневной выживаемости также были выше у пациентов в группе с ПВВГДФ. Недостатком исследования является его недостаточная мощность, а также то, что исследователи сравнивали группы с диализом и без. Тем не менее, объединенные результаты последних 4-х исследований указывают на достоверно лучшую выживаемость пациентов, получивших большую дозу диализа. Хотя эти данные на сегодняшний день не подкреплены более убедительными доказательствами, они свидетельствуют о необходимости использования ПВВГФ, ПВВГДФ в дозе минимум 35 мл/кг/ч, или ежедневного интермиттирующего гемодиализа с Kt/V не менее.
Перерывы в лечении, обусловленные необходимостью проведения хирургических операций или диагностических манипуляций, также влияют на результаты продолжительных методов ЗПТ. В проспективном наблюдательном исследовании было показано, что «стоп»-время («down time» - количество часов, на которое прерывалось активное лечение) неблагоприятно сказывается на контроле азотемии. Между длительностью перерывов в лечении и концентрацией креатинина имелась достоверная корреляционная связь (P<0,0001). По мнению авторов, для поддержания стабильной концентрации креатинина и мочевины длительность перерывов в лечении должна составлять менее 8 ч в сутки (при ультрафильтрации 2 л/ч). Например, если заданная скорость ультрафильтрации составляет 35 мл/кг/ч, то при длительности перерывов в лечении общей продолжительностью 8 ч в день, реальная скорость составит только 23 мл/кг/ч.
Evanson и колл. обнаружили другие факторы, влияющие на снижение дозы интермиттирующего (прерывистого) ГД, включающие большой вес пациента, мужской пол, низкую скорость потока крови, ограничение в назначении ГД и то, что в 70% диализов достигаемый Kt/V меньше. Ретроспективное исследование Venkataraman и колл. также показало, что благодаря всем этим факторам пациенты получают только 67% предписанной дозы постоянной ЗПТ (CRRT). Известно, что в клиническом исследовании влияния дозы ПВВГФ19 в анализ включались только те пациенты, которые получили более 85% предписанной дозы ЗПТ. Для достижения этой цели проводилась компенсация времени перерывов в при постоянной ЗПТ в ОРИТ путем увеличения скорости потока эффлюента в последующие часы. Недавно проведенное наблюдательное исследование, в котором оценивалось отношение предписанная/достигнутая доза ЗПТ, показало, что в среднем наблюдается снижение достигнутой дозы на 10,7% (р<0,05) по сравнению с предписанной. Это сокращение иногда связано с ошибками программ для расчета необходимой дозы, но чаще – с сокращением времени терапии. Поэтому, насколько это возможно, перерывы в терапии должны быть минимизированы.
Сравнение постоянных и интермиттирующих методов ЗПТ
Когда основными критериями эффективности диализа являются метаболические параметры, допустимый уровень азота мочевины (BUN - 60 мг/дл или 21 ммоль/л) у пациента весом 100 кг может быть достигнут только после нескольких дней ПВВГФ при скорости фильтрации 2 л/ч. Компьютерные модели показывают, что достичь этой цели трудно даже при интенсивных режимах интермиттирующего (прерывистого) ГД. В руководствах по лечению сепсиса и септического шока Surviving Sepsis Campaign, на основе имеющихся научных доказательств, предполагается, что постоянные методы эквивалентны прерывистым у больных с ОПП. В большом сравнительном рандомизированном исследовании 166 пациентов в критическом состоянии с ОПП лечились либо ПВВГФ, либо прерывистым ГД. Авторы обнаружили, что группа пациентов, у которых применялась ПВВГФ, независимо от рандомизации имела значительно большие значения тяжести состояния в баллах. Это частично может объяснить, почему пациенты из группы ПВВГФ имели больший показатель смертности, несмотря на лучший контроль азотемии и, вероятно, более эффективный контроль за балансами жидкостей. Vinnsoneau с колл. закончили большое проспективное рандомизированное мультицентровое исследование, проводимое в 21 ОРИТ в течение более 3,5 лет. Основной первичной точкой было исследование 60-дневной выживаемости после рандомизации 360 пациентов с ОПН либо в группу с ПВВГДФ, либо в группу с интермиттирующим ГД (ИГД) в центрах, где умеют выполнять оба эти метода. Критерии включения в группу были изменены через 8 месяцев из-за невозможности набрать достаточно пациентов. Не было отмечено никакой разницы в 28-, 60- (ПВВГДФ 33% и ИГД 32%) или 90-дневной выживаемости между этими двумя группами. Исследование было хорошо спланировано и организовано и на данный момент является лучшим примером рандомизированного контролируемого исследования, сравнивающего эффективность двух методов. Однако исследование началось 7 лет назад, а за это время произошли значительные изменения в практике применения обоих методов – ПВВГДФ и ИГД. Как было заявлено Vinnsoneau с колл., это привело к изменениям протокола в процессе проведения исследования, особенно касательно определения реальной дозы терапии, по сравнению с первоначальными «стандартизованными условиями», и адаптации этих изменений к потребностям конкретных пациентов, для обеспечения достижения поставленных целей контроля за обменом веществ. Интересно, что смертность внутри группы с ИГД снижалась в процессе набора пациентов, что отражает изменения в тактике лечения диализом – увеличение назначаемого времени диализа. Имеющийся недостаток контроля дозы в обеих группах не дает возможности сделать окончательные определяющие выводы. Как отмечено в сопутствующей редакторской статье, ответ на вопрос – какой метод лучше – зависит от поставленной задачи. Постоянная ЗПТ может иметь преимущества, когда нужно удалить избыток общей воды и растворенных в ней веществ за 24 ч лечения, и у гемодинамически нестабильных пациентов, а ИГД может обеспечить гораздо большую скорость удаления воды и растворенных веществ за 1 ч, и не требует длительной антикоагуляции или полной неподвижности пациента.

Другие исследователи пришли к аналогичным выводам. В течение последних 2-х десятилетий технические достижения в обеспечении диализной терапии значительно снизили вероятность развития во время ИГД интрадиализной гипотензии. Эти достижения включают внедрение диализных машин с контролем объемов удаляемой и вводимой жидкости, повседневное использование биосовместимых синтетических диализных мембран, применение бикарбонатного диализата и практическое обеспечение более высоких доз диализа. Schortgen и соавт. продемонстрировали, что с внедрением в клиническую практику алгоритмов, специально разработанных для увеличения гемодинамической переносимости ИГД, уменьшилась гемодинамическая нестабильность пациентов и улучшились общие результаты лечения. Рекомендации включали заполнение диализного контура изотоническим раствором, установку содержания Na в диализном растворе выше 145 ммоль/л, отмену терапии вазодилятаторами и установку температуры диализата ниже 37оС. Эти изменения смогли улучшить ИГД до уровня постоянной ЗПТ, если не лучше.
Рандомизация пациентов для назначения одного или другого вида лечения независимо от состояния может привести к получению данных, которые трудно применить в клинической практике. Около 10 лет назад проходили аналогичные жаркие дебаты по поводу стратегии ухода от ИВЛ (вентиляция с поддержкой по давлению против спонтанной вентиляции через Т-образную трубку, против постоянного положительного давления в дыхательных путях, против синхронизированной перемежающейся принудительной вентиляции). В конце концов, научное сообщество пришло к соглашению, что трудно выбрать предпочтительный режим вентиляции и что способ его применения может быть более эффективен, чем непосредственно сам режим.
В настоящее время стали доступны так называемые гибридные технологии. Они включают медленный низкоэффективный ежедневный гемодиализ (SLEDD – slow low- efficiency extended daily dialysis), постоянную ежедневную интермиттирующую ЗПТ (PDIRRT – prolonged daily intermittent renal replacement therapy), продленный ежедневный диализ (EDD – extended daily dialysis) или просто продленный диализ и зависят от вариаций режима и типа удаления растворенных веществ (конвекция или диффузия). Эти виды лечения были разработаны, чтобы предложить лучшее сочетание достоинств, как постоянной ЗПТ, так и ИГД, включая:
-
эффективное удаление веществ с минимальным нарушением их равновесия;
-
меньшую скорость ультрафильтрации с гемодинамической стабильностью;
-
оптимальное соотношение расчетной и реальной дозы терапии;
-
низкую потребность в антикоагулянтах;
-
снижение стоимости лечения;
-
эффективное использование ресурсов;
-
увеличение мобильности пациентов.
Первые отчеты об опыте применения показали, что эти гибридные подходы осуществимы и действительно обеспечивают высокие клиренсы. Одиночное кратковременное одноцентровое исследование сравнило эти гибридные методы лечения с постоянной ЗПТ и показало, что они в состоянии обеспечить приемлемую дозу и гемодинамическую стабильность. Baldwin c колл. недавно рандомизировали 16 пациентов в течении 3-х последовательных дней лечения на группу с ПВВГФ (8 пациентов) и группу с длительным ежедневным диализом с фильтрацией (EDDf) и сравнили концентрацию низкомолекулярных веществ, электролитов и КОС. После 3-х дней лечения они не нашли значительной разницы между этими двумя методами лечения по концентрации мочевины и креатинина. Все электролитные нарушения, имевшиеся на момент начала лечения, были скорректированы, за исключением 1 пациента в группе с ПВВГФ, у которого развилась гипофосфатемия (0,54 ммоль/л) в течение 72 ч. После 3-х дней лечения в группе с EDDf по сравнению с группой с ПВВГФ сохранялся незначительный, но постоянный метаболический ацидоз.
Современные технологии позволяют получать ультрачистый замещающий раствор прямо в ОРИТ с более низкой стоимостью, чем при постоянной ЗПТ, в существенно больших объемах и за более короткий промежуток времени. Выбор метода лечения стал практически безграничным, можно выбирать между 3-х или 4-часовым интермиттирующим ГД со стандартными параметрами или постоянной ЗПТ со скоростью удаления фильтрата 35 мл/кг/ч. В качестве альтернативы можно использовать SLEDD (медленный низкоэффективный ежедневный диализ) со скоростью потока крови и диализата 150 мл/ мин в течение 8 ч днем, или SLEDD в течение 12 ч ночью.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии