Влияние анестезии на организм. Влияние лекарств на печень
Все ингаляционные анестетики снижают печеночный кровоток, но десфлуран и севофлуран оказывают наименее существенное влияние на общий печеночный кровоток и доставку кислорода к печени, тогда как галотан вызывает наибольшее снижение печеночного кровотока.
Прогрессирующие заболевания печени могут нарушать элиминацию, продлевать период полужизни и усиливать клинические эффекты некоторых препаратов, включая морфин, меперидин, альфентанил, векуроний, рокуроний, мивакуриум, бензодиазепины и дексмедетомидин. Эти препараты должны использоваться с осторожностью у пациентов с циррозом печени и при терминальных стадиях других заболеваний печени; их дозировки и способ применения должны быть соответственно адаптированы.
Отклонения от нормы при исследовании ферментов печени могут быть выявлены примерно у 4% здоровых людей и у 36% психиатрических пациентов, несмотря на то, что распространенность клинически существенной дисфункции печени у данной группы лиц составляет менее 1%. Это наводит на мысль о ненужности дальнейшего дорогостоящего предоперационного исследования у пациентов, не имеющих клинических симптомов поражения печени.
Пациенты с бессимптомным увеличением уровней трансаминаз плазмы крови могут перенести оперативное вмешательство с минимальным влиянием данных показателей на периоперационный исход.
Ретроспективные данные показывают, что пациенты с острым гепатитом любой этиологии являются группой повышенного риска развития печеночной недостаточности и смерти после планового оперативного вмешательства. Таким образом, плановые операции должна быть отсрочены у таких пациентов до разрешения острой гепатоцеллюлярной дисфункции.
Пациенты с бессимптомной формой любого хронического гепатита должны быть тщательно обследованы перед плановой операцией, им должно быть уделено пристальное внимание в плане поддержания печеночного кровотока в периоперационном периоде, следует избегать применения любых гепатотоксичных препаратов или значительной гипотензии, так как эти факторы могут усугубить печеночную недостаточность и печеночную энцефалопатию.
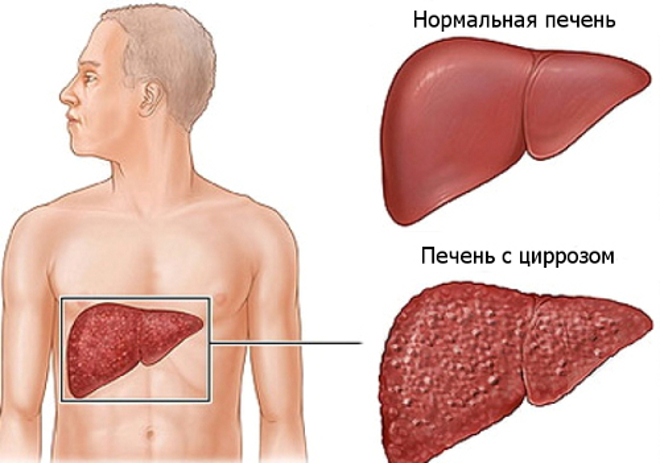
Данные больших ретроспективных исследований пациентов с циррозом печени, подвергавшихся абдоминальным оперативным вмешательствам, особенно пациентов класса C по Чайлд-Пью, говорят о возможном увеличении риска периоперационной смертности. Плановых оперативных вмешательств у этих пациентов необходимо избегать в пользу менее агрессивных лечебных процедур.
Послеоперационная желтуха может возникнуть в результате повреждения гепатобилиарной системы во время операции, которое может быть обусловлено гепатотоксическим действием анестетиков, тяжелой гипоперфузией печени, а также применением множества лекарственных средств.
Ведение пациентов с наиболее тяжелыми заболеваниями печени должно быть направлено на максимизацию печеночного кровотока и доставки кислорода к печени, а также на предотвращение и лечение возможных осложнений – печеночной энцефалопатии, отека мозга, коагулопатий, кровотечений и портальной гипертензии.
Печень – самый большой внутренний орган, она играет важнейшую роль в поддержании гомеостаза многих физиологических систем и процессов, включающих метаболизм нутриентов и лекарственных препаратов, синтез белков сыворотки и важных факторов свертывания крови, детоксикацию и элиминацию многих эндогенных и экзогенных субстанций. Острая или хроническая дисфункция печени может ухудшить ответ организма на анестезию и хирургическое вмешательство по нескольким критическим направлениям; в то же время некоторые осложнения анестезии и гемодинамические расстройства могут вызвать внезапные и серьезные нарушения послеоперационного функционирования печени.
Влияние анестетиков на функцию печени
Ингаляционные анестетики
Летучие анестетики вариабельно влияют на печеночный кровоток, тогда как внутривенные анестетики и опиоиды оказывают значительно меньшее влияние, хотя их склонность к изменению печеночного кровотока исследована значительно меньше, чем у летучих анестетиков. Более того, интерпретация результатов клинических наблюдений и результатов экспериментов ограничена множеством потенциально запутывающих показателей, которые могут влиять на печеночный кровоток и функцию печени. Например:
-
какие виды животных брали для исследований;
-
возраст подопытного;
-
состояние внутрисосудистого объема жидкости;
-
вид применяемой механической вентиляции;
-
положение тела во время измерения показателей;
-
одновременно проводимые хирургические манипуляции;
-
изменения артериального давления;
-
сопутствующее применение вазопрессоров и местных анестетиков;
-
изменения концентрации гемоглобина и артериального кислорода.
Несмотря на эти вариабельные факторы, можно получить достаточно точные заключения о вероятной клинической значимости и воздействии анестетиков на функцию печени в норме и у пациентов с циррозом печени.
Влияние ингаляционных анестетиков на печеночный кровоток, доставку кислорода, и печеночное отношение доставки/потребления были всесторонне оценены для всех основных ингаляционных анестетиков, в основном в экспериментах на крысах и свиньях. Доступные данные исследований на людях также поддерживают результаты ранних экспериментальных исследований. Для оценки печеночного и портального кровотока использовались разнообразные методики, но наиболее общепринятой является методика определения плазменного клиренса индоцианина зеленого. Чрезпищеводная эхокардиография является новым методом исследования печеночного венозного кровотока, но она может рассматриваться только как метод непрямого измерения печеночной перфузии и оксигенации. Новые методики с применением импульсных допплеровских датчиков, имплантируемых у животных и у людей во время холецистэктомии, позволяют более точно измерять артериальный печеночный и венозный портальный кровоток. Большинство анестетиков снижают портальный печеночный кровоток вследствие снижения сердечного выброса, однако артериальный печеночный кровоток может увеличиваться, хотя часто это бывает недостаточным для восстановления общего печеночного кровотока до нормальных значений. ОПК равен сумме АПК и ППК. В большинстве исследований были получены согласующиеся данные о том, что снижение среднего артериального давления и умеренное снижение сердечного выброса отмечаются при применении всех ингаляционных анестетиков, но наиболее выраженное уменьшение ППК, АПК и ОПК происходит на фоне применения галотана и энфлурана по сравнению с изофлураном и севофлураном. Эти изменения, в основном наблюдаются в пределах минимальных альвеолярных концентраций анестетиков. Ингаляционные анестетики также изменяют портальное венозное и печеночное артериальное сосудистое сопротивление в разной степени, находящейся во взаимосвязи со снижением сердечного выброса, среднего АД и мезентериальной симпатической активности, которые в сумме определяют параметры сосудистой доставки печени.
Несмотря на то, что все современные летучие анестетики снижают среднее АД и портальный печеночный кровоток, галотан обладает наиболее выраженным влиянием на артериальный печеночный кровоток. Галотан вызывает вазоконстрикцию печеночного артериального сосудистого русла, что отражается в увеличении печеночного артериального сопротивления. Видеомикроскопия in vivo после применения галотана на крысах демонстрирует сниженный синусоидальный кровоток, как результат уменьшения диаметра синусоидальных сосудов, что напрямую доказывает вазоконстрикцию на уровне микроциркуляторного русла. Напротив, изофлуран увеличивает скорость потока крови в печеночных синусоидах и, таким образом, сохраняет микроциркуляторный кровоток в большей степени, чем галотан или энфлуран. Примечательно, что Benumof и соавт. показали значительное снижение АПК после применения галотана у двух пациентов во время артериографии печени; при этом печеночный кровоток вернулся к норме через 20 мин после прекращения галотановой анестезии.
Галотан также уменьшает доставку кислорода к печени и печеночную венозную сатурацию кислорода. Эти изменения связаны со снижением среднего АД и более выраженным уменьшением сердечного выброса на фоне применения галотана по сравнению с другими летучими анестетиками. Gelman и соавт. в исследовании на свиньях показали, что при хирургическом стрессе анестезия на основе фентанила или изофлурана, снижающая артериальное давление менее чем на 30%, обеспечивает адекватную доставку кислорода к печени, тогда как анестезия на основе галотана, снижающая артериальное давление более чем на 30%, приводит к неадекватной доставке кислорода. Эти данные также применимы к эпизодам ишемии печени, когда фентанил или изофлуран обеспечивали лучшую защиту, чем галотан или энфлуран. Галотан в сравнении с изофлураном, кроме сосудистых эффектов, оказывает неблагоприятное влияние на функцию печени по данным измерения уровня трансаминаз плазмы крови.
Вызванные ингаляционными анестетиками изменения печеночного кровотока частично опосредованы механизмами ауторегуляции, обеспечивающими постоянный общий печеночный кровоток. Эта физиологическая адаптация называется печеночным артериальным буферным ответом, который уравнивает снижение портального кровотока компенсаторным увеличением артериального кровотока для поддержания постоянного общего кровотока в печени при выраженной гиповолемии, опосредованных эффектах при больших абдоминальных операциях или массивной кровопотере. Галотан, по-видимому, нарушает эту компенсаторную реакцию, тогда как севофлуран и изофлуран поддерживают HABR. Севофлуран даже подавляет печеночную артериальную вазоконстрикцию и поэтому поддерживает HABR более эффективно, чем галотан. Севофлуран эквивалентен изофлурану или даже лучше него в плане поддержания АПК, печеночной доставки О2 и соотношения доставки/потребления О2. Кроме того, лабораторные исследования показали незначительные изменения результатов обычных печеночных проб после применения изофлурана или десфлурана.
Обнадеживающие результаты, полученные при применении изофлурана в сравнении с более старыми ингаляционными анестетиками, были поддержаны наблюдением, что компаунд А, образующийся при длительной низкопоточной анестезии севофлураном, не ухудшает функции печени у взрослых хирургических пациентов по данным печеночных проб или измерения артериальных кетоновых тел, предполагаемых маркеров функции гепатоцитов. В самом большом клиническом исследовании севофлурана Bito и колл. указали на умеренное послеоперационное увеличение показателей билирубина и трансаминаз у 100 хирургических пациентов, получавших низко- и высокопоточную анестезию на основе севофлурана или изофлурана, без признаков клинической гепатотоксичности. Примечательно, что результаты рутинных печеночных тестов часто бывают слегка повышены после операций или после анестезии с применением различных ингаляционных анестетиков, хотя специфический вклад в это явление самих ингаляционных анестетиков продолжает оставаться предметом дискуссий.
Назначение севофлурана, или десфлурана, добровольцам, не подвергающимся операциям, не вызвало значимых нарушений при оценке печеночных проб, позволяя предположить, что вызвать умеренные преходящие изменения уровня плазменных трансаминаз могут другие периоперационные хирургические факторы. Действительно, ранние исследования на людях обнаружили резкое падение расчетного печеночного кровотока немедленно после индукции анестезии, что коррелировало со снижением артериального давления; печеночный кровоток быстро возвращался в норму вскоре после начала операции, позволяя считать, что глобальное снижение сердечного выброса и артериального давления являются более значимыми механизмами снижения печеночного кровотока, чем негативное влияние специфического ингаляционного или внутривенного анестетика на печеночный кровоток.
Десфлуран действует на печеночный кровоток и функцию печени подобно изофлурану, это было оценено в исследованиях на животных и людях. В хроническом эксперименте на собаках Merin и соавт. показали небольшое, но значимое снижение ОПК при МАК, как результат снижения ППК, но без значимых различий между десфлураном и изофлураном при любых измерениях печеночного кровотока в пределах МАК. В опытах на свиньях Armbruster и колл. наблюдали снижение ОПК при 1 МАК десфлурана, но только при клинически незначимой гипотензии и без изменений печеночных проб. Другие исследования на собаках говорят о лучшей сохранности ОПК на фоне десфлурана по сравнению с галотаном или изофлураном. Более поздние исследования на добровольцах, оценивавшие скорее функцию печени, чем печеночный кровоток, оказались неспособны показать какую-либо гепатотоксичность десфлурана.
В противоположность информации, касающейся здоровых добровольцев и хирургических пациентов, доступно гораздо меньше информации, описывающей влияние анестетиков на функцию печени у пациентов с прогрессирующими заболеваниями печени. Ограниченные данные показывают, что десфлуран и изофлуран не изменяют результаты периоперационных печеночных проб у взрослых хирургических пациентов с хроническими заболеваниями печени. Вероятно, изофлуран более эффективен по сравнению с кетамином или галотаном в сохранении печеночного кровотока у животных с циррозом, хотя другие исследования не показали различий в функции печени у крыс с циррозом при применении фентанила, галотана, энфлурана или изофлурана. Однако, учитывая менее благоприятное влияние галотана на печеночный кровоток и печеночную функцию, следует избегать его применения у больных с заболеваниями печени. С учетом доступности подходящих альтернативных летучих анестетиков и повсеместного уменьшения использования галотана, эта рекомендация имеет преимущественно исторический интерес. Более того, вследствие потенциальной гепатотоксичности галотана, множество авторитетных специалистов сейчас считают неоправданным применение галотана у здоровых взрослых пациентов и у любых пациентов со значимой печеночной дисфункцией.

В связи с этим при выборе новейших ингаляционных анестетиков следует обратить внимание на отсутствие у них гепатотоксичности. Инертный газ ксенон, анестетические свойства которого впервые были описаны в 1951 г, считается идеальным ингаляционным анестетиком вследствие отсутствия взрыво- и пожароопасности, низкой токсичности, отсутствия известных тератогенных свойств, возможности быстрой индукции в анестезию и восстановления за счет чрезвычайно низкого коэффициента растворимости кровь-газ, наименьшего из всех известных анестетиков. Он не оказывает значимого влияния на функцию левого желудочка, системное сосудистое сопротивление и системное артериальное давление. Его гемодинамический профиль у людей подобен пропофоловой анестезии и отличается меньшей гипотензией, и отсутствием влияния на функцию левого желудочка по сравнению с изофлураном в исследованиях на людях. Хотя исследования на животных говорят о значительном увеличении церебральной перфузии на фоне ксенона по сравнению с внутривенными анестетиками, у него, по-видимому, нет влияния на региональную перфузию других органов, включая перфузию печени. Он не изменяет артериальный печеночный кровоток, и, не влияя на сердечный выброс, он теоретически не должен влиять на общий печеночный кровоток. Он также не изменяет результаты печеночных проб. В эксперименте Reinelt и соавт. указали на повышенный уровень печеночного венозного содержания кислорода у свиней на фоне дыхания 73-78% ксеноном в сравнении с внутривенной анестезией на основе пентобарбитала и бупренорфина. Их наблюдения были сочтены второстепенными по отношению к возможному снижению уровня катехоламинов в плазме, с последующим снижением интенсивности метаболизма в печени и увеличением печеночного венозного содержания кислорода. Поэтому ксенон можно считать идеальным анестетиком в отношении перфузии печени. Для окончательного решения вопроса о безопасности ксенона у больных с острыми и хроническими заболеваниями печени требуются большие клинические исследования у пациентов с нормальной и измененной функцией печени. К сожалению, такие исследования с ксеноном маловероятны.
Таким образом, влияние ингаляционных анестетиков на печеночный кровоток и функцию является сложным и зависит не только от свойств анестетиков как таковых, но и от особенностей, связанных с самим пациентом:
-
тяжести имеющейся дисфункции печени;
-
пожилого возраста;
-
влияния хирургического стресса;
-
интраабдоминальных манипуляций хирургов.
Однако севофлуран, десфлуран и изофлуран лучше сохраняют печеночный кровоток и функции печени, чем галотан и энфлуран. Необходимы обширные проспективные исследования для лучшего определения влияния новых ингаляционных анестетиков на печеночный кровоток у пациентов с заболеваниями печени.
Ранние исследования предполагали, что этомидат и тиопентал уменьшают печеночный кровоток за счет увеличения печеночного сосудистого сопротивления или за счет снижения сердечного выброса и артериального давления, тогда как кетамин оказывает небольшое воздействие на печеночный кровоток даже в больших дозах. Определяя органный кровоток у животных с применением методики чувствительных меченных радиоизотопами микросфер, исследователи обнаружили, что пропофол увеличивает ОПК за счет и артериального, и портального компонента, что позволяет предположить значимый спланхнический вазодилятирующий эффект пропофола. В некоторых экспериментах на животных ОПК сохранялся даже при значительном снижении среднего АД, в других – средний печеночный кровоток снижался вопреки увеличению среднего АД, эти находки приписывались специфичному для пропофола влиянию на экспериментальных животных. Пропофол, вероятно, обеспечивает более благоприятный баланс между спланхнической и печеночной доставкой кислорода, чем галотан. Опираясь на данные ограниченного числа клинических и экспериментальных исследований, можно сказать, что внутривенные анестетики оказывают небольшое влияние на печеночный кровоток и не имеют значимого неблагоприятного влияния на послеоперационную функцию печени, при условии адекватного поддержания артериального давления.
Ранние исследования на людях, проведенные Kennedy и колл, показали, что печеночный кровоток снижается во время высокой спинальной и эпидуральной анестезии и, видимо, отражает уменьшение системного артериального давления. Данные, полученные на животных, позволяют предположить, что уменьшение портального кровотока при неизменном артериальном при высоком эпидуральном блоке обусловливали снижение общего печеночного кровотока. Эти неблагоприятные изменения могут быть реверсированы, и печеночный кровоток может поддерживаться назначением вазопрессорных препаратов для восстановления портального кровотока или введением жидкости для поддержания нормального артериального давления. Вероятно, вызванное гипотензией уменьшение печеночного кровотока вторично по отношению к снижению спланхнического кровотока и, соответственно, уменьшению портального кровотока. В недавнем исследовании на свиньях Vagts и соавт. не обнаружили изменений печеночной доставки и потребления кислорода в условиях торакальной эпидуральной анестезии бупивакаином, несмотря на снижение АПК. В этом исследовании назначение внутривенной инфузии до начала торакальной эпидуральной анестезии не оказывало влияния на ОПК.
Напротив, на метаболизм препаратов с низкой биодоступностью, таких как бензодиазепины, влияет преимущественно степень их связывания с белками – несвязанный препарат доступен для элиминации через механизмы внутрипеченочного клиренса и метаболические реакции, возможности которых уменьшаются пропорционально тяжести гепатоцеллюлярной дисфункции. Однако увеличение свободной фракции препарата из-за снижения уровня белков плазмы крови может действовать противоположно снижению печеночного метаболизма и приводить к умеренным изменениям окончательного эффекта препарата. В результате увеличение свободной фракции препарата из-за снижения связанной с белками фракции может привести к большему депонированию препарата в тканях, что в совокупности со снижением печеночного метаболизма может увеличить время полувыведения препарата в организме. Очевидно, что фармакокинетика лекарственных веществ при наличии прогрессирующего заболевания печени весьма сложна.
Влияние дисфункции печени и заболеваний гепатобилиарной системы на фармакокинетику анестетиков
Заболевания печени могут оказывать значительное влияние на фармакокинетику и метаболизм препаратов в результате изменения их связывания с белками, изменения объема распределения препаратов при асците и увеличении общего количества воды в организме и в результате снижения интенсивности метаболизма из-за дисфункции гепатоцитов. Кроме того, седативные средства и опиаты могут оказывать значительно усиленный эффект у пациентов с прогрессирующими заболеваниями печени, а также вызвать или ухудшить печеночную энцефалопатию. Индуцирующее воздействие хронического употребления алкоголя на ферменты печени также может влиять на итоговый эффект препаратов у пациентов с циррозом печени.
Воздействие заболеваний печени на распределение и метаболизм препарата зависит не только от путей элиминации для данного препарата, но и от тяжести имеющейся печеночной дисфункции. Эффективность элиминации препарата печенью определяется несколькими факторами, включающими печеночный кровоток, активность и эффективность ферментов печени, степень связывания препарата с белками плазмы крови, индуцированные холестазом изменения в энтеральном, печеночном кровотоке и метаболизме перорально употребляемых препаратов, а также присутствие портокавальных шунтов, которые позволяют определенным препаратам миновать этап элиминации при заболеваниях печени. Кроме того, отличается влияние заболеваний печени на элиминацию парентерально и энтерально вводимых препаратов. В целом, тяжелые заболевания печени предсказуемо изменяют метаболизм препаратов с большими коэффициентами биодоступности, например, лидокаина и меперидина, клиренс которых, прежде всего, зависит от печеночного кровотока и выраженности портокавального шунтирования крови.
Опиоиды
Значительное снижение интенсивности метаболизма морфина у пациентов с прогрессирующим циррозом печени приводит к увеличению его периода полувыведения, заметному увеличению биодоступности морфина при его пероральном приеме, уменьшению его связанности с белками плазмы крови и тем самым потенциально усиливает его седативный эффект и степень угнетения дыхания. Несмотря на то, что внепеченочный метаболизм может способствовать клиренсу морфина у пациентов с циррозом печени, интервал его введения у таких пациентов должен быть увеличен в 2 раза, а доза препарата уменьшена в связи с увеличением биодоступности. Подобные изменения характерны и для меперидина, для которого наблюдается снижение клиренса на 50% и удвоение периода полувыведения. Кроме того, клиренс нормеперидина снижается, и пациенты с тяжелыми заболеваниями печени могут испытывать эффекты нейротоксичности данного метаболита.

В отличие от этих препаратов, фентанил – высоколипофильный синтетический опиоид короткого действия при однократном внутривенном болюсном введении, что связано с его быстрым перераспределением в тканевые депо. При повторном введении иди продленной инфузии может произойти кумуляция и пролонгирование его эффекта. Поскольку фентанил практически полностью метаболизируется в печени, время его элиминации предсказуемо увеличивается у пациентов с прогрессирующими заболеваниями печени. Однако элиминация фентанила не столь заметно изменена у пациентов с циррозом печени. Пока неизвестно, связана ли эта фармакокинетическая особенность с умеренностью поражения печени у исследуемых пациентов, или с тем, что повторное введение или непрерывная инфузия фентанила оказывали более выраженный и продленный эффект.
Суфентанил – более мощный, но подобный фентанилу синтетический липофильный опиоид, который также усиленно метаболизируется печенью и обладает высокой связываемостью с белками плазмы крови. Его фармакокинетика у пациентов с циррозом печени при однократном введении изменена незначительно, но его действие при непрерывной инфузии и снижении степени связанности с белками изучено плохо, это же относится и к фентанилу. Альфентанил – опиоид короткого действия, менее мощный, чем фентанил, также метаболизируется преимущественно печенью и обладает высокой связываемостью с белками плазмы крови. Однако, в отличие от фентанила и суфентанила, его период полувыведения практически удваивается у пациентов с циррозом печени, и отмечается большее количество свободной фракции препарата, что потенциально может привести к пролонгированию и усилению эффекта. Ремифентанил – синтетический опиоид с эфирной структурой, подвергающийся быстрому гидролизу тканевыми и плазменными эстеразами, что обуславливает высокий клиренс, быструю элиминацию и быстрое прекращение эффекта, практически независимо от дозы и продолжительности введения. Очевидно, что его клиренс не должен изменяться при дисфункции печени, и доступные данные показывают, что элиминация ремифентанила действительно неизменна у пациентов с тяжелыми заболеваниями печени и у пациентов, которые подвергаются трансплантации печени.
Седативные препараты/гипнотики
Тиопентал обладает небольшим коэффициентом доступности при прохождении через печень, поэтому интенсивность его метаболизма и клиренс значительно снижаются у пациентов с заболеваниями печени. Однако период полувыведения тиопентала неизменен у пациентов с циррозом печени, возможно, из-за большого объема распределения. Таким образом, более длительный эффект от стандартных доз тиопентала у данной группы пациентов кажется маловероятным. Напротив, другие внутривенные анестетики, такие как метогекситал, кетамин, этомидат и пропофол, являются чрезвычайно липофильными, активно метаболизируются печенью и имеют большой коэффициент доступности при прохождении через печень; их клиренс должен ощутимо снижаться при наличии прогрессирующего заболевания печени. Несмотря на такой фармакокинетический профиль, клиренс этомидата не изменяется при циррозе печени, хотя увеличение объема распределения может продлить период полужизни и продлить эффект на неопределенное время. Для мето- гекситала и пропофола при циррозе печени также характерен фармакокинетический профиль, подобный таковому у здоровых индивидуумов, как при единственном болюсе пропофола, так и при длительной его инфузии. Однако среднее время клинического восстановления после прекращения инфузии пропофола может быть более длительным у пациентов с циррозом. Снижение клиренса мидазолама у пациентов с заболеваниями печени терминальной стадии приводит к увеличению его периода полувыведения. В связи со снижением связанной с белками фракции мидазолама и увеличением его свободной фракции является ожидаемым увеличение длительности действия и усиление седативного эффекта у пациентов с тяжелыми заболеваниями печени, особенно при многократном введении или продленной инфузии. Подобные изменения также характерны для диазепама.
Дексмедетомидин, а2-адреномиметик с седативными и аналгетическими свойствами, метаболизируется преимущественно в печени, его почечный клиренс минимален. В целом, у пациентов с печеночной недостаточностью различной тяжести наблюдается снижение его клиренса, удлинение периода полувыведения и более низкие показатели биспектрального индекса, чем у пациентов с нормальной функцией печени. Поэтому необходима коррекция дозы дексмедетомидина при его использовании у пациентов с существенной печеночной дисфункцией. Частичным доказательством этому являются результаты использования дексмедетомидина у людей с дисфункцией почек, где длительная седация, имевшая место вопреки неизмененной фармакокинетике, была приписана изменению его связанности с белками – что также актуально и для пациентов с дисфункцией печени.
Итак, несмотря на существенную роль печеночного метаболизма в биотрансформации большинства внутривенных анестетиков, цирроз печени оказывает минимальное влияние на фармакокинетический профиль седативных препаратов и гипнотиков. Исходя из того, что клинический эффект и продолжительность действия бензодиазепинов более выражены при наличии тяжелого заболевания печени, эти препараты должны использоваться с осторожностью, особенно при многократном введении или в виде продленной инфузии, как в операционной, так и в отделении интенсивной терапии, поскольку может ожидаться кумуляция препарата, пролонгирование эффекта и увеличение риска печеночной энцефалопатии.
Миорелаксанты
В отличие от скудных фармакокинетических данных, касающихся опиатов и внутривенных анестетиков, доступна более полная информация относительно воздействия цирроза печени на фармакокинетику и фармакодинамику миорелаксантов. Векуроний – стероидный миорелаксант, подвергающийся элиминации в печени,; при применении у пациентов с циррозом печени наблюдается снижение клиренса, удлинение периода полувыведения и продление нейромышечного блока , Воздействие алкогольного поражения печени менее выражено, клиренс и период полувыведения, как правило, не изменяются. Рокуроний, другой стероидный миорелаксант с более быстрым началом действия по сравнению с векуронием, также подвергается печеночному метаболизму и элиминации. Дисфункция печени может увеличить объем распределения рокурония, продлевая, таким образом, его период полужизни в организме и удлиняя время клинического восстановления и возвращения нормальной мышечной силы. Gao и соавт. отмечают снижение требуемой дозы рокурония на 24% у 17 пациентов во время ангепатической фазы пересадки печени. Несмотря на то, что заболевания печени не влияют на начальное клиническое восстановление нейромышечной активности, большие дозы рокурония или его повторное введение, как правило, характеризуются пролонгированным эффектом при наличии значимой печеночной дисфункции.
Увеличение объема распределения некоторых препаратов, наблюдаемое при циррозе, может также продлить период полувыведения панкурония. У пациентов с заболеваниями печени терминальной стадии при использовании миорелаксантов, которые подвергаются органонезависимой элиминации, таких как атракурий и цисатракурий, период их полувыведения и продолжительность действия подобны таковым в норме. Лауданозин, метаболит атракурия и цисатракурия, элиминируется преимущественно через печень, но, несмотря на то, что его концентрация может увеличиваться у пациентов, подвергающихся трансплантации печени, о клинически значимой нейротоксичности не сообщалось. Однако уникальная элиминация мивакурия холинестеразой плазмы крови изменена при циррозе печени.
Использование мивакурия будет также обсуждено здесь, несмотря на то, что этот препарат недоступен в некоторых странах, характеризуется более долгим восстановлением нейромышечной активности, имеет более длительный период полувыведения и оказывает более длительный эффект у пациентов с печеночной недостаточностью, тесно коррелирующий со снижением активности холинестеразы плазмы крови у пациентов с циррозом. Это может быть связано со снижением плазменного клиренса двух активных изомеров мивакурия – цис-транс и транс-транс изомера. Частота и скорость введения мивакурия должна быть соответственно адаптирована у пациентов с прогрессирующими заболеваниями печени. Изменения, характерные для мивакурия, ожидаемы и при использовании сукцинилхолина в связи со снижением активности холинестеразы плазмы крови при прогрессирующих заболеваниях печени. Снижение уровня холинестеразы характерно для таких пациентов, и эффект сукцинилхолина может быть пролонгирован.
В общем, цирроз печени и другие прогрессирующие заболевания печени, очевидно, замедляют элиминацию векурония, рокурония и мивакурия, продлевая тем самым нейромышечный блок, особенно при многократном введении или длительной инфузии. Атракурий и цисатракурий элиминируются независимо от печени и могут использоваться без изменения дозировок у пациентов с заболеваниями печени даже в терминальных стадиях.
Анестезиологическая литература переполнена детальными предписаниями, касающимися предоперационной оценки сердечного риска при некардиальной хирургии. Предоперационные факторы риска, касающиеся почек, также освещены. Однако предоперационная оценка факторов риска развития послеоперационной печеночной дисфункции или недостаточности при операциях, не затрагивающих гепатобилиарную систему, не была достаточно освещена, и фактически анестезиологи все это время вели пациентов с предоперационной печеночной дисфункцией, основываясь на данных, полученных 40-50 лет назад. К сожалению, проспективных исследований, нацеленных на данную проблему, недостает даже в современную эру новых анестезиологических и хирургических методик. При оценке факторов риска послеоперационной печеночной недосточности необходимо учитывать:
-
бессимптомное предоперационное повышение результатов печеночных проб;
-
наличие острого гепатита;
-
стеатоза;
-
хронического гепатита;
-
цирроза печени;
-
виды хирургического вмешательства, которые потенциально предрасполагают к послеоперационной дисфункции печени.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания










Комментарии