Уход за дентальными имплантатами: этапы, последовательность
Условием успешной установки эндостального дентального имплантата является внутрислизистая герметизация мягких тканей у поверхности имплантата. Неудача в достижении или поддержании этой герметизации приводит к апикальной миграции эпителия в зону контакта «кость-имплантат», что может привести к полной инкапсуляции эндостальной или корневой части имплантата.
Внутрислизистая или внутридесневая область
В естественных зубах соединительный эпителий обеспечивает герметизацию у основания борозды, которая препятствует пенетрации в нее химических или бактериальных веществ. Если герметизация нарушена или волокна с апикальной стороны эпителия растворены или разрушены, эпителий быстро мигрирует в направлении верхушки, формируя карман с образованием трещины мягкой ткани у поверхности корня. Поскольку на поверхности эндостального имплантата нет цемента или прикрепленных волокон, десневая герметизация является важной. Если она потеряна, пародонтальный карман простирается до костных структур.
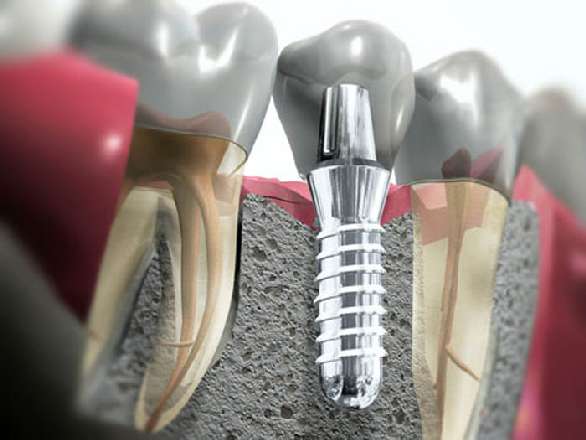
Gould и соавт. сообщили, что эпителиальные клетки прикрепляются к поверхности титана во многом так же, как к поверхности естественного зуба, т.е. посредством базальной мембраны и гемидесмосом. Schroeder и соавт. наблюдали, что если штифт имплантата находился в области неподвижной кератинизированной слизистой, то признаки адгезии эпителиальных клеток к поверхности с титановым напылением были очевидны. Wennstrom и Wennstrom и Lindhe, в отличие от Schroeder, утверждали, что отсутствие кератинизированной десны необязательно является неблагоприятной ситуацией и что подвижная слизистая вокруг шейки имплантата, если ее сохранять, может обеспечить успех. Чтобы подтвердить это предположение, Wennstrom ссылается на данные проспективных и ретроспективных исследований Adell и соавт., которые свидетельствуют о присутствии прикрепленной, кератинизированной десны на щечной и язычной поверхностях челюстей в 67 и 51 % случаев соответственно при выживаемости имплантатов верхней и нижней челюстей в течение 5-12-летнего периода 84 и 93% соответственно. На основании этих данных Wennstrom предложил теорию, что кератинизированная десна, хотя ее присутствие и желательно, не является крайне важной для поддержания десневой герметизации. Однако клинический опыт автора говорит, что имплантаты, протезы и супраструктуры имеют отличные от нормальных десневые/зубные контуры и взаимосвязи и создают ситуацию, которая требует специальных, детализированных инструкций и особого внимания к домашнему уходу. Кроме того, пациенты, рассматривающие себя в качестве возможных кандидатов на установку имплантатов, не являются лицами, осуществляющими оптимальный домашний уход в прошлом, так как у них потеряна часть или все зубы и наличие у них знаний об адекватной гигиене полости рта сомнительно. Jansen оспорил данные Gould и сообщил, что гемидесмосомальноподобные контакты наблюдались только на покрытых апатитом и полистиреновых поверхностях, но никогда на металлических или углеродных. Он понимал, что его результаты могут отличаться от данных Gould из-за отличий в клеточной популяции, условиях выращивания культуры клеток или обработки титана. В любом случае не существует никакой биологической герметизации или прикрепления мягких тканей к поверхности имплантата, и их адаптация к поверхности имплантата в десневой области является в большей степени результатом тонуса и максимального сближения ткани, чем соединительного эпителиального прикрепления.
Исследования, проведенные в течение 4-месячного периода на собаках, продемонстрировали образование трещин мягких тканей с глубокой эпителиальной инвагинацией, если ткань сближали с гладкой титановой поверхностью. При конечном анализе, если десневая герметизация разрушалась или не присутствовала, существовал карман, и в этой области развивалось заболевание пародонта, приводящее к образованию костных дефектов.

Чтобы облегчить процедуры домашнего ухода, шейка имплантата должна быть гладкой, а не пористой. De Porter и соавт. устанавливали собакам имплантаты из сплава Ti-6Al-4V с порами размером 50-200 мкм. Они были пористыми не только в корневой части, но также и в десневой. Исследования прекратили преждевременно из-за выраженной потери кости и выпадения имплантатов. Klawitter и соавт. установили собакам 44 пористых алюминиевых имплантата. Через 6 мес. только 2 из 44 имплантатов все еще были на месте. Остальные повыпадали вследствие выраженного воспаления и потери кости. Hottel и Gibbons сообщили, что пористость поверхности предрасполагает к образованию вокруг имплантата толстой фиброзной капсулы, а плотная поверхность имплантата более благоприятно влияет на десневую герметизацию в области контакта. Все авторы пришли к заключению, что шероховатая поверхность десневой области исключительно вредна для здоровья тканей.
Барьерные материалы обращают на себя внимание в исследованиях по направленной регенерации ткани. Такие вещества, как нерезорбируемые мембраны или резорбируемые коллагеновые материалы помещают между хирургическим лоскутом ткани и поверхностью имплантата, чтобы исключить апикальную пролиферацию эпителия и присутствие элементов десневой соединительной ткани на поверхности субстрата. Концепция, определяющая направленную регенерацию ткани, состоит в устранении быстро регенерирующих тканей (эпителия или соединительной ткани) с помощью барьера. Это обеспечивает дифференциацию плюрипотенциальных клеток и их миграцию из пародонтальной связки и лунки в дефект. Это, в частности, применимо к потрескавшейся поверхности имплантата, при наличии которой хирургическая установка эндостального имплантата может привести к фациальным и лингвальным костным дегисценциям. Группа исследователей сообщила о закрытии обнаженных витков резьбы эндостальных имплантатов вновь образованной костной тканью через 6-15 мес. у кроликов. Другие специалисты показали рост новой костной ткани вокруг треснувших имплантатов с гидроксиапатитным покрытием у собак через 4 нед.. В двух этих исследованиях использовали нерезорбируемые тефлоновые материалы. Проводятся исследования различных резорбируемых барьерных материалов и разных комбинаций трансплантационных материалов, они демонстрируют большое расхождение результатов от отсутствия регенерации до непрерывной регенерации.
Сравнение пародонтита и периимплантита
Мягкие и твердые ткани, окружающие остеоинтегрированный имплантат (зону контакта «кость-имплантат»), демонстрируют некоторое сходство с пародонтом естественного зуба. Большая разница между ними состоит в том, что коллагеновые волокна не прикреплены и идут параллельно поверхности имплантата, а не перпендикулярно от кости к цементу в соответствии с их функциями. Пародонтитоподобный патологический процесс – периимплантит – может влиять на дентальные имплантаты и так же, как нелеченый пародонтит может в конечном счете привести к потере естественных зубов и дентальных имплантатов. В то же время значимые доказательства приводятся в поддержку концепции, что бактериальный налет является первичным этиологическим фактором при потере зубов и имплантатов. Как при пародонтите вокруг естественных зубов, клинические признаки патологического процесса вокруг несостоятельных имплантатов включают значительное воспаление десны, формирование глубоких карманов и прогрессирующую потерю кости.
Микробиологические данные при периимплантите
Как было сказано выше, сходная бактериальная флора встречается при пародонтите и периимплантите. Показано, что патогены, связанные с заболеванием пародонта, являются грамотрицательными, образующими черный пигмент анаэробными микроорганизмами. Из опубликованных данных Mombelli и соавт. видно, что бактериальная флора в области несостоятельных имплантатов состоит из грамотрицательных палочек, включая Bacteroides и Fusobacterium. Несостоятельные имплантаты, по данным Becker и соавт., клинически характеризуются повышением подвижности и периимплантационной рентгенопрозрачности, а также глубиной зондирования более 6 мм, что связано с воздействием пародонтальных патогенов, включая Actinobacillus actinomycetemcomitans, Prevotella intermedia, Porphyromonas gingivalis, которые были обнаружены более чем в 1/3 исследованных с помощью ДНК-анализа зон. Показано, что бактерии, обнаруживаемые в периимплантационной борозде в случае успешности имплантата, в основном соответствуют флоре борозды естественных здоровых зубов. Mombelli и Меricske-Stem исследовали микрофлору 18 беззубых пациентов с успешно функционирующими имплантатами и обнаружили, что она на 52,8% состоит из факультативных аэробных кокков, на 17,4% – из факультативных анаэробных палочек и только на 7,3% – из грамотрицательных палочек, и авторы не обнаружили P. gingivalis или спирохет. Haanaes подтвердил, что микрофлора вокруг стабильных имплантатов аналогична таковой для здоровых тканей вокруг естественных зубов; вокруг несостоятельных имплантатов, наоборот, обнаруживается микрофлора, подобная бактериям вокруг больных естественных зубов. Спирохеты, считающиеся одним из наиболее патогенных бактериальных морфотипов, присутствующие при пародонтите у взрослых (Mombelli и соавт. и Mombelli), редко выявляются в субгингивальном налете у клинически стабильных дентальных имплантатов в условиях хорошего ухода (Mombelli и соавт.). Данные другого исследования (Rams и соавт.) свидетельствуют, что в бактериальной флоре при периимплантите обнаруживается больше стафилококков (15,1%), чем при гингивите (0,06%) или пародонтите (1,2%); авторы предположили, что стафилококки могут иметь большее этиологическое значение, чем считалось ранее.

Mombelli и соавт. в исследовании 10 пациентов с имплантатами Brânemark и 10 пациентов с имплантатами ITI брали образцы из глубоких остаточных карманов и обнаружили во многих из них P. gingivalis, P. intermedia, Fusobacterium и спирохеты через 3-6 мес. Ни один из имплантатов не был колонизирован A. actinomycetemcomitans, но схема распространения бактерий для имплантатов Brânemark и ITI была сходной. 3-летние исследования Leonhardt и соавт. 19 пациентов с остеоинтегрированными имплантатами показали, что в поддесневой флоре преобладают P. gingivalis, P. intermedia и A. actinomycetemcomitans.
По-видимому, имплантаты у частично адентичных пациентов имеют больший риск развития периимплантита, чем при полной адентии. Существует несколько качественных различий в микрофлоре, окружающей имплантаты и зубы у частично адентичных пациентов. В то же время наблюдается значительное уменьшение количества пародонтальных патогенов вокруг имплантатов полностью адентичных пациентов. Возможно, что естественные зубы могут служить в качестве резервуаров для пародонтальных патогенов, из которых они могут колонизировать имплантаты. Quirynen и Listgarten изучили 24 частично адентичных пациентов с имплантатами, у которых соотношение кокков, подвижных палочек и спирохет в имплантационных карманах было 65,8, 2,3 и 2,1%, соответственно; для борозды естественного зуба это соотношение было 56,5, 4,9 и 3,6%. У пациентов с полной адентией было обнаружено больше кокков (71,3%), меньше подвижных палочек (0,4%) и не было обнаружено спирохет. Авторы пришли к заключению, что флора вокруг имплантата частично адентичных пациентов потенциально более патогенная. Другое исследование показало, что вокруг имплантатов, функционирующих в течение 3-4 лет, было больше бактерий, чем вокруг имплантатов через 1-2 года после их установки, и было обнаружено больше Р. gingivalis и Р. intermedia у пациентов с частичной адентией по сравнению с пациентами с полным отсутствием зубов.
Предположение, что пародонтит – это то же самое, что и периимплантит, поддерживается исследованием Dharmar и соавт., которое показало, что:
-
существует большая ферментная активность в карманах зубов/имплантатов с глубиной 3-4 мм по сравнению с глубиной кармана 1-2 мм;
-
существует больше подвижных палочек в карманах зубов/имплантатов с глубиной 3-4 мм по сравнению с глубиной кармана 1-2 мм;
-
не обнаружено спирохет вокруг имплантатов у полностью адентичных пациентов, доля спирохет в общей бактериальной флоре составляет 1,8% у частично беззубых пациентов и 2,5% – у пациентов контрольной группы с естественными зубами;
-
ферментные тесты показали, что микрофлора вокруг имплантатов Brânemark подобна таковой вокруг естественных зубов.

Adonogianaki и соавт., исследуя жидкость из десневых борозд 31 частично адентичного пациента как в здоровых тканях, так и при воспалении, не обнаружили никаких отличий между периимплантационной жидкостью и жидкостью из борозды при наличии здоровых тканей и воспаления, и они пришли к заключению, что воспалительная и иммунная реакции аналогичны вокруг зуба и имплантата. Gatewood и соавт. определили, что последовательность бактериальной колонизации, включающей кокки, палочки различной длины, филаментные формы и спирохеты, была аналогична для зубов и поверхностей имплантатов и что формирование и созревание бактериального налета было идентичным. Ponteriero позволил налету скапливаться вокруг имплантатов IMZ («Interpore», США) и естественных зубов в течение 3 нед. и обнаружил определенную корреляцию между скоплением налета и развитием периимплантационного мукозита, но не обнаружил никакой разницы в реакции мягких тканей вокруг зубов и имплантатов. Скопление налета в течение послеоперационного периода после установки имплантата может привести к ухудшению эпителиального прикрепления к его поверхности.
Различие между несостоятельностью имплантата, вызванной инфицированием пародонтальными патогенами (инфекционная несостоятельность), и несостоятельностью имплантата, связанной с ретроградным периимплантитом (травматическая несостоятельность), также отражается на микрофлоре. Rosenberg и соавт.60 показали, что вокруг имплантатов с первичной инфекционной этиологией несостоятельности 42% поддесневой флоры состояло из Peptostreptococcus, Fusobacterium и кишечных грамотрицательных палочек. Вокруг имплантатов, чья несостоятельность имела травматическую этиологию, микрофлора была более характерной для десны и состояла в основном из стрептококков.
Периимплантационные ткани не аккомодируют повышение биомеханического стресса, потому что:
-
имплантаты смещаются в кости минимально по сравнению с естественными зубами;
-
при перегрузке образуются микротрещины кости, и этот процесс необратим даже при отсутствии перегрузки в будущем;
-
у корневидных имплантатов площадь области поддержки меньше, чем у естественных зубов.
В противоположность этому:
-
пародонтальная связка гипертрофируется при увеличении функции, обеспечивая большее смещение в кости;
-
при перегрузке объем минерализованной кости может уменьшаться вокруг естественных зубов, но при отсутствии воспаления и болезни пародонта ситуация обратима при прекращении действия или уменьшении величины перегрузки;
-
пародонтальная связка прикрепляется к естественному зубу на большей площади поверхности и позволяет зубу выдерживать внеосевую нагрузку.
Показано, что воспаление более выражено и воспалительный процесс идет глубже и быстрее вокруг дентального имплантата, чем вокруг соседнего естественного зуба. Предположительно, имплантаты имеют менее эффективный естественный тканевой барьер, чем естественные зубы, и менее резистентны к инфекции. Предсказуемость стабильного прикрепления мягкой ткани не подтверждена, и десневая герметизация может состоять всего лишь из циркулярных волокон.
Таким образом, микрофлора, ассоциированная с несостоятельными дентальными имплантатами, аналогична флоре, обычно связанной с заболеваниями пародонта, и главной причиной периимплантита является зубной налет. Грамотрицательные микроорганизмы, составляющие большую часть микрофлоры при пародонтите и периимплантите, продуцируют эндотоксин – термостойкий липополисахарид, который инициирует острую воспалительную реакцию и деструкцию кости вокруг зуба или имплантата. Предположительно, поверхность имплантата при контакте с пародонтальными патогенами контаминируется эндотоксином, который может подавить восстановление и заживление.
Литературные источники приводят противоречивые данные в отношении прикрепления мягкой ткани к поверхности имплантата посредством эпителия или соединительной ткани. Donley и соавт. предположили, что эпителиальные клетки десневой борозды титанового имплантата образуют гемидесмосомальное прикрепление к поверхности имплантата, подобное таковому для естественных зубов. На основании данных исследований Jansen, Kasten и соавт. сообщили о незначительном эпителиальном клеточном прикреплении к титану или сплаву титана, Meffert предположил, что гемидесмосомальное эпителиальное прикрепление может не быть предсказуемым вокруг металлической имплантационной системы. Kasten и соавт. сообщили, что эпителиальные клетки прикреплялись и распределялись намного легче на поверхности из гидроксиапатита и оксида алюминия, чем из титана или его сплава.

Если вокруг больного естественного зуба и проблемного имплантата микрофлора сходная и реакции поддерживающих тканей на зубной налет аналогичные, то стоматолог может считать, что лечение и восстановление в этих двух ситуациях после деконтаминации зуба/имплантата и удаления эндотоксинов будут такими же.
Гигиенический контроль и инструментарий
Повышенный уровень поддесневых спирохет ассоциируется с эндостальными дентальными имплантатами (керамическими, типа «ramus frame», пластиночными, а также с типами штифтов, сделанных из металла и углерода), которые считаются несостоятельными из-за формирования глубоких карманов, выраженного воспаления десны и прогрессирующей потери кости, однако спирохеты редко встречаются в поддесневом налете вокруг клинически стабильных имплантатов при адекватном гигиеническом уходе. Rams и соавт. брали образцы налета из наиболее апикальных частей пластиночного имплантата и постштифтовых пародонтальных карманов имплантатов и нашли большое количество мелких и средних, но не крупных спирохет. Спирохеты полости рта могут повредить мягкие ткани или задержать их заживление вокруг дентальных имплантатов посредством продукции и высвобождения протеолитических ферментов, растворяющих фибрин, трипсиноподобных ферментов, разрушающих межклеточную адгезию, и конечных продуктов метаболизма, цитотоксичных для десневых тканей. Lekholm и соавт. изучали краевые ткани и бактерии, ассоциированные со здоровыми, функционирующими имплантатами. В основном вокруг здоровых имплантатов были обнаружены неподвижные палочки и кокки. Mombelli и соавт., сравнивали клинические и микробиологические данные для здоровых и несостоятельных имплантатов. Области несостоятельных имплантатов характеризовались микрофлорой, состоящей в основном из грамотрицательных аэробных палочек. Выделяющие черный пигмент Bacteroides и виды рода Fusobacterium обнаруживались регулярно. Вокруг здоровых имплантатов спирохеты и фузиформные бактерии обнаруживали редко. В другом исследовании были взяты образцы у 17 пациентов с 26 несостоятельными имплантатами. Из 26 образцов Staphylococcus spp. был обнаружен в 8, Candida albicans – в 9, грамотрицательные палочки – в 10, Bacteroides intermedins – в 3, Wolinella spp. – в 2, Fusobacterium spp. – в 2, A. acünomycetemcomitans – в 1 и Capnocytophaga – в 1. Becker и соавт. при клиническом и ДНК-исследовании 36 несостоятельных имплантатов у 13 пациентов обнаружили A. acünomycetemcomitans в 27% тестируемых зон, В. intermedius – в 35,4% и Porphyromonas gingivalis – в 37,5%. Wolinski и соавт. провели сравнение бактериальной адгезии к обработанным слюной титану и эмали. Начальное прикрепление Actinomyces viscosus к обработанному слюной титану было меньше, а прикрепление Streptococcus sanguis было одинаковым при сравнении титана и эмали. Таким образом, даже взаимодействие бактерий с субстратом поверхности изменяется. Но, несмотря на эти данные, большинство авторов и исследователей считают, что вокруг несостоятельных имплантатов присутствуют патогены, характерные для пародонтита.
Для ухода за дентальными имплантатами нужно использовать гигиенические методики, инструментарий и, возможно, антимикробные средства. Thompson-Neal и соавт. оценили in vitro эффекты различных профилактических схем на разных поверхностях имплантатов, таких как технически чистый титан; титан, покрытый ГА; кристаллический сапфир (оксид алюминия). Последний был использован в качестве контроля. Была предложена теория, что поскольку кристаллический сапфир является самым твердым материалом, используемым при изготовлении эндостальных дентальных имплантатов, он должен быть более резистентен к изменениям поверхностной топографии и текстуры при износе или более устойчив, чем другие материалы.

Как и предполагалось, на кристаллический сапфир в наименьшей степени влияли используемые для ухода за имплантатами методики, они приводили к образованию только поверхностных царапин. Авторы придерживались протокола, который предусматривал действие инструментов на поверхность, эквивалентное 15 годам программы профессионального ухода при 4 визитах в год с продолжительностью воздействия на поверхность 8 с, с использованием вспомогательного полирующего агента в течение 8 мин.
Если технически чистый титан (не фрезерованный и до начала использования) исследовать под электронным микроскопом с увеличением в 350 раз, то его поверхность будет гладкой, с очень мелкими бороздами от обработки. Если эту поверхность обработать кюреткой с титановым наконечником, то образуются параллельные борозды и пересекающие их штрихи, кюретки из нержавеющей стали образуют на поверхности хаотичные борозды и ямки. Обработка мягкой титановой поверхности воздушно-абразивным инструментом приводит к формированию хаотично расположенных ямок. Ультразвуковые сканеры и инструменты значительно обдирали поверхность, а полировочные пасты создавали хаотичные борозды с кристаллами полировочного вещества на концах борозд. Антимикробные средства, ручные и автоматические щетки очень незначительно изменяли поверхность фрезерованного имплантата.
Титановые имплантаты с гидроксиапатитным покрытием значительно меняли свои свойства при удалении ультразвуковыми инструментами большей части или всего ГА, поэтому топография их поверхности изменялась при воздействии кюреток с титановыми наконечниками. Выраженность повреждений вследствие обработки поверхности различными устройствами и инструментами уменьшается в следующем ряду:
-
ультразвуковые инструменты;
-
звуковые устройства;
-
кюретки с титановым наконечником;
-
межзубные щетки;
-
полировочные пасты;
-
антимикробные средства.
Исследование Misch и соавт. показало, что водяные и воздушные звуковые/ультразвуковые инструменты делают поверхность металла и кристаллического сапфира шероховатой, что может способствовать скоплению налета. Эти же устройства и методики приводили к частичному или полному удалению ГА с металлической основы, за такой поверхностью нельзя оптимально ухаживать и ее нельзя восстановить. Применение однопучковых щеток и антимикробных средств было наиболее безопасным; из всех изученных неабразивных гигиенических методик, пригодных для использования на всех поверхностях имплантата, самым безопасным и наименее абразивным видом профессионального лечения для регулярного использования было полирование резиновой чашкой с пастой. Неопубликованные исследования подтверждают, что пластиковые кюретки незначительно изменяют состояние титановой поверхности имплантата, в отличие от металлических инструментов, применение которых приводит к статистически значимым повреждениям (р = 0,001). В этом исследовании применение кюретки с титановым наконечником приводило к более грубым повреждениям, чем использование кюретки из нержавеющей стали.
Необходимо внедрить в практику пластиковые или тефлоновые кюретки, которыми можно эффективно обработать поддесневые области без изменения поверхностной топографии имплантата.

Антимикробное лечение
Чтобы обеспечить оптимальное здоровье тканей вокруг имплантата, нужно выполнять следующее:
-
Ингибировать процесс образования налета.
-
Удалять популяции микроорганизмов с поверхности зуба/имплантата.
-
Удалять весь существующий налет.
-
Изменять состав налета от патогенных микроорганизмов к непатогенным.
Антимикробные средства в минимальной степени влияют на состояние поверхности имплантата, так что эффективным средством ухода за мягкими тканями вокруг дентального имплантата может быть использование полоскания, содержащего, например, феноловые агенты, алкалоиды растений, или лекарственных средств, содержащих глюконат хлоргексидина.
Многие имплантологи используют глюконат хлоргексидина, рекомендованный Американской стоматологической ассоциацией, из-за его доказанной эффективности при применении в полости рта. Показано, что при концентрации 0,12% он убивает почти 100% бактерий, действие сохраняется даже через 5 ч после 30-секундного полоскания.
Глюконат хлоргексидина является симметричной катионовой молекулой, в состав которой входят два 4-хлорфениловых кольца и две бигуанидовые группы, соединенные центральной гексаметиленовой цепочкой. При физиологическом pH он взаимодействует с отрицательно заряженными клеточными стенками бактерий и фактически связывается или абсорбируется ими. После прикрепления молекулы глюконата хлоргексидина изменяется проницаемость бактериальной клеточной стенки и внутриклеточные компоненты выходят во внеклеточное пространство. При высоких концентрациях наблюдается преципитация цитоплазмы. Глюконат хлоргексидина не вызывает лизиса бактериальных клеток, как пенициллины или некоторые антисептики, например гипохлорит, его действие в основном связано с обширными внутриклеточными повреждениями.
Протокол последующего наблюдения
Для оптимизации ухода в области соединения десны и имплантата гигиенические процедуры легче всего выполнять с помощью межзубной щетки, электрической однопучковой щетки (Rota-Dent, «ProDentec») или ультразвуковой щетки (Sonicare, «Phillips»). Последний инструмент особенно эффективен в задних отделах и на язычной стороне зубов, где доступ затруднен и супраструктура закрывает штифт имплантата при выполнении нормальных гигиенических процедур. Наш опыт свидетельствует, что пациента следует проинструктировать обрабатывать каждую область после установки супраструктуры. Это следует выполнить сразу после установки протеза, и это должно быть частью протокола лечения.
Также эффективным является использование антимикробных средств, нанесенных на ручные или электрические щетки, чтобы достичь максимального контакта агента с поверхностями эффективность гигиены и проверяется целостность фикстуры или другого устройства, для этого инструмент вводится под протез и протез слегка приподнимается, при этом отмечаются любые движения супраструктуры. Подвижность будет говорить о дефиците остеоинтеграции имплантата, возможной несостоятельной цементной фиксации между супраструктурой и ретейнером (в случае цементированного протеза) или несостоятельности винта (разлом, ослабление) в случае винтовой снимаемой супраструктуры. Кроме повторных визитов каждые 3 месяца, следует делать периапикальные рентгенограммы каждые 6 месяцев, чтобы регистрировать любые изменения костной топографии или наличие периимплантационного пространства, означающего наличие проблем или несостоятельность имплантата.

Связывающая активность и действенность соединений по отношению к мягким тканям, зубу и структурам имплантата повышают эффективность и долгосрочный успех процедур домашнего ухода. Пациент должен полоскать рот, соблюдая рекомендации производителя. При применении хлоргексидина у отдельных пациентов может развиваться побочный эффект в виде окрашивания зубов, так что пациенту с многочисленными реставрациями из композитных материалов или пломбировочных материалов, окрашенных в цвет зубов, следует использовать смоченный в хлоргексидине ватный аппликатор, прикладываемый к конкретному месту. Авторы также рекомендуют смачивать головку ручной или электрической щетки в растворе хлоргексидина с последующим прикладыванием к головке и шейке имплантата. По одному из протоколов ухода пациент начинает полоскания сразу после хирургической установки при одноэтапном методе или повторного открытия имплантата при двухэтапном методе установки имплантата. Сочетание полосканий и чистки щеткой с антимикробными средствами начинается после установки протеза.
Чтобы облегчить процедуры домашнего ухода, супраструктура должна быть самоочищающейся и полностью удерживаемой фикстурой с адекватными амбразурами для доступа гигиенических инструментов, а не полностью негигиеничной, способствующей накоплению налета, воспалению десны и не обеспечивающей эффективный уход.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии