Реакции гиперчувствительности: типы. Реакции гиперчувствительности замедленного типа
Реакции гиперчувствительности II и III типов опосредуются антителами, принадлежащими к IgG, IgM, а в некоторых случаях изотипами IgA или IgE. В настоящее время известно, что эти реакции обладают некоторыми общими эффекторными механизмами. Различия между двумя формами гиперчувствительности лежат в типе и расположении антигена, вовлеченного в реакцию, и том способе, с помощью которого антиген соединяется с антителом. Важно понимать, что во многих случаях антигены-мишени, вовлеченные в такие реакции гиперчувствительности, являются аутоантигенами. Цитотоксические реакции гиперчувствительности II типа стимулируются путем непосредственного прикрепления антитела к антигену на поверхности клетки. Реакции III типа стимулируются иммунными комплексами антиген-антитело. Иммунные механизмы, которые определяют клинические проявления при таких реакциях гиперчувствительности, рассматриваются в данной главе.
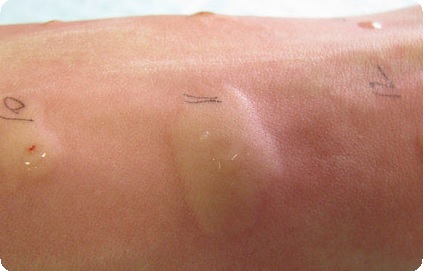
Цитотоксические реакции: гиперчувствительность II типа
Как показывают приведенные далее примеры клинически важных реакций гиперчувствительности II типа, многие из этих цитотоксических реакций являются выражением аутоиммунитета, опосредованного антителами. Антитела, вовлеченные в такие реакции гиперчувствительности, направлены или против обычных (например, перекрестно-реагирующие антитела, возникшие после инфекции), или против измененных аутоантигенов (например, аутоантитела, измененные под воздействием лекарственных средств и возникшие после их связывания с мембранами некоторых клеток). Клетка-мишень при этом либо повреждается, либо разрушается различными механизмами. В таких цитотоксических реакциях задействованы три различных механизма, опосредованные антителами.
Реакции, опосредованные комплементом
При реакциях гиперчувствительности, опосредованных комплементом, антитела реагируют с компонентом мембраны клетки, приводя к фиксации комплемента. Этим запускается каскад комплемента, что ведет или к лизису клетки, или к опсонизации, опосредованной рецепторами для Fc или СЗ. Опсонизация способствует фагоцитозу и разрушению клетки макрофагами и нейтрофилами, экспрессирующими поверхностные рецепторы для Fc или СЗb. Наиболее часто этими механизмами повреждаются клетки крови. Интересно отметить, что у мышей, нокаутных по Fc-рецепторам для IgG, не запускаются реакции гиперчувствительности II типа (и III типа) — эти данные подчеркивают роль Fc-рецепторов для IgG в инициации каскадов этих реакций.

При антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦ) используются Fc- рецепторы, экспрессируемые на клетках многих типов (например, натуральных киллерах, макрофагах, нейтрофилах, эозинофилах), которые обеспечивают средства привлечения этих клеток и вступление в контакт с клетками-мишенями, покрытыми антителами. Лизис этих клеток-мишеней требует непосредственного контакта, но не связан с фагоцитозом или фиксацией комплемента. Напротив, лизис клеток-мишеней при АЗКЦ аналогичен киллингу цитотоксическими Т-клетками и включает высвобождение перфорина и гранзимов из цитоплазматических гранул (модифицированных лизосом). После высвобождения из литических гранул перфорины проникают в мембрану клетки-мишени и полимеризуются с образованием пор. При этом гранзимы, к которым относятся по крайней мере три сериновые протеазы, проникают в цитоплазму клетки-мишени и активируют реакции, ведущие к апоптозу.
В реакциях АЗКЦ участвуют IgG и Fc-рецепторы для IgG (FcylH, известные также как CD16). В частности, подклассы IgG — IgG1 и IgG3 — способны вызывать реакции АЗКЦ, поскольку их Fc- фрагменты способны связываться с CD 16. Однако в АЗКЦ могут также участвовать антитела класса IgE. В этом случае низкоаффинные Fc-рецепторы для IgE (FceRII), экспрессированные на определенных клетках, включая эозинофилы, как указывалось в предыдущей главе, связываются с Fc-фрагментом антител IgE, прикрепленных к антигенам-мишеням.

Опосредованные антителами нарушения функции клеток
Рецепторы клеточной поверхности также могут служить антигенами-мишенями в реакциях гиперчувствительности II типа. Когда аутоантитела прикрепляются к таким рецепторам, они или нарушают функцию клеток, или вмешиваются в ее регуляцию без повреждения клеток или воспаления.
В следующем подразделе рассмотрены несколько примеров клинически важных антитело-опосредованных цитотоксических реакций гиперчувствительности.
Примеры цитотоксических реакций гиперчувствительности
Трансфузионные реакции
Переливание АВО-несовместимой крови приводит к развитию цитотоксических реакций, опосредованных комплементом. Например, у людей с группой крови 0 по еще не достаточно ясным причинам в кровотоке находятся анти-А- и анти-В-антитела класса IgM (изогемагглютинины), которые реагируют с субстанциями групп крови А и В соответственно. Если такому человеку переливают эритроциты типа А, мгновенные последствия могут быть катастрофическими. Поскольку у этих людей имеется значительное количество анти- А-антител IgM в кровотоке, на всех перелитых А-эритроцитах будут закрепляться антитела. В связи с эффективной активацией комплемента антителами IgM (одна молекула IgM может активировать многочисленные молекулы комплемента) и отсутствием механизмов восстановления мембраны эритроцитов разрушаются комплементом, и клетки подвергаются лизису. При этом не только не достигается необходимый эффект от переливания, но и реципиент подвергается риску развития почечной недостаточности, связанной с блокадой почек большим количеством клеточных мембран эритроцитов, и возможности токсических эффектов при высвобождении комплекса гема.
Реакции, вызванные лекарственными средствами
На некоторых людей определенные лекарственные средства действуют как гаптены. Они соединяются с клетками или другими компонентами крови и приводят к формированию антител. Когда антитела соединяются с клетками, покрытыми лекарственным средством, возникает цитотоксическое повреждение. Его тип зависит от типа клетки, соединяющейся с лекарственным средством.
Например, некоторые лекарственные средства могут соединяться с тромбоцитами, делая их иммуногенными. Ответы со стороны антител приводят к лизису тромбоцитов, вызывая тромбоцитопению (малое количество тромбоцитов в крови). Это нарушение в свою очередь приводит к появлению пурпуры (кровоизлияний в кожу, слизистые оболочки и внутренние органы), что является основной проблемой при тромбоцитопенической пурпуре, вызванной приемом лекарственных средств. Отмена препарата ведет к исчезновению симптомов. Другие лекарственные средства, такие как:
-
хлорамфеникол (антибиотик), могут связываться с лейкоцитами;
-
феноцитин (анальгетик);
-
хлорпромазин (транквилизатор) — с эритроцитами.
Следствием иммунного ответа на эти лекарственные средства может явиться агранулоцитоз (уменьшение количества гранулоцитов) в случае, если задействованы лейкоциты, и гемолитической анемии в случае, если повреждаются эритроциты. Повреждение этих клеток-мишеней в данных случаях может опосредоваться любым из двух механизмов, описанных ранее: цитолизом посредством активации комплемента или разрушением клеток путем фагоцитоза, опосредованного рецепторами к Fc или СЗb.
Реакции при резус-конфликте
В клинической практике резус-конфликт отмечается при реакциях резус-несовместимости, встречающихся у детей, рожденных от родителей с резус-несовместимыми группами крови. Резус- антигены были названы так, поскольку кроличья антисыворотка, полученная против эритроцитов обезьян макак-резус, агглютинировала эритроциты примерно у 85 % обследованных людей. Эритроциты таких людей обозначаются как Rh+, в то время как эритроциты оставшихся 15% населения — как Rh. Резус-отрицательные матери могут сенсибилизироваться к Rh-антигенам во время своей первой беременности ребенком, чьи эритроциты были резус-положительными. Это происходит в результате попадания некоторых эритроцитов ребенка в кровоток матери во время рождения. Если мать при этом получила достаточную иммунизацию, чтобы производить анти- Rh-антитела изотипа IgG, то следующий плод будет находиться в группе риска, поскольку антитела IgG способны проходить через плаценту. Таким образом, при второй и последующих беременностях, когда aнти-Rh-антитела IgG проходят через плаценту, они связываются с Rh- антигеном на эритроцитах плода. Так как плотность расположения Rh-антигена на поверхности эритроцита мала, эти антитела не способны напрямую приводить к лизису или агглютинации клеток. Однако покрытые антителами клетки активно разрушаются посредством опсонического действия Fc-фрагментов IgG, которые взаимодействуют с Fc-рецепторами на фагоцитирующих клетках РЭС. Результатом является усиливающееся разрушение эритроцитов плода или новорожденного, патологические последствия которого определяются снижением способности крови переносить кислород. При этом развивается желтуха, обусловленная продуктами разрушения гемоглобина, — состояние, называемое гемолитической болезнью новорожденных (эритробластозом плода). Предотвратить такую реакцию Rh-несовместимости можно, если ввести матери анти-Rh- антитела в течение 72 ч в период родов, чтобы эффективно блокировать фазу сенсибилизации. Это также приводит к быстрому выведению из кровотока матери Rh+-клеток. Одним из широко применяемых препаратов анти- Rh -антител являются антитела (Rhogam) против антигена D, в настоящее время считающегося наиболее сильным иммуногеном и наиболее важным из всех Rh-антигенов.
Аутоиммунные реакции с вовлечением рецепторов клеточных мембран
Примером опосредованной антителами дисфункции клеток, обусловленной реакцией с клеточными рецепторами, является аутоиммунное заболевание — злокачественная миастения. Антагонистические аутоантитела реагируют с ацетилхолиновыми рецепторами концевых пластинок двигательного нерва скелетных мышц, нарушая нервно-мышечную проводимость и вызывая слабость мышц. Антитела в некоторых случаях могут служить и агонистами, вызывая стимуляцию клеток-мишеней. Примером последнего случая является болезнь Грейвса, при которой антитела к рецепторам тироидстимулирующего гормона (ТСГ) на эпителиальных клетках щитовидной железы стимулируют клетки, приводя к гипертиреозу.
Аутоиммунные реакции с вовлечением детерминант других клеточных мембран
Вследствие некоторых инфекционных заболеваний или других пока еще неизвестных причин у отдельных людей появляются антитела против собственных клеток крови (аутоиммунная гемолитическая анемия) Если клетками-мишенями являются эритроциты, присоединение антиэритроцитарных антител сокращает их срок жизни или приводит к их уничтожению посредством механизмов гемолиза или фагоцитоза с помощью рецепторов для Fc и СЗb. Если продукция новых эритроцитов не будет компенсировать их убыль, все это может вызвать прогрессирующую анемию. Иногда антитела эффективно связываются только при низких температурах (холодовые агглютинины); в этих случаях понижение температуры тела, особенно охлаждение рук и ног, ведет к активному прикреплению антител и разрушению эритроцитов.
Другим примером разрушения клеток аутоантителами является идиопатическая тромбоцитопеническая пурпура. При этом заболевании антитела, направленные против тромбоцитов, вызывают их разрушение комплементом или фагоцитирующими клетками с рецепторами Fc или СЗb. Уменьшение количества тромбоцитов может привести к кровоизлияниям (пурпура). Таким же образом антитела, направленные против гранулоцитов, могут привести к агранулоцитозу, что делает человека восприимчивым к различным инфекциям. Наконец, могут формироваться антитела против других компонентов ткани, таких как коллаген базальной мембраны, вызывая синдром Гудпасчера, и против десмосом, приводя к вульгарной пузырчатке (пемфигусу).
При предыдущем обсуждении внимание акцентировалось на реакциях II типа, вызываемых лекарственными средствами, однако следует учитывать, что гиперчувствительность к ним может также вызывать реакцию немедленной гиперчувствительности, опосредованную IgE (I типа), реакцию ГЗТ (IV тип) и реакции, опосредованные иммунными комплексами (III тип). Некоторые реакции вызываются лекарственными средствами, действующими как гаптены, соединяющиеся с некоторыми компонентами организма, другие реакции могут индуцироваться лекарственными средствами, действующими как контактный аллерген.
Реакции, обусловленные иммунными комплексами: гиперчувствительность III типа
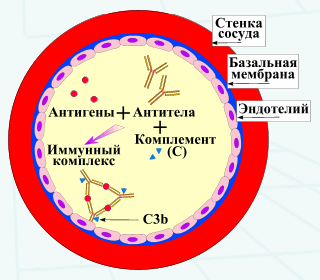
В нормальных условиях циркулирующие иммунные комплексы удаляются фагоцитирующими клетками, при этом такие комплексы соединяются с Fc-рецепторами lgG, экспрессированными на этих клетках. Кроме того, эритроциты, имеющие СЗb-рецепторы, могут связывать комплексы, соединенные с комплементом, и транспортировать их в печень, где они удаляются фагоцитирующими купферовскими клетками. Если в циркулирующей крови появляется большое количество иммунных комплексов определенного размера, они могут откладываться в тканях и способствовать появлению различных системных патологических изменений, так называемых реакций гиперчувствительности III типа. Такие реакции могут быть системными или локализованными. Они опосредуются отложением иммунных комплексов в тканях, особенно почках, коже, суставах, сосудистом сплетении и цилиарной артерии глаза.
Формирование иммунных комплексов может инициироваться чужеродными антигенами, такими как бактерии или вирусы, или, как при реакции Артюса, при попадании большого количества чужеродного белкового антигена внутрь кожи или в легкие. В отличие от этого эндогенные антигены, такие как ДНК, могут быть мишенью для аутоантител, как при системной красной волчанке (СКВ). В последнем случае клинический результат наиболее точно определяет аутоиммунный феномен. У больных с СКВ часто наблюдаются как системное (мультиорганное), так и локализованное проявления болезни иммунных комплексов. Локализованное повреждение ткани возникает в результате формирования комплексов антиген — антитело во внесосудистых пространствах (например, в гломерулах почек). Это также происходит при различных гломерулярных заболеваниях, при которых иммунные комплексы формируются in situ на базальной мембране гломерул.
Механизм повреждения, наблюдаемый при заболеваниях, опосредованных иммунными комплексами, одинаков независимо от формы отложения иммунного комплекса (т.е. системного или локального). Центральное место в патогенезе повреждения ткани занимают фиксация комплемента иммунными комплексами, активация каскада комплемента и высвобождение биологически активных фрагментов (например, анафилатоксинов СЗа и С5а). Активация комплемента приводит к увеличению проницаемости сосудов и стимуляции привлечения ПМЯ фагоцитов, высвобождающих лизосомальные ферменты (например, нейтральные протеазы), которые могут повредить базальную мембрану гломерул.
Изотип имуноглобулинов, вовлеченных в реакции гиперчувствительности III типа, обычно IgG, но могут вовлекаться и IgM. Как и при реакциях гиперчувствительности II типа, Fc-рецепторы для IgG (CD 16), экспрессируемые на лейкоцитах, играют решающую роль в инициации каскадов реакций III типа. Комплексы антиген-антитело могут фиксировать комплемент и/или активировать эффекторные клетки (основная часть представлена нейтрофилами), которые вызывают повреждение ткани. Анафилатоксины СЗа и С5а, получающиеся при активации комплемента, приводят к высвобождению тучными клетками и базофилами метаболитов арахидоновой кислоты и хемокинов, которые привлекают дополнительные базофилы, эозинофилы, макрофаги и нейтрофилы в место реакции. Полиморфные клетки высвобождают свои лизосомальные ферменты на поверхности поврежденной ткани. Происходит стимулирование макрофагов с высвобождением фактора некроза опухоли a (TNFa) и IL-1, при этом тромбоциты формируют микротромбы и участвуют в пролиферации клеток путем высвобождения тромбоцитарного фактора роста (PDGF).
Системное заболевание, вызванное иммунными комплексами
Патогенез системного заболевания, вызванного иммунными комплексами, может быть разделен на три фазы. В течение первой фазы в кровотоке формируются иммунные комплексы антиген – антитело. Вслед за этим происходит депонирование иммунных комплексов в разных тканях, которое приводит к развитию третьей фазы — воспалительным реакциям в них. Некоторые факторы позволяют определить, приведет ли формирование иммунных комплексов к их депонированию в тканях и заболеванию. В этом смысле важным является размер комплексов. Очень большие комплексы, формирующиеся в условиях избытка антител, быстро удаляются из кровотока фагоцитирующими клетками и таким образом не представляют опасности. Мелкие и среднего размера комплексы довольно длительный период времени циркулируют в кровотоке и прикрепляются с меньшей завидностью к Fc-рецепторам для IgG, экспрессируемым на фагоцитирующих клетках. Таким образом, мелкие и средние иммунные комплексы являются более патогенными, чем большие. Вторым фактором, который может повлиять на развитие системного заболевания, вызванного иммунными комплексами, является целостность системы мононуклеарных фагоцитов. Изначальное нарушение функции этой системы повышает вероятность длительного нахождения иммунных комплексов в циркуляции. Предполагается, что перегрузка этой фагоцитарной системы большим количеством иммунных комплексов также подрывает ее способность удалять их из кровотока. По еще не до конца выясненным причинам наиболее вероятными местами депонирования иммунных комплексов являются почки, суставы, кожа, сердце и мелкие сосуды. Локализация отложений в почках может быть частично объяснена тем, что гломерулы осуществляют функцию фильтрации.
Сывороточная болезнь
Прототипом системного заболевания, вызванного иммунными комплексами, является сывороточная болезнь. Этот термин возник благодаря наблюдениям, сделанным на рубеже XX в. К. П. Пирке (С. Р. Pirquet) и Б. Шиком (В. Schick), в процессе лечения некоторых инфекционных заболеваний (таких как дифтерия и столбняк) при введении лошадиной антисыворотки. Было хорошо известно, что патологические последствия инфекций, вызванных Corynebacterium и Clostridium, обусловлены секрецией экзотоксинов, действующих на клетки организма крайне разрушительно. Сами по себе эти бактерии относительно неинвазивны и не вызывают тяжелых расстройств. Поэтому стратегия лечения этих заболеваний заключалась в быстрой нейтрализации токсина до того, как он появится в тканях в количестве, достаточном, чтобы убить организм. Поскольку для активной иммунизации необходимо несколько недель, чтобы получить «рабочий» уровень антител, было необходимо защитить организм путем пассивной иммунизации — введением большого количества уже сформировавшихся антител к токсину как можно быстрее после диагностики заболевания, чтобы предотвратить вызываемую ими смерть. Оказалось, что лошади легко иммунизируются и способны вырабатывать большое количество необходимой антисыворотки, поэтому их выбрали для получения антитоксина. В настоящее время известно, что введение большого количества гетерологичной (полученной от другого вида) сыворотки вызывает образование антител к чужеродным иммуноглобулинам у реципиента А, это ведет к формированию комплексов антиген-антитело и появлению симптомов сывороточной болезни. Эта болезнь может возникать у пациентов в качестве вторичной реакции на введение небелковых лекарственных средств. Классическими клиническими проявлениями являются лихорадка, артралгия, лимфоаденопатия и кожная сыпь. Кроме того, следует помнить о сывороточной болезни у пациентов, лечившихся от злокачественных новообразований или аутоиммунных расстройств моноклональными антителами, полученными от грызунов, а также принимавших препараты против отторжения трансплантата.
Болезнь иммунных комплексов, связанная с инфекциями
Вероятно, наилучшим примером заболеваний иммунных комплексов является ревматоидная лихорадка. У чувствительных людей это заболевание обусловлено инфекциями (например, ангинами), вызываемыми стрептококками группы А. При этом заболевании развивается воспаление и повреждаются сердце, суставы и почки. Было показано, что в клетках и мембранах стрептококков находятся различные антигены, обладающие перекрестной реактивностью с антигенами в мышцах сердца человека, суставах и базальной мембране гломерул. Полагают, что антитела к стрептококковым антигенам связываются с этими компонентами нормальной ткани и вызывают воспалительные реакции тем же путем, что описан ранее. Существуют наблюдения, что при ревматоидном артрите вырабатывается ревматоидный фактор — аутоантитела IgM, которые связываются Fc-фрагментами нормальных IgG. Эти иммунные комплексы участвуют в воспалении сустава и определяют характер повреждения при данном заболевании.
При других инфекциях у некоторых людей вырабатываются антитела, перекрестно реагирующие с некоторыми составляющими нормальной ткани. Например, у индивидуумов, предрасположенных к синдрому Гудпасчера, это заболевание иногда развивается после респираторных вирусных инфекций. У таких пациентов легочные кровоизлияния и гломерулонефрит возникают из-за того, что антитела прикрепляются непосредственно к базальной мембране в легких и почках, активируют комплемент и вызывают повреждение мембраны в результате накопления нейтрофилов и высвобождения расщепляющих ферментов. Иногда синдром Гудпасчера рассматривается как реакция гиперчувствительности II типа, поскольку при нем также наблюдается цитотоксическое воздействие на обычные клетки, опосредованное антителами. Различие между таким заболеванием, вызванным инфекцией и опосредованным антителами, и сывороточной болезнью, связанной с иммунными комплексами, состоит в том, что при микроскопическом исследовании определяются отложения, похожие на ленту, располагающиеся вдоль базальной мембраны и создающие впечатление, что к поверхностным антигенам прикрепилась гладкая ковровая дорожка из антител. Напротив, при сывороточной болезни соединение из уже сформировавшихся иммунных комплексов на базальной мембране ведет к образованию комковатых неровных отложений.
При некоторых инфекционных заболеваниях (малярии, проказе, лихорадке Денге) в течении болезни могут возникать периоды, когда одновременно появляется большое количество и антигенов, и антител, что приводит к формированию иммунных агрегатов, которые депонируются в различных местах. Таким образом, при любом из этих заболеваний комплекс имеющихся симптомов может включать компонент, относящийся к реакциям гиперчувствительности III типа.
Дефицит комплемента
Как указывалось ранее, большинство иммунных комплексов не вызывают повреждения, поскольку удаляются из кровотока до того, как откладываются в тканях. Комплексы, содержащие СЗb, прикрепляются к эритроцитам, несущим CR1. Эритроциты доставляют комплексы к мононуклеарным фагоцитам в печени и селезенке для удаления путем фагоцитоза. Компоненты классического пути комплемента уменьшают число эпитопов антигена, к которым могут прикрепиться антитела, включаясь в структуру комплекса, что приводит к получению более мелких растворимых комплексов. Именно эти маленькие растворимые комплексы наиболее активно соединяются с эритроцитами. У пациентов с дефицитом комплемента, затрагивающим C1, С2 и С4, комплексы остаются большими и плохо связываются с эритроцитами. Эти не связанные с эритроцитами комплексы быстро захватываются печенью, а затем высвобождаются с последующим отложением в тканях, таких как кожа, почки и мышцы, где они могут запускать воспалительные реакции.
Локализованная болезнь иммунных комплексов
В 1903 г. французский ученый М.Артюс иммунизировал кроликов лошадиной сывороткой путем повторных внутрикожных инъекций. После нескольких недель он отметил, что каждая последующая инъекция вызывает увеличивающуюся по тяжести реакцию в месте их введения. Вначале наблюдались умеренная эритема (краснота) и отек (накопление жидкости) в течение 24 ч после инъекции. К следующему дню эти реакции проходили без последствий, но повторные инъекции вызывали более выраженные отечные реакции, а к пятой или шестой инъекции поражения становились геморрагическими, сопровождались некрозом и медленно заживали. Этот феномен, называемый реакцией (феноменом) Артюса, является прототипом локализованных реакций иммунных комплексов. Как и в системных реакциях гиперчувствительности, обусловленных иммунными комплексами, в локализованных реакциях участвует растворимый антиген. Возникающие местные воспалительные реакции проявляются после взаимодействия антигена с уже сформированными специфичными к данному антигену антителами IgG. Когда такие предсуществующие антитела вступают в контакт с антигеном в соответствующих концентрациях (избыток антител) в стенках сосудов (венулы) или вблизи них, формируются и накапливаются нерастворимые иммунные комплексы аналогично тому, как это происходит в диффузионной камере с гелем при иммунодиффузии. Последующие патофизиологические изменения очень схожи с наблюдаемыми при системной форме заболевания. В результате повреждения сосудистой стенки наблюдаются ее разрывы и кровотечения, сопровождаемые локальным некрозом ткани.
Клиническим примером реакций гиперчувствительности по типу Артюса является заболевание, называемое фермерским легким. Оно является внутрилегочной реакцией гиперчувствительности III типа у больных с экзогенно-аллергическим альвеолитом. Как свидетельствует название, заболевание иногда возникает у людей, занимающихся фермерским хозяйством, и поэтому классифицируется как профессиональное. У чувствительных индивидуумов контакт с заплесневевшим сеном ведет к возникновению тяжелого расстройства дыхания или пневмониту в течение 6-8 ч. Было показано, что у таких больных вырабатывается большое количество антител IgG, специфичных к спорам термофильных актиномицетов, растущих на гниющем сене. Вдыхание бактериальных спор вызывает реакцию в легких, напоминающую реакцию Артюса в коже, а именно формирование агрегатов антиген — антитело и последующее воспаление.
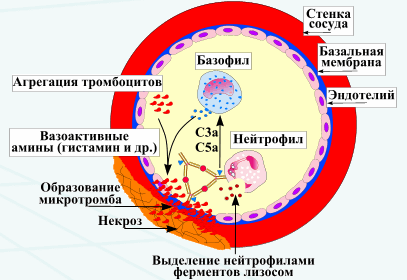
Существует много сходных легочных реакций III типа, названных с учетом профессиональной принадлежности больных или агента, их вызывающего, например аллергоз голубеводов, работников сыродельной промышленности, багассоз (вызывается вдыханием микроволокон сахарного тростника), аллергоз дубильщиков кленовой коры, болезнь переработчиков паприки и чрезвычайно редко — легкое настильщиков соломенных крыш. Загрязненность окружающей среды в месте работы, определяющая длительный контакт с большим количеством потенциально антигенного вещества, очевидно, способствует развитию этой формы профессионального заболевания.
Реакции гиперчувствительности: опосредованная Т-клеткам и гиперчувствительность замедленного типа (IV тип)
В отличие от реакций гиперчувствительности, опосредованных антителами, гиперчувствительность, опосредованная Т-клетками, также называемая гиперчувствительностью замедленного типа (ГЗТ) или IV типа, определяется иммунными ответами, инициируемыми в основном антигенспецифичными Т-клетками. При этом реакции гиперчувствительности, опосредованные антителами, можно воспроизвести, если ввести неиммунизированному индивидууму сыворотку, взятую у иммунизированного или сенсибилизированного человека. А реакции гиперчувствительности IV типа могут быть воспроизведены только с помощью Т-клеток, что показано в экспериментах на животных.
Так же как и в случае гиперчувствительности, опосредованной антителами, реакции гиперчувствительности, опосредованные Т-клетками, иногда являются патогенными Когда активированные контактом с антигеном, представляемым атигенпрезентирующими клетками, реактивные Т-клетки высвобождают неоправданно большое количество цитокинов, некоторые из них привлекают и активируют другие мононуклеарные клетки, которые не являются антигенспецифичными (моноциты и макрофаги). Это в основном и определяет конечный патогенный эффект этих реакций. Антигены, вызывающие этот тип ответа, могут быть чужеродной тканью (как при реакциях на аллотрансплантат), внутриклеточными паразитами (например, вирусами, микобактериями или грибами), растворимыми белками, а также одним из многочисленных химических соединений, способных проникать через кожу и соединяться с белками организма, являющихся для них носителями.
Клинические проявления реакций гиперчувствительности IV типа различаются в зависимости от сенсибилизирующего антигена и способа контакта с ним. Вариантами такой реакции могут быть:
-
контактная гиперчувствительность;
-
гиперчувствительность по туберкулиновому типу;
-
гранулематозная гиперчувствительность.
В основном, однако, все эти варианты имеют общие патофизиологические механизмы. Основные события, приводящие к появлению таких реакций, состоят из трех этапов:
I) активация антиген-специфичных ТН1-клеток у ранее сенсибилизированного индивидуума;
2) выработка антиген-специфичными ТН1-клетками провоспалительных цитокинов;
3) привлечение и активация антиген-неспецифичных воспалительных лейкоцитов.
Эти процессы обычно происходят в течение нескольких дней (24-72 ч), вследствие чего и появился термин «гиперчувствительность замедленного типа». Эта отдаленность по времени является характерным отличием ГЗТ от реакций, опосредованных антителами, которые проявляются гораздо быстрее.
Механизмы гиперчувствительности замедленного типа
Механизмы, вовлеченные в процесс сенсибилизации при ГЗТ и индукции реакции после контакта с антигеном, в настоящее время хорошо изучены. Следует подчеркнуть, что, как и при реакциях гиперчувствительности, опосредованных антителами, для появления ГЗТ необходим предшествующий контакт с антигеном. Такой контакт (фаза сенсибилизации) активирует и увеличивает количество антигенспецифичных ТН1-клеток памяти, которые при последующем контакте с тем же антигеном обусловливают ответ с появлением реакции ГЗТ (фаза проявления). Фаза сенсибилизации обычно продолжается 1-2 недели, во время которых действуют обычные механизмы активации Т-клеток. В отличие от этого для привлечения и активации таких клеток после контакта с антигеном в фазе проявления необходимы примерно 24-72 ч — период, который завершается появлением гистологических и клинических признаков ГЗТ. Клинические проявления ГЗТ способны сохранятся несколько недель или в некоторых случаях наблюдаться постоянно (например, ГЗТ при некоторых аутоиммунных заболеваниях).
Во время фазы проявления контактировавшие с антигеном ТН1-клетки секретируют ряд цитокинов, особенно хемокины и интерферон-у (IFNy), которые вызывают хемотаксис и активацию макрофагов. Привлечение и активация антиген-неспецифичных клеток антиген-специфичными ТН1-клетками является примером взаимодействия приобретенного и врожденного иммунитета. Другим цитокином, секретируемым этими клетками, является IL-12. Он подавляет субпопуляцию ТН2 и способствует росту субпопуляции ТН1, таким образом направляя ответ на увеличение синтеза ТН1-клетками цитокинов, активирующих макрофаги. Следовательно, IL-12 играет важную роль в ГЗТ.
В реакциях ГЗТ также участвуют С08+-Т-клетки, которые первыми активируются и распространяются в период сенсибилизационной фазы реакции. Эти клетки могут повреждать ткани с помощью механизмов клеточно-опосредованной цитотоксичности. Активация CD8+- Т-клеток происходит в связи с тем, что многие растворимые в жирах химические вещества способны индуцировать реакции ГЗТ и проникать сквозь клеточную мембрану (например, пентадекакатехол — химическое соединение, которое приводит к развитию дерматита, вызванного контактом с ядовитым плющом (сумахом укореняющимся)). Внутри клетки эти химические соединения реагируют с цитозольными белками с образованием модифицированных пептидов, которые перемещаются в эндоплазматический ретикулум, а затем на поверхность клетки в составе молекул МНС I класса. Клетки, презентирующие такие модифицированные собственные белки, затем повреждаются или уничтожаются CD8+-T- клетками.
Последствия гиперчувствительности замедленного типа
Исходя из сказанного, должно быть понятно, что эффекторные функции при ГЗТ осуществляются активированными макрофагами. В наиболее благоприятных условиях ГЗТ приводит к разрушению инфицирующего организма, который мог вызвать реакцию в месте первого контакта. Считается, что это разрушение происходит преимущественно в результате фагоцитоза микроорганизма макрофагами, их активации IFNy с последующим расщеплением ферментами лизосом и сопутствующими продуктами респираторного взрыва, такими как пероксидные и супероксидные радикалы. Чужеродная ткань, опухолевая ткань и растворимые или конъюгированные антигены уничтожаются таким же путем.
В основе нескольких известных вариантов классической ГЗТ лежат одинаковые механизмы. Однако все эти варианты обладают дополнительными характеристиками, которые описываются в этом подразделе.
Контактная гиперчувствительность
Контактная гиперчувствительность (иногда называемая контактным дерматитом) является одной из форм ГЗТ, при которой органом-мишенью является кожа, а воспалительная реакция — это результат контакта с сенсибилизирующими веществами на поверхности кожи. Таким образом, это в первую очередь эпидермальная реакция, характеризующаяся экземой в месте контакта с аллергеном. Обычно пик реакции случается через 48-72 ч со времени контакта. Прототипом этой формы ГЗТ является дерматит после контакта с ядовитым плющом (сумахом укореняющимся). Вещество, вызывающее реакцию, содержится в масле, выделяемом листьями ядовитого плюща или другого родственного растения. Подобные масла содержат катехолы (дигидроксифенолы) с длинными углеводородными боковыми цепями. Эти особенности позволяют веществу проникать в кожу за счет липофильности (которая позволяет ему растворяться в жирах, находящихся в коже), а также за счет способности ковалентно соединяться (путем формирования хинонов) со связанными с клеткой белками (например, молекулами-носителями на поверхности клеток). Другие вещества, сенсибилизирующие при контакте, обычно также являются растворимыми в жирах гаптенами. Различные по химической форме, они обладают общим свойством проникать через кожу и формировать конъюгаты гаптен-носитель. Химические соединения, подобные 2,4-динитрохлорбензолу, используются для индукции контактной сенсибилизации. Поскольку практически у любого нормального индивидуума можно добиться появления гиперчувствительности при контакте с пробной дозой этого соединения, оно часто используется для оценки склонности пациентов к развитию Т-клеточных реакций (клеточноопосредованный иммунитет). Различные металлы, такие как никель и хром, которые присутствуют в ювелирных украшениях и застежках для нижнего белья, также способны вызывать реакцию со стороны кожи при контакте, вероятно, путем хелатирования (ионного взаимодействия) белками кожи.
Считается, что индуцирование контактной чувствительности происходит путем презентации причинного аллергена клетками Лангерганса (АПК в коже). Еще не ясно, прикрепляется ли сенсибилизирующий агент непосредственно к компонентам поверхности клетки Лангерганса или вначале прикрепляется к белкам сыворотки крови или ткани, а только затем захватывается этими клетками.
Первоначальный контакт приводит к расширению клонов ТН1-клеток, способных распознавать специфический контактный сенсибилизирующий антиген. Последующий контакт с сенсибилизирующим антигеном запускает фазу проявления ГЗТ, как указывалось ранее. Если при этом варианте ГЗТ провести гистологию, то можно наблюдать формирование волдыря в эпителии и мононуклеарных инфильтратов в дерме. При этом происходят отделение эпидермальных клеток, спонгиоз (воспалительный межклеточный отек эпидермиса) и формирование пузыря.
Примеры гиперчувствительности замедленного типа
Во многих случаях в месте первичного контакта сохраняется достаточное количество сенсибилизирующего антигена. Таким образом, примерно в течение I недели, пока наблюдается экспансия Т-клеток, сохранившийся антиген служит провоцирующим фактором, и реакция в этом месте будет усиливаться. Поэтому фаза проявления может возникнуть без нового контакта с сенсибилизирующим антигеном.
Обычной процедурой для тестирования на наличие контактной чувствительности является накожная проба, при которой раствор с вероятным антигеном наносят на кожу и накрывают плотной повязкой. Появление в течение 3 суток на этом участке индурации и эритемы указывает на чувствительность к антигену.
Гранулематозная гиперчувствительность
В условиях, аналогичных контактному дерматиту, когда антиген быстро удаляется, повреждение проходит медленно с небольшим повреждением ткани. Иногда, однако, антиген может оказаться защищенным и существовать очень долгое время, как, например, яйца шистосом и инкапсулированные в липидах микобактерии, устойчивые к ферментативному расщеплению. В этих случаях ответ может затягиваться и становиться разрушительным для организма. Продолжающееся накопление макрофагов ведет к образованию кластеров эпителиоидных клеток, которые сливаются с образованием гигантских клеток в гранулемах.
Максимальное время реакции с образованием гранулемы составляет 21-28 дней. Патологические изменения возникают из-за неспособности макрофагов разрушить фагоцитированные патогены (например, Mycobacterium leprae) или расщепить большие инертные антигены. Гранулемы могут оказать вредоносное воздействие в связи с тем, что они смещают нормальную ткань и приводят к казеозному (творожистому) некрозу. Подобное явление типично для такого заболевания как туберкулез, вызванный М. tuberculosis, при котором лимфоциты кольцом окружают сердцевину и может наблюдаться значительный фиброз.
Патологический процесс при таком заболевании может быть обусловлен не столько воздействием чужеродного организма, сколько постоянными попытками организма изолировать и удерживать паразита с помощью механизмов ГЗТ. При таких заболеваниях, как оспа, корь, герпес, характерные экзантемы (кожная сыпь) частично связаны с реакциям ГЗТ на вирус, которые оказывают дополнительное деструктивное воздействие, приписываемое атакам цитотоксических С08+-Т-клеток на инфицированные вирусом эпителиальные клетки.
Реакция гиперчувствительности туберкулинового типа
Реакции туберкулинового типа являются кожными воспалительными реакциями, характеризующимися появлением плотного красного участка отека кожи, максимально выраженного спустя 48-72 ч после контакта. Название «туберкулиновый тип» появилось благодаря прототипной реакции ГЗТ, при которой липопротеиновый антиген, выделенный из М. tuberculosis и названный туберкулином, использовался в тесте, определяющем наличие предшествующего контакта организма с возбудителем туберкулеза. Важно отметить, однако, что растворимые антигены от других микроорганизмов (таких как М. leprae и Leishmania tropica) индуцируют такие же реакции ГЗТ туберкулинового типа. В настоящее время тесты на туберкулез делают путем внутрикожной инъекции более очищенного липопротеинового экстракта, выделенного из М tuberculosis и называемого очищенным протеиновым дериватом (purified protein derivative — PPD). Тест c PPD (также называемый пробой Манту) часто используют при обследовании населения на туберкулез. Если индивидуум уже был сенсибилизирован антигенами М. tuberculosis в результате инфицирования этим микроорганизмом, то в месте инъекции в течение 48-72 ч появится характерное повреждение туберкулинового типа. Реакция в виде эритемы (покраснение) и индурации (возвышающегося уплотнения), которые появляются после контакта, достигают максимума через 72 ч. Индурацию легко отличить от отека (скопления жидкости) по отсутствию углубления после надавливания. Эти реакции, даже весьма выраженные, редко ведут к некротическим повреждениям и медленно разрешаются. Биопсия, сделанная на ранней стадии реакции, выявляет преимущественно мононуклеарные моноцитарно-макрофагальные клетки с небольшим количеством рассеянных лимфоцитов. Характерно, что мононуклеарные инфильтраты появляются в виде периваскулярной муфты перед тем, как интенсивно заполнить место нахождения антигена. Нейтрофилы не являются характерными участниками ранних стадий реакции. Тяжелые формы реакции гиперчувствительности туберкулинового типа могут прогрессировать до гранулематозных реакций. Биопсия тканей в таких случаях выявляет более сложную картину, характеризующуюся появлением В-клеток и формированием гранулем в случаях хронических повреждений. Уплотнение ткани, или индурация, объясняется отложением фибрина в месте повреждения.
Хотя тест с PPD обычно очень надежен, в некоторых случаях встречаются ложноотрицательные и ложноположительные реакции. У людей с подавленным иммунитетом (например, у инфицированных ВИЧ или проходящих интенсивную химиотерапию) иногда отмечают ложноотрицательные реакции с PPD, что обусловлено невозможностью ответа со стороны антигенспецифичных Т-клеток (анергия).
В тех ситуациях, когда тест с PPD используется для определения, имел ли индивидуум ранее контакт с М. Tuberculosis, у людей, вакцинированных непатогенными аттенуированными штаммами микроорганизмов, вызывающих туберкулез у скота (а именно M.bovis — бациллами Кальметта-Герена (БЦЖ)), могут возникать ложноположительные реакции. Эффективность вакцины БЦЖ против легочного туберкулеза у человека сильно варьирует в различных популяциях. Основным объяснением этого различия считают взаимодействия между вакциной и микобактериями, характерными для конкретных условий, но точный механизм этого до сих пор не ясен. Во многих странах, включая США, не применяют повсеместную вакцинацию БЦЖ в связи с ее сомнительной эффективностью и указанным влиянием на результаты теста, проводимого для определения, был ли человек инфицирован М. Tuberculosis ранее.
Отторжение аллотрансплантата
Если индивидуум получает трансплантат в виде клеток, тканей или органов от аллогенного донора (генетически отличающийся индивидуум того же вида), то трансплантат обычно васкуляризируется и первоначально приживается. Однако если генетические отличия касаются каких-либо генов гистосовместимости, особенно генов МНС, наступает опосредованный Т-клетками процесс отторжения, продолжительность и интенсивность которого зависит от уровня несовместимости донора и реципиента. Первоначально вслед за васкуляризацией в трансплантат через стенки кровеносных сосудов проникает смешанная популяция антигенспецифичных Т-клеток и антигеннеспецифичных моноцитов. Эта воспалительная реакция вскоре приводит к разрушению сосудов, а отсутствие питательных веществ впоследствии вызывает и отторжение пересаженной ткани.
Другие примеры гиперчувствительности замедленного типа
Необычная форма реакции замедленного типа наблюдается у человека при повторных внутрикожных инъекциях антигена. Начало такой реакции отсрочено во времени (примерно на 24 ч); обычно оно представляет собой появление эритемы без индурации, типичной для реакций ГЗТ. После того как подобное состояние было изучено в эксперименте, обнаружили, что эритема сопровождалась появлением небольшого клеточного инфильтрата, но при этом доминирующим типом клеток были базофилы. Опыты на морских свинках показали, что реакция была в основном опосредована Т-клетками и была связана с МНС-рестрикцией, как и классические реакции, опосредованные Т-клетками. При наличии классической ГЗТ, однако, инфильтратов из базофилов не наблюдалось. Таким образом, кожная базофильная гиперчувствительность считается вариантом реакций, опосредованных Т-клетками, но ее точный механизм неизвестен. Общая картина осложнилась еще больше, когда оказалось, что в некоторых условиях базофильную реакцию способен вызывать пассивный перенос сыворотки крови.
Физиологическое значение кожной базофильной гиперчувствительности оставалось тайной, пока не обнаружилось, что у морских свинок, укушенных определенным видом клещей, развивались тяжелые кожные реакции базофильной гиперчувствительности в месте прикрепления насекомого. Базофильная инфильтрация и, вероятно, высвобождение медиаторов воспаления из их гранул приводили к смерти клеща и его отделению от животного. Таким образом, кожная базофильная гиперчувствительность может быть важна при определенных формах иммунного ответа к паразитам. Позднее базофильные инфильтраты были также обнаружены в случаях контактного дерматита, вызванного аллергенами, например от ядовитого плюща, а также в случаях отторжения почечных трансплантатов и при некоторых формах конъюнктивитов. Эти наблюдения свидетельствуют о том, что базофилы могут также играть роль при некоторых типах заболеваний, ассоциированных с ГЗТ.
Другими примерами ГЗТ являются реакции на аутоантигены при определенных аутоиммунных заболеваниях. Как и при хронических инфекциях, которые могут вызвать хронические реакции ГЗТ, эти реакции часто бывают хроническими и являются результатом продолжающейся активации клонов аутореактивных ТН1-клеток. В качестве примеров аутоиммунных заболеваний, в которые вовлечены реакции ГЗТ, можно назвать ревматоидный артрит, диабет I типа и рассеянный склероз.
Терапия гиперчувствительности, опосредованной Т-клетками, связана с типом ГЗТ. В большинстве случаев реакции ГЗТ, такие как контактный дерматит и реакции туберкулинового типа, проходят спустя определенный период, длящийся от нескольких дней до нескольких недель от момента устранения антигена. Исключительно эффективным для этих форм ГЗТ является местное или системное применение кортикостероидов. При более тяжелых видах ГЗТ, таких как вызванная патогеном гранулематозная гиперчувствительность, отторжение аллотрансплантата и тех, которые наблюдаются при некоторых аутоиммунных заболеваниях, обычно используется более агрессивная форма иммуносупрессивной терапии, включающая применение таких лекарственных средств, как азатиоприн или циклоспорин.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии