Подклапанный стеноз аорты: диагностика, лечение, рекомендации врачей
Субаортальный стеноз представляет собой полиморфное подклапанное сужение выводного тракта левого желудочка, чаще всего в виде дискретной мембранозной диафрагмы или фиброзного кольца, реже он образован мышечной или фиброзной тканью, исходящей из мембранозной перегородки, митрального и трехстворчатого клапанов. Этот порок имеет врожденное происхождение, однако редко наблюдается у новорожденных.
Частота
По данным различных авторов, органический субаортальный стеноз встречается довольно часто и составляет от 1 до 1,5 % всех ВПС и 10-31,2 % всех случаев врожденных стенозов устья аорты. У мужчин наблюдается в два раза чаще, чем у женщин.
Этиология
Этиология дискретного субаортального стеноза окончательно не выяснена. Существует несколько гипотез, включая генетическую наследственность, травматизирующее воздействие кровотока на ткани выводного тракта левого желудочка и последствия кардиохирургических вмешательств.
В пользу гипотезы о передаче порока по наследству свидетельствуют исследования Pyle и соавторов, изучивших развитие субаортального стеноза у популяции собак породы «ньюфаундленд». Было выявлено появление и прогрессирование этой аномалии у щенков в возрасте от 3 нед до 6 мес, причем у собак она никогда не была диагностирована при рождении. Гистологические исследования показали пролиферацию эмбриональных тканей в зоне обструкции. Таким образом, этими авторами была описана как наследственная предрасположенность к формированию субаортального стеноза, так и клинико-анатомическое прогрессирование порока со временем. Семейный характер порока отмечали некоторые авторы, подчеркивая аутосомальный доминантный тип наследования.
Ряд авторов придерживаются теории о том, что развитие субаортального стеноза является следствием врожденной аномалии тканей выводного тракта левого желудочка. Серийные катетеризации подтверждают прогрессирование порока. Обследования членов многодетных семей не выявили случаев его наследственной связи, тем не менее, субаортальный стеноз, наряду с парашютообразным митральным клапаном, надклапанным митральным стенозом и коарктацией аорты входит в синдром Shone. Описано также его сочетание с туберозным склерозом.
По мнению Банкла, порок возникает в области перехода от луковицы сердца к артериальному стволу. Его формированию способствует травматизация кровотоком тканей в зоне выводного тракта левого желудочка и их дальнейшее воспаление, пролиферация и развитие фиброза. Эту же гипотезу поддерживают Gewilling и соавторы. Анатомической предпосылкой является удлиненный или гипоплазированный выводной тракт левого желудочка. Даже после операции сохраняется анатомический субстрат для рецидива — в виде выступа, валика или других неровностей эндотелия на межжелудочковой перегородке, создающих завихрения кровотока в выводном тракте желудочка. Цветная допплерография, позволяющая визуализировать кровоток, убедительно демонстрирует, что турбулентные завихрения крови имеются не только дистальнее зоны стенозирования, но и проксимальнее ее.
Возникновению и развитию субаортального стеноза способствуют и особенности конфигурации выводного тракта левого желудочка: увеличенный аортоперегородочный угол и удлиненный митрально-аортальный контакт. Выступающая левосторонняя вентрикулоинфундибулярная складка иногда дополняет морфологический субстрат субаортального стеноза, способствуя удлинению и сужению выводного тракта левого желудочка. Эта область опасна для резекции, так как можно оказаться вне сердца. Обструкция может сформироваться как до операции по поводу основной патологии, так и после нее.
В пользу приобретенной природы порока свидетельствует отсутствие существенной подклапанной обструкции в грудном возрасте. Кроме того, в абсолютном большинстве сообщений субаортальный стеноз в возрасте до 3 лет встречается только как аномалия, сопутствующая другим порокам, которые в целом и определяют нарушения гемодинамики. Если изолированный субаортальный стеноз и встречается в грудном возрасте, то, как правило, он имеет незначительный градиент систолического давления и не требует оперативного лечения. Однако обструкция постепенно прогрессирует и становится более выраженной в детском и подростковом возрасте. Так, Leichter и соавторы на примере 35 больных, наблюдаемых в динамике на протяжении от 3 мес до 19 лет, установили существенное прогрессирование субаортального стеноза. По данным первичной катетеризации, у них не было гемодинамически значимого градиента систолического давления в выводном тракте левого желудочка, а при повторной катетеризации выявлен существенный градиент систолического давления — от 30 до 135 мм рт. ст. Есть доказанные примеры проявления подклапанного сужения через несколько лет после предшествующего инвазивного исследования в детском возрасте, проведенного перед коррекцией коарктации аорты.
Выявлена связь возникновения и прогрессирующего развития субаортального стеноза с предшествующим кардиохирургическим лечением с манипуляциями в области выводного тракта левого желудочка. При обследовании больных после закрытия дефектов перегородок необходимо тщательное исследование выводного тракта левого желудочка. В ряде случаев субаортальный стеноз возникает и прогрессирует без видимых причин.
Таким образом, субаортальный стеноз является полиэтиологическим заболеванием, но наиболее часто он проявляет себя как врожденный порок с приобретенными изменениями. Cape и соавторы описали 4 связанных между собой механизма развития субаортального стеноза:
-
морфологические изменения;
-
повышение напряжение сдвига;
-
генетическая предрасположенность;
-
клеточная пролиферация в ответ на напряжение сдвига.
Анатомия
Фиксированный субаортальный стеноз проявляется в различных анатомических вариантах. Классификация порока была разработана Kelly и соавторами. Ими были выделены 3 основных анатомических типа субаортального стеноза:
1. Мембранозно-диафрагмальный. Стенозирующим элементом являлась циркулярная фиброзная мембрана с центрально расположенным отверстием диаметром 0,5-1,5 см;
2. Фиброзно-мышечный воротник. Характерно валикообразное фиброзное утолщение, располагающееся на 0,5-2 см ниже створок аортального клапана и охватывающее выводной отдел левого желудочка в виде циркулярного вала;
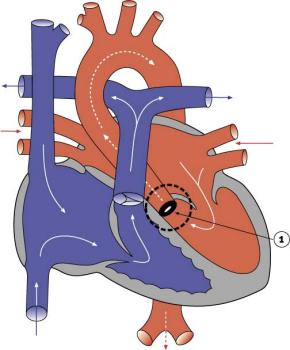
3. Фиброзно-мышечный туннель. Стенозирующая основа — локализованное образование в виде толстой фиброзно-мышечной складки, располагающейся на 1-3 см ниже клапанного кольца и охватывающей выводной отдел левого желудочка полукольцом наподобие воротника. Этот тип порока нередко сопровождается гипертрофией межжелудочковой перегородки.
Из-за трудности дифференцировать два первых типа субаортального стеноза по данным ангиокардиографии, ряд авторов подразделяют органический субаортальный стеноз по особенностям морфологической структуры на два типа стеноза, условно называемые «ограниченный» и «диффузный».
Ограниченный стеноз чаще бывает «мембранозным» и характеризуется наличием в выводном отделе левого желудочка тонкой фиброзной циркулярной мембраны, имеющей одно или несколько отверстий, или серповидной фиброзной складки, закрывающей 2/3 выводного отдела левого желудочка. Мембрана обычно расположена непосредственно под фиброзным кольцом аорты или чуть ниже, но не более чем на 2 см. Одним краем она прикрепляется вдоль основания передней створки митрального клапана, а другим — к межжелудочковой перегородке под некоронарной и правой коронарной створками аортального клапана.
Другой вариант ограниченного субаортального стеноза, получивший название «фибромускулярный», представлен циркулярным фиброзно-мышечным воротником. Сужение располагается на 1-3 см ниже клапанного кольца аорты, имеет контакт с передней створкой митрального клапана и охватывает выводной отдел левого желудочка в виде циркулярного или полулунного валика. Протяженность сужения может достигать 2-3 см. При этом варианте стеноза нередко наблюдаются умеренная гипоплазия корня аорты и фиброзное утолщение створок клапана.
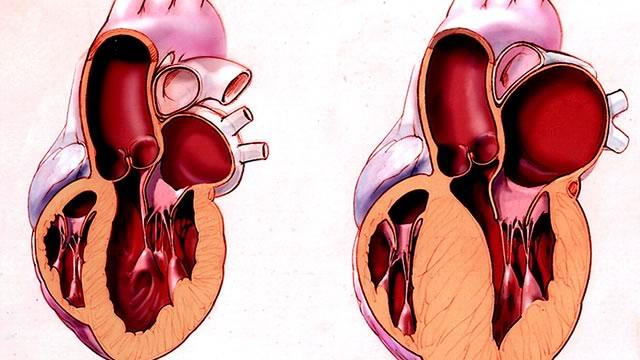
Диффузный субаортальный стеноз, или фиброзно-мышечный туннель, является крайней степенью предшествующей формы. Отмечается резкая гипертрофия мышц выводного отдела левого желудочка. Слой фиброзной ткани простирается от кольца аортального клапана к передней створке митрального клапана, а также книзу вдоль септальной и париетальной стенок желудочка. Этот тип порока нередко сопровождается существенной гипертрофией межжелудочковой перегородки. Диаметр просвета тубулярного канала уменьшен из-за значительного утолщения фиброзных наслоений. Протяженность суженного сегмента составляет от 1 до 3 см.
Диффузный субаортальный стеноз необходимо дифференцировать с обструктивной формой гипертрофической кардиомиопатии. Патогенез ее еще не совсем ясен. Кроме того, гемодинамически выраженные, своевременно не оперированные дискретные стенозы обоих типов осложняются вторичной гипертрофией миокарда левого желудочка такой выраженности, что внешне напоминают гипертрофическую кардиомиопатию с мышечной обструкцией выводного тракта левого желудочка. При этом часто наблюдается сочетание субаортального стеноза с гипоплазией фиброзного кольца аорты, поэтому для коррекции такого порока необходима не только резекция участка стенозирования, но и расширение корня аорты.
Другие анатомические формы субаортального стеноза
Формирование обструкции за счет аномалии прикрепления и развития створок митрального клапана встречается довольно редко, но спектр морфологии описанных вариантов аномалии очень широк. К стенозированию выводного тракта левого желудочка могут привести различные аномалии митрального клапана. Среди них:
-
аномальное прикрепление передней створки митрального клапана непосредственно к межжелудочковой перегородке;
-
наличие дополнительной ткани на митральном клапане, которая выбухает в субаортальную область и образует препятствие;
-
изолированное расщепление передней створки митрального клапана с дополнительными сухожильными нитями, внедряющимися в межжелудочковую перегородку;
-
«парашютная» деформация митрального клапана;
-
удвоенный митральный клапан.
Обструкцию выводного тракта левого желудочка может вызывать ткань, исходящая из мембранозной перегородки или трехстворчатого клапана, грыжеобразно выдающаяся в выводной тракт левого желудочка через ДМЖП. Это чаще наблюдается после суживания легочной артерии.
При ДМЖП, образовавшемся вследствие отсутствия соосности между основной частью перегородки и конусной перегородкой, может образоваться субаортальный гребень, который вдается в подклапанное пространство, создавая препятствие току крови. При смещении основной части межжелудочковой перегородки кпереди образуется дефект и нависание аорты. Смещение конусной перегородки кзади приводит к образованию дефекта и субаортального сужения.
В клинической практике встречаются случаи обструкции выводного тракта левого желудочка у новорожденных за счет рабдомиом. Изредка обструкция может быть обусловлена атипичными мышечными трабекулами.
Некомпетентность аортального клапана является вторичным прогрессирующим пороком. Поток крови, проходящий через зону стеноза, изменяет скорость и становится турбулентным высокоскоростным, вызывает травматизацию створок аортального клапана, их утолщение и потерю эластичности. Аортальный клапан, как правило, трехстворчатый, утолщен, диаметр аортального кольца может быть меньше, чем в норме. Вторичное повреждение створок, обусловленное субаортальным стенозом, приводит к гемодинамически значимой аортальной недостаточности, в основном, у старших пациентов. Величина сопутствующей аортальной недостаточности достигает 81%, однако степень ее относительно невысока и варьирует от небольшой до умеренной.
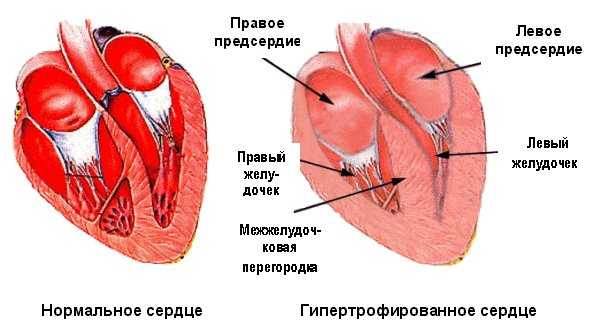
Физиологической реакцией левого желудочка на увеличенную посленагрузку является его гипертрофия, степень которой находится в прямой зависимости от стенозирования. Нарастает несоответствие между потребностью гипертрофированного миокарда в кислороде и его доставкой. Гипертрофия левого желудочка у больных с субаортальным стенозом из физиологической превращается в патологическую. При избыточной гипертрофии нарастающая ишемия миокарда приводит к гибели части кардиомиоцитов и замещению их соединительной тканью. Избыточная гипертрофия левого желудочка сопровождается субэндокардиальной ишемией миокарда, которая является причиной фатальных нарушений ритма и инфарктов миокарда. У больных, умерших от миокардиальной недостаточности, на вскрытии выявляется выраженный миокардиофиброз, обусловливающий нарушение сократительной функции миокарда. Выраженная гипертрофия левого желудочка чаще встречается у больных старшей возрастной группы.
Thilenius и соавторы показали, что у 30% больных субаортальным стенозом в встречается гипоплазия клапанного кольца аорты с различными аномалиями створок аортального клапана. Отношение клапанного кольца к диаметру нисходящей аорты у больных с субаортальным стенозом меньше, чем в норме.
Сопутствующие пороки
Субаортальный стеноз часто сочетается с другими пороками: двустворчатым артериальным клапаном, клапанным стенозом аорты, коарктацией аорты, ОАП, ДМЖП, тетрадой Фалло и полным АВСД. Спектр сопутствующих аномалий зависит от возраста больного. Castaneda и соавторы у 105 из 119 больных детей младшего возраста выявили сочетание субаортального стеноза с коарктацией и полным перерывом дуги аорты, ДМЖП, полным АВСД и синдромом Shone. По данным Затикян, у 20% детей с субаортальным стенозом встречаются сопутствующие пороки.
У половины больных с фиксированной формой субаортального стеноза имеет место прогрессирующая недостаточность аортального клапана. Одним из механизмов ее возникновения является постоянная травма подклапанных структур струей крови из стенозированного отверстия в начале систолы. Второй предполагаемой причиной служит деформация створок вследствие распространения фиброэластической ткани из места дискретного стеноза на основание или выше основания створок. При этом с увеличением расстояния от клапана до диафрагмы увеличивается вероятность аортальной недостаточности.
Гемодинамика
Нарушение гемодинамики при изолированной форме субаортального стеноза обусловлено препятствием на пути поступления крови из левого желудочка в аорту, в результате чего между ними возникает градиент систолического давления. Выраженность стеноза является основным фактором, определяющим тяжесть гемодинамических расстройств и клиническое течение заболевания. Гемодинамические изменения в основном аналогичны таковым при изолированном клапанном стенозе аорты, но градиент систолического давления возникает внутри самого желудочка. Струя крови проходит из проксимальной камеры левого желудочка через суженное отверстие в добавочную камеру, расположенную между стенозирующим образованием и створками аортального клапана. Однако между двумя формами стеноза аорты есть и отличия. Гетманский в 1984 г. установил, что градиент систолического давления в группе больных с субаортальным стенозом меньше, чем при клапанной форме стеноза аорты. В то же время конечно-диастолическое давление в левом желудочке больше, поэтому компенсаторные возможности левого желудочка истощаются быстрее, и сократительная способность миокарда снижается раньше.
Основным механизмом компенсации, обеспечивающим системное кровообращение, является повышение давления в левом желудочке, которое может достигать 200-250 мм рт. ст. Однако длительная гиперфункция левого желудочка, способствующая гипертрофии миокарда, постепенно приводит к истощению компенсаторных механизмов. Главная роль в этом процессе принадлежит деструктивным изменениям в гипертрофированном миокарде, функционирующем в условиях относительной недостаточности коронарного кровотока. Нарушение сократительной способности миокарда обусловливается миогенной дилатацией сердца, возрастанием конечно-диастолического давления в желудочке. Постепенно увеличивается давление в левом предсердии и в малом круге кровообращения, т.е. возникает клиническая картина левожелудочковой недостаточности. В этой стадии левый желудочек уже не может выполнять достаточную работу по преодолению сопротивления стеноза и обеспечению должного сердечного выброса крови.
По данным ЭКГ и ЭхоКГ, гипертрофия левого желудочка чаще выявляется при выраженной обструкции и реже — при умеренной. Кроме того, существует аналогичная зависимость и от длительности заболевания. Избыточная гипертрофия левого желудочка сопровождается субэндокардиальной ишемией миокарда, которая является причиной клинических проявлений. В дальнейшем прогрессирующий миокардиофиброз приводит к нарушению сократительной функции миокарда и миокардиальной недостаточности. Наличие гипертрофии левого желудочка является неблагоприятным прогностическим признаком. Риск развития декомпенсации кровообращения в 3-4 раза выше у лиц с индексом массы миокарда свыше 116 г/м2, чем при ИММ меньше 75 г/м2. В ряде исследований было показано, что гипертрофия левого желудочка является предвестником сердечно-сосудистых осложнений и внезапной смерти. Guarini и соавторы показали, что в течение 12-летнего периода наблюдений 31% больных с артериальной гипертензией и гипертрофией левого желудочка находились в I или II функциональном классе NYHA, 69% — в III или IV классе. Поэтому своевременная диагностика гипертрофии левого желудочка, особенно на начальных стадиях, когда она еще обратима, крайне важна.
О гемодинамической значимости субаортального стеноза можно судить не только по таким показателям, как толщина стенок и масса миокарда левого желудочка. У клинически компенсированных пациентов с гемодинамически значимым субаортальным стенозом обычно выявляется повышение его компенсаторной сократимости.
Клиника
У новорожденных и детей раннего возраста субаортальный стеноз в изолированном виде практически не встречается и проявляется только в возрасте после одного года жизни. В раннем возрасте в большинстве случаев он встречается как сопутствующая патология и клиника заболевания «маскируется» основным пороком. У более взрослых детей и у некоторых взрослых даже выраженный стеноз может протекать бессимптомно. Основными жалобами больных являются: одышка, повышенная утомляемость, боли в области сердца. Последние, как правило, наблюдаются у больных старшего возраста и обусловлены относительной коронарной недостаточностью. Одна из клинических особенностей порока — обморочные состояния, которые наблюдаются у 27,2% больных. Обмороки следует расценивать как плохой прогностический признак, являющийся абсолютным показанием к операции.
Резкий субаортальный стеноз у детей проявляется бледностью, одышкой, плохим аппетитом.
Также может иметь место акроцианоз. В подростковом возрасте и у взрослых больных клиническая картина более выражена, обычными являются жалобы на одышку и быструю утомляемость при небольшой физической нагрузке, боли в области сердца; часто возникают приступы сердцебиений, нередко сопровождающиеся потерей сознания.
Диагностика
Выбор метода лечения и результаты хирургической коррекции субаортального стеноза во многом зависят от точности дооперационной диагностики форм и типа стеноза, правильной оценки степени выраженности порока, внутрисердечной гемодинамики, ангиокардиографической и ЭхоКГ-анатомии и функционального состояния миокарда левого желудочка. Именно поэтому уделяется большое внимание всем диагностическим методам, несущим объективную информацию о морфологических и функциональных изменениях сердца.
При объективном исследовании характерными особенностями субаортального стеноза, как и клапанного стеноза аорты, являются усиленный приподнимающийся верхушечный толчок, несоответствие между ним и редким малым пульсом. У всех больных выслушивается звучный систолический шум над основанием сердца или в III межреберье слева с иррадиацией на шею и в яремную ямку. Характерно систолическое дрожание над сонными артериями, периферический пульс не ослаблен. Систолическое дрожание над сонными артериями является важным признаком для дифференциальной диагностики субаортального стеноза и пороков, дающих выраженный систолический шум. При объективном исследовании можно отметить отличительный признак субаортального стеноза — отсутствие характерно для клапанного стеноза аорты систолического щелчка на верхушке сердца.
У 65% пациентов выслушивается также невыраженный диастолический шум, который является следствием вторичного процесса поражения створок аортального клапана и формирования аортальной недостаточности.
-
Рентгенография.
Специфических признаков субаортального стеноза на рентгенограмме нет. При выраженном стенозе на рентгенограмме наблюдается расширение контура левого желудочка и сердце имеет аортальную конфигурацию с резко выраженной «талией». Кардиоторакальный индекс сравнительно небольшой: 46-62,5%, что объясняется поворотом сердца во фронтальной плоскости. При этом гипертрофированный левый желудочек смещается вправо и вперед, проецируется на переднюю поверхность сердца, мало или совсем не изменяя его поперечные размеры.
Восходящая аорта обычно не расширена в связи с тем, что уровень обструкции при субаортальном стенозе расположен ниже, чем при клапанном аортальном стенозе. Трансстенотический поток крови попадает в восходящую аорту с частично угасшей линейной скоростью.
-
Фонокардиограмма.
На ФКГ во всех случаях фиксируется высокоамплитудный систолический шум изгнания, возникающий вследствие сужения устья аорты. Он имеет четкую ромбовидную форму. Максимум шума определяется во II межреберье справа от грудины или нередко в яремной ямке, однако шум хорошо проводится и в другие точки сердца, на сосуды шеи и на спину при резких степенях порока. Шум начинается за I тоном и заканчивается ко II тону, имеет голосистолический характер. При оценке степени сужения устья аорты учитывается амплитуда шума: чем она больше, тем значительнее выражен порок. Следует также обращать внимание на положение пика шума. При умеренных степенях стеноза он расположен в первой половине или середине систолы, при резких — ближе ко II тону, что связано с более медленным подъемом давления в левом желудочке. При резком стенозе аорты с градиентом систолического давления более 80 мм рт. ст. пик шума располагался во второй половине систолы, примыкая ко II тону. На основании этого признака можно предположить величину ГСД между левым желудочком и аортой.
Следует обращать также внимание на сохраненный II тон, так как клапан аорты не изменен. Еще одним отличием ФКГ при субаортальном стенозе является отсутствие систолического тона изгнания, который есть при умеренном клапанном стенозе аорты и связан с ударом струи крови в стенку постстенотически расширенной аорты в фазе быстрого изгнания. При субаортальном стенозе турбулентный поток крови попадает в восходящую аорту с угасшей линейной скоростью и не вызывает данного феномена.
Электрокардиограмма при субаортальном стенозе отражает в основном те же особенности гемодинамических нарушений, что и при клапанном стенозе аорты. При небольших субаортальных стенозах ЭКГ остается нормальной, а при выраженной обструкции появляются признаки гипертрофии левого желудочка, что и является основным проявлением порока. Наиболее широко для оценки гипертрофии левого желудочка используется ЭКГ, однако по чувствительности она в 5-10 раз уступает ЭхоКГ. По сравнению с данными ЭхоКГ чувствительность ЭКГ-признака гипертрофии левого желудочка Соколова-Лайона составляет 30-43%, а корнельского признака — 28-45%. Индекс информативности 16 изученных критериев гипертрофии левого желудочка варьирует от 0,15 до 0,59. Тем не менее на ЭКГ всегда наблюдается типичная комбинация признаков гипертрофии левого желудочка при ММ более 200 г или ИММ > 100 г/м2.
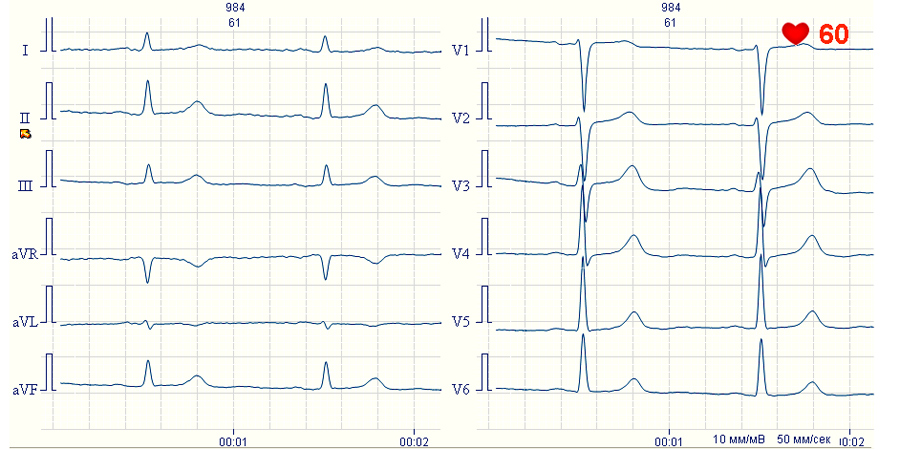
При сопоставлении изменений ЭКГ с величиной ГСД между ними выявлена прямая зависимость. До настоящего времени наиболее распространенным и доступным методом диагностики гипертрофии левого желудочка является ЭКГ в 12 общепринятых отведениях. В литературе описано более 30 критериев гипертрофии левого желудочка, обладающих достаточно высокой специфичностью, но относительно низкой чувствительностью. Для повышения чувствительности ЭКГ, без существенной потери ее специфичности, были предложены различные комплексы диагностических признаков гипертрофии левого желудочка.
Дечко считает, что использование ЭКГ-критериев Соколова-Лайона позволяет выявить гипертрофию левого желудочка у 45-61% больных, при этом ложноположительные результаты составляют 11-23% и ЭхоКГ имеет явное преимущество в диагностики гипертрофии левого желудочка, особенно на начальной ее стадии.
-
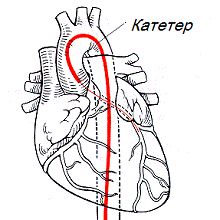
Катетеризация сердца и ангиография.
Долгие годы основным и единственным методом диагностики субаортального стеноза была катетеризация сердца и ангиокардиография. Если фиброзная диафрагма находится сразу же под аортальным клапаном, ГСД может регистрироваться непосредственно на клапане, что затрудняет дифференциальную диагностику субаортального стеноза и клапанного аортального стеноза.
Ангиокардиографическая картина при первых двух типах порока характеризуется наличием дефекта наполнения в виде поперечного тяжа, расположенного в выводном отделе левого желудочка на 0,5-2 см ниже клапанного кольца. При третьем типе субаортального стеноза обструкция контрастируется в виде пирамиды, расположенной на 1-3 см ниже створок аортального клапана. Обнаружение ГСД при переходе зонда из левого желудочка в подклапанную зону — бесспорное подтверждение наличие субаортального стеноза.
Для фиброзного типа субаортального стеноза характерно наличие светлой поперечной полосы по всей окружности выводного тракта левого желудочка в виде кольца шириной до 2-3 мм, на большем расстоянии от дна аортального клапана. При этом типе отчетливо выявляется подклапанный карман или «второй желудочек» между суживающим фиброзным кольцом и аортальным клапаном. Для фибромускулярного типа субаортального стеноза характерны неравномерные краевые дефекты наполнения в выводном тракте левого желудочка в виде гребнеподобных выступов. В последние годы инвазивные методы диагностики применяются все реже, и необходимость в их использовании возникает только при сложных сочетанных аномалиях. Основная роль в предоперационной диагностике субаортального стеноза отводится ЭхоКГ.
-
Эхокардиография.
Эхокардиография совершила революцию в диагностике дискретного субаортального стеноза. Этот метод позволяет получить всю необходимую информацию о внутрисердечной анатомии, так что в большинстве случаев отпадает необходимость в катетеризации сердца. ЭхоКГ дает возможность с максимальной точностью оценить размер левого желудочка и кольца аортального клапана, степень подклапанного сужения выводного тракта левого желудочка, его размер, уровень и протяженность стеноза, а также ГСД на уровне стеноза. Исследования возможности ультразвуковой диагностики субаортального стеноза начались еще с середины 70-х годов.
Такие классические ЭхоКГ-признаки наличия обструкции выводного тракта левого желудочка, определяемые в одномерном режиме, как раннее систолическое прикрытие аортального клапана и высокочастотное трепетание створок аортального клапана в систолу, являются неспецифическими и не могут определять тип субаортальной обструкции. Кроме субаортального стеноза, они встречаются и при других нарушениях гемодинамики. Диагностическая ценность этого симптома несомненна — он имеет огромное значения для предварительной диагностики субаортального стеноза.
Двухмерная ЭхоКГ расширила возможности метода в определении места и вида обструкции. Левая парастернальная и апикальная позиции в сечении по длинной оси позволяют хорошо визуализировать выводной тракт левого желудочка. При индивидуальном подборе сечений удается непосредственно лоцировать субаортальный стеноз и определить его анатомию. Данные ЭхоКГ хорошо коррелируют с данными инвазивных методов диагностики.
Выраженность ГСД является основным фактором, определяющим тяжесть гемодинамических расстройств и клиническое течение заболевания. Еще до широкого применения допплер-ЭхоКГ для определения ГСД были предложены расчеты ГСД по ЭхоКГ-показателям морфометрии левого желудочка, однако они не нашли широкого применения, несмотря на неплохую корреляцию с данными инвазивных исследований.
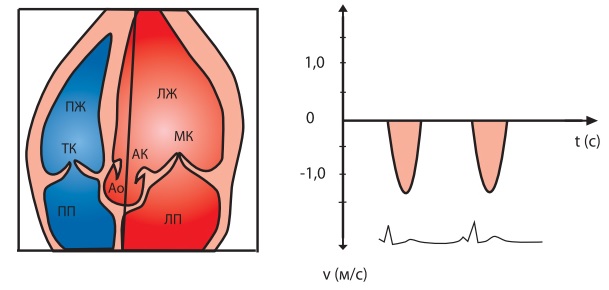
Градиент систолического давления традиционно определяли при катетеризации сердца. По величине ГСД больные распределены на 3 клинические группы:
-
I — с умеренным субаортальным стенозом;
-
II — с выраженным субаортальным стенозом;
-
III — с резким субаортальным стенозом.
При импульсной допплер-ЭхоКГ можно определить скорость кровотока в небольшом «контрольном объеме». Возможность измерения высоких скоростей в области обструкции ограничена максимально возможной частотой повторения импульсов в используемой аппаратуре. Максимальная скорость кровотока, или черта Найквиста, была равна 2 м/с, или, в перерасчете согласно уравнению Бернулли, — 16 мм рт. ст. При нахождении «контрольного объема» в зоне потоков со скоростью выше черты Найквиста наблюдался aliasing эффект — искажение допплеровского спектра с появлением сигнала, направленного в противоположную сторону от реального.
Непрерывная допплер-ЭхоКГ открыла новые возможности предоперационной неинвазивной диагностики субаортального стеноза, позволяющей оценить его степень и показания к операции. Непрерывный режим давал возможность измерить скорость кровотока до 8 м/с, или, в перерасчете на ГСД, — 256 мм рт. ст..
Количественная оценка тяжести субаортального стеноза с помощью допплер-ЭхоКГ — одна из самых эффективных областей применения метода. При непрерывной допплер-ЭхоКГ для измерения ГСД между левым желудочком и аортой необходимо направить ультразвуковой луч точно по потоку стенотической струи. Поэтому у каждого пациента следует искать стенотическую струю из нескольких доступов: апикального, супрастернального и правого парастернального. Поток через зону обструкции может быть эксцентричным, и заранее невозможно предсказать, какая позиция датчика будет оптимальной для расчета ГСД. Неточная ориентация ультразвукового луча приводит к недооценке тяжести субаортального стеноза. Наибольшую скорость кровотока через субаортальный стеноз обычно удается зарегистрировать при исследовании из апикального или супрастернального доступа.
Градиент систолического давления, определяемый при катетеризации сердца, не полностью соответствует ГСД, вычисляемому при допплер-ЭхоКГ. Скорость кровотока через аортальный клапан, превышающая 4 м/с, указывает на выраженный аортальный стеноз; скорости ниже 3 м/с — на нетяжелый стеноз, поэтому при субаортальном стенозе допплер-ЭхоКГ должна давать более высокие значения максимального ГСД между левым желудочком и аортой, чем катетеризация полостей сердца.
Градиент систолического давления, определенный при допплер-ЭхоКГ, в среднем превышает таковой, определенный при катетеризации, на 6,7 мм рт. ст. При небольшой степени стеноза расхождения между ГСД могут достигать 50%, а при выраженном стенозе при ГСД 100 мм рт. ст. ошибка не превышает 7 %. Тем не менее многие авторы демонстрируют очень высокую корреляцию мак симальных ГСД, определенных при допплер- ЭхоКГ и при катетеризации полостей сердца у больных со стенозами устья аорты.
В настоящее время ЭхоКГ имеет всеобщее признание в качестве наиболее точного метода диагностики и оценки степени гипертрофии левого желудочка, особенно в повседневной клинической практике. Наиболее простой метод выявления гипертрофии левого желудочка — измерение в одномерном режиме толщины межжелудочковой перегородки и задней стенки в диастолу. О наличии гипертрофии левого желудочка говорят при толщине стенок более 1,1 см в диастолу. Однако использование линейных размеров толщины стенок сердца может привести к неправильной оценки наличия и степени гипертрофии левого желудочка, так как у одного и того же человека толщина стенок сердца зависит от диастолического наполнения левого желудочка. При сниженном диастолическом наполнении толщина стенок может превышать норму при нормальной ММ, и наоборот, при дилатации левого желудочка стенки остаются тонкими даже при выраженном увеличении ММ.
В основном и по настоящее время для расчета ММ в одномерном режиме используется формула Devereux и Reichek, которая была выведена на основании сопоставления результатов ЭхоКГ с данными ангиокардиографии и аутопсии. Многочисленные исследования информативности одномерной ЭхоКГ для определения ММ обнаружили высокую корреляцию данных ЭхоКГ с инвазивными методами исследования и патологоанатомическими данными.
При расчете ММ в одномерном режиме необходимо помнить о неизбежности возникновения погрешности в измерении толщины стенок левого желудочка и его конечно-диастолического размера, которые используются в расчетах ММ. Следует учесть, что при применении формулы «возведения в куб» даже небольшая погрешность в измерении исходных параметров приводит к «кубическому» увеличению ошибки в расчете ММ. Вследствие этой погрешности ММ, рассчитанная по одномерной ЭхоКГ, может варьировать в пределах 8±3,5 г. Возможные погрешности расчетов ММ необходимо принимать во внимание при оценке отдаленных результатах лечения. Различия значений ММ у одного больного, рассчитанные в разное время, могут ошибочно трактоваться как динамика показателя.
Сравнение показателей ИММ до и после протезирования аортального клапана по поводу стеноза аорты или пересадки почки у больных с артериальной гипертензией свидетельствуют о значительном снижения ММ. Однако говорить о регрессии или о прогрессе ММ можно только в том случае, если динамика этого показателя будет превышать 10%, или 10 г/м2. В основном динамика ММ и гипертрофии левого желудочка исследована для оценки результатов терапевтического лечения гипертонической болезни, и этот вопрос наиболее изучен в данной области.
Вопросы регрессии ММ и степени гипертрофии левого желудочка у больных с субаортальным стенозом после кардиохирургического лечения недостаточно освещены в литературе. Неясны сроки, в течение которых происходит достоверная регрессия гипертрофии левого желудочка, не установлена зависимость степени регрессии гипертрофии левого желудочка от изначальной степени его гипертрофии. Неизвестно, происходит ли обратное развитие ММ у больных с выраженной степенью гипертрофии левого желудочка, с большим «стажем» порока и миокардиофиброзом.
Расчет ММ, так же как и объемов левого желудочка, следует проводить только по данным двухмерного режима. Принцип всех формул одинаков: из общего объема левого желудочка вычитают конечно-диастолический объем и получают объем миокарда. Расчеты ММ в двухмерном режиме ММ показали более высокую корреляцию с инвазивными методами по сравнению с одномерным режимом, так как учитываются все индивидуальные особенности геометрии левого желудочка. Расчет ММ в двухмерном режиме более сложен и трудоемок. Однако учитывая, что левый желудочек у больных с субаортальным стенозом имеет правильную геометрическую форму, симметричную гипертрофию и не нарушенную секторальную сократимость, вполне допустимо применение для этих целей и одномерного режима под контролем двухмерной ЭхоКГ.
До сих пор нет единого мнения о том, при каких значениях ММ уже можно говорить о гипертрофии левого желудочка. Была выявлена зависимость ММ от возраста, пола, роста и массы тела и даже от расы человека. При перерасчете ММ на площадь поверхности тела и выражении этого показателя в виде ИММ индивидуальные различия в определенной степени нивелируются. В норме ИММ составляет < 100 г/м2.
Несмотря на то, что информативность методов расчетов объемов левого желудочка и фракция выброса, особенно по двухмерной ЭхоКГ, несколько выше, чем по наиболее распространенному одномерному ЭхоКГ-методу Teichholz, в современной литературе по-прежнему широко встречаются исследования как морфометрии левого желудочка и его гемодинамики, так и расчеты показателей гипертрофии левого желудочка, основанные на простом и удобном для повседневного практического применения методе одномерной ЭхоКГ.
Метод тканевого допплеровского исследования — это новая ЭхоКГ-технология исследования сократимости миокарда и скорости его сокращения. В последнее время широко применяется для изучения общей и секторальной сократимости левого желудочка. Однако проведенные зарубежными авторами сравнительные исследования максимальной скорости сокращения миокарда, определенной классическим одномерным методом и при ТДИ у здоровых лиц, тесно коррелируют между собой. В тех случаях, когда отсутствует нарушение сократительной способности миокарда, преимуществ у метода ТДИ перед одномерным режимом нет.
Естественное течение
В большинстве сообщений указано, что возраст больных с субаортальным стенозом не превышает 18 лет. Еще в 1959 г. Brock предположил, что субаортальный стеноз — порок, который без лечения заканчивается летально еще в подростковом возрасте. После 35 лет он встречается редко, так как быстро прогрессирует, без операции до этого возраста доживают только отдельные больные или же сам порок приобретает черты вторичной гипертрофической кардиомиопатии с миокардиальной недостаточностью. Тем не менее, Sung и соавторы сообщают данные о достаточно большой группе взрослых пациентов — 36 из 138 больных с субаортальным стенозом: 30 человек были в возрасте от 18 до 50 лет и 6 — от 50 до 65 лет. В опубликованных сериях хирургических вмешательств по поводу изолированной формы субаортального стеноза возраст самых младших пациентов составлял от 3 до 6 лет, и операций практически не делали после 30 лет.
Хирургическое лечение
-
Показания к операции.
Единственным эффективным методом лечения субаортального стеноза является его хирургическое устранение. Однако четкие общепризнанные показания к операции до сих пор не разработаны. Это объясняется многообразием вариантов клинического течения заболевания и отсутствием связи между объективными показателями состояния больного и его субъективными ощущениями. С одной стороны, учитывая прогрессирующее течение порока, сопровождающееся более выраженными по сравнению с другими видами врожденных стенозов аорты нарушениями, было бы желательно как можно раньше осуществлять операцию. С другой стороны, высокий процент рецидивов и необходимость выполнения повторных операций заставляют более тщательно определять показания к операции.
Основным показанием к хирургическому вмешательству при этом является наличие ГСД на уровне обструкции более 50 мм рт. ст.. При значительно выраженном стенозе показания к операции абсолютные. При ГСД от 50 до 80 мм рт. ст. вопрос о необходимости оперативного лечения решается индивидуально. Существенное значение в определении показаний во всех спорных случаях имеют выраженность гипертрофии левого желудочка и клинических проявлений. При наличии головокружения, боли в области сердца и гипертрофии левого желудочка по данным ЭКГ, а так же при прогрессировании субаортального стеноза или тенденции к развитию левожелудочковой недостаточности операция показана. Выжидательная тактика рекомендуется при отсутствии клинических проявлений, даже если ГСД больше 50 мм рт. ст. В этих случаях и при незначительной обструкции показаны повторные ЭхоКГ-обследования каждые 6 мес в связи с возможным быстрым прогрессированием стеноза.

Выжидательная тактика не получила абсолютного признания. Многие авторы считают, что ранние вмешательства при градиенте менее 40 мм рт. ст. могут предотвратить рецидив стеноза и прогрессирование деформации аортального клапана. Было показано, что вероятность недостаточности аортального клапана зависит от возраста пациента на момент операции, величины дооперационного градиента, наличия кардиомегалии и применения миэктомии. Устранение субаортального стеноза уменьшает выраженность аортальной недостаточности у 86% пациентов с ее наличием до операции. С другой стороны, некоторые хирурги не нашли никакой пользы от операций на ранних стадиях развития гемодинамических нарушений.
Тактика хирургического лечения субаортального стеноза зависит от анатомической формы порока. Наиболее «удобным» вариантом для хирургического лечения является стеноз в виде дискретной фиброзно-мышечной диафрагмы. В некоторых случаях может применяться оперативное лечение в виде рентгенэндоваскулярной дилатации стеноза. При диффузной обструкции или при многоуровневой обструкции выводного тракта левого желудочка и некомпетентности аортального клапана вышеуказанные показания сохраняются, но для каждого пациента важна конкретная морфология. Обычная резекция неэффективна, и обструкция часто возвратная. В этих случаях показаны сложные пластические операции: изолированная аортовентрикулопластика, операции по методу Коппо или их модификации, а также трансплантация собственного легочного клапана в аортальную позицию.
При сочетании субаортального стеноза с ДМЖП устранение первого показано при меньшем ГСД. Учитывая прогрессирующее течение порока, необходимо устранять стеноз через ДМЖП, даже если ГСД составляет 15-20 мм рт. ст..
Виды вмешательств
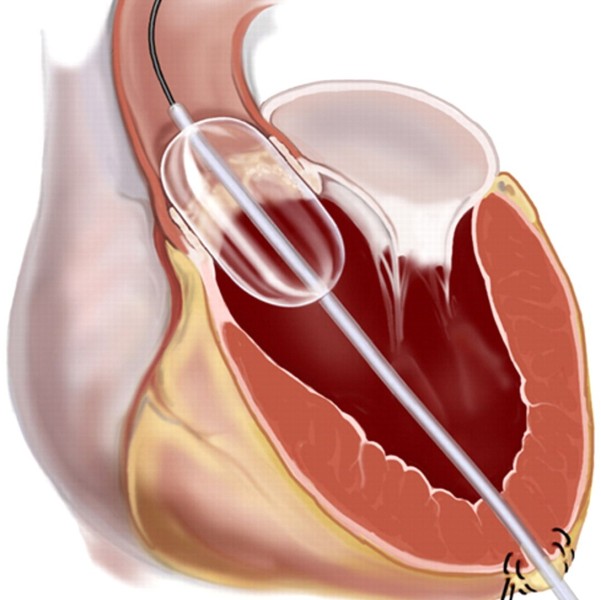
Транслюминальная баллонная дилатация
Метод РЭД был применен как малоинвазивная альтернатива для снижения ГСД при дискретном субаортальном стенозе. С момента первого сообщения ряд авторов подтвердили успешное применение метода РЭД при дискретном субаортальном стенозе у детей и молодых пациентов. Если сопутствующая аортальная недостаточность свыше 2+ служит противопоказанием для баллонной вальвулопластики клапанного стеноза аорты, то субаортальный стеноз в виде подклапанной мембраны может быть устранен методом баллонной вальвулопластики, несмотря на аортальную недостаточность. Регургитация даже свыше 2+ не является противопоказанием, так как воздействие оказывается не на полулунные створки, а на мембрану. Рентгенэндоваскулярная дилатация неэффективна при субаортальном стенозе в виде фиброзно-мышечного воротника и туннеля. Метод применяется для устранения только мембранозной формы порока при ГСД больше 50 мм рт. ст., ЭКГ-признаках гипертрофии левого желудочка, наличии жалоб на одышку, головокружение и потерю сознания, болевой синдром.. Учитывая прогрессирующее течение субаортального стеноза и относительно малое количество осложнений при РЭД, ряд авторов рекомендуют использовать метод и при умеренно выраженной стадии порока с ГСД меньше 50 мм рт. ст..
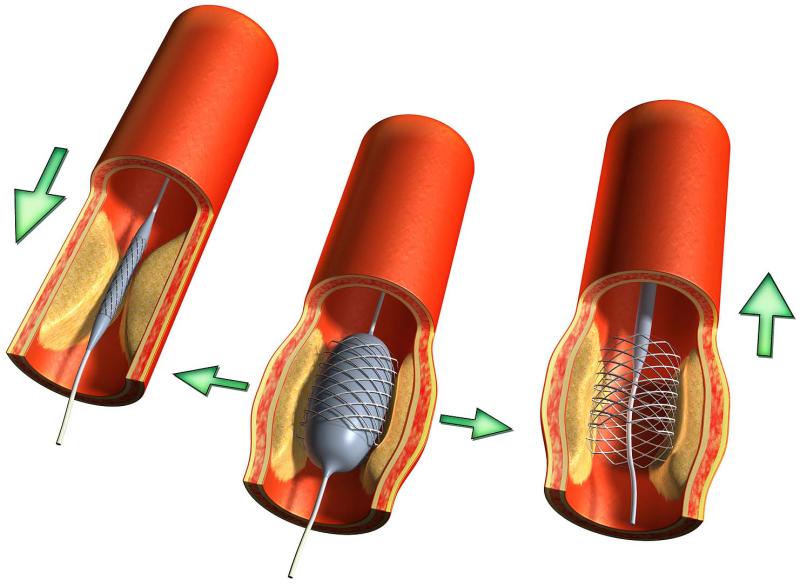
По мнению ряда авторов, снижение ГСД после РЭД практически одинаково эффективно как при клапанном стенозе, так и при подклапанной фиброзной диафрагме. Кроме того, у всех больных с сопутствующей аортальной недостаточностью и без нее после РЭД степень недостаточности не изменилась или же она не возникла, т. е. наличие аортальной недостаточности не является противопоказанием к РЭД мембранозной формы стеноза. При РЭД происходит разрыв мембраны, в ряде случаев до ее основания. Оценка эффективности РЭД проводится по данным непосредственного инвазивного исследования и по данным допплер-ЭхоКГ. При этом может наблюдаться различие показателей ГСД, полученных инвазивно непосредственно после РЭД и при допплер-ЭхоКГ, что объясняется нарушениями гемодинамики в момент вальвулопластики, не проходящими к моменту завершения процедуры. Контрольную допплер-ЭхоКГ необходимо проводить не ранее чем через 2 сут после РЭД в условиях полного восстановления функционального состояния миокарда.
Резекция дискретного подклапанного стеноза аорты
При субаортальном стенозе в виде фиброзномышечной диафрагмы или воротника применяется резекция дискретного подклапанного стеноза аорты в условиях искусственного кровообращения. Операцию выполняют через поперечный разрез аорты. Фиброзно-мышечный гребень экспонируют, крючками или мягким окончатым зажимом отводя створки клапана. Скальпелем производят два разреза фиброзно-мышечного гребня, один из которых проводят ниже комиссуры между левой и правой коронарными створками и другой — ниже центра правой коронарной створки. Митральный клапан защищают плоским крючком. Миокард перегородки удаляют, глубоко внедряясь в межжелудочковую перегородку между двумя разрезами. Проводящие пути находятся около мембранозной перегородки, которую нужно идентифицировать. Слишком глубокое рассечение межжелудочковой перегородки чревато возникновением блокады и ДМЖП, хотя миэктомия перегородки улучшает результат операции и снижает вероятность рецидива. Далее, двигаясь по часовой стрелке, отсекают фиброзный гребень от перегородки и от передней створки митрального клапана. Агрессивная резекция в области митрального клапана сопряжена с риском ее перфорации. Если мембрана тесно связана с основанием створок аортального клапана и переходит на септальную створку митрального клапана, убирают только фиброзную диафрагму или валик, сбривая его со створки или митрально-аортального кольца скальпелем. У большинства взрослых пациентов фиброзная диафрагма может быть вылущена из подлежащей мышечной ткани тупым путем.
Операция может осложниться возникновением ДМЖП, полной блокады и недостаточности аортального клапана в случае повреждения створок. Появление ятрогенного ДМЖП может быть заподозрено по систолическому дрожанию на передней стенке правого желудочка, скачку сатурации крови на уровне желудочка и подтверждено внутриоперационной ЭхоКГ. Закрытие такого дефекта сопровождается повышенным риском полной AV- блокады. У пациентов с выраженной аортальной недостаточностью и подклапанным стенозом резекция субаортального сужения может быть выполнена как часть операции транслокации собственного легочного клапана в аортальную позицию.
Летальность при этой операции приближается к нулю. Рецидив субаортального стеноза возникает у 15-20% больных.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии