Перерыв дуги аорты у новорожденных. Причины, лечение, последствия.
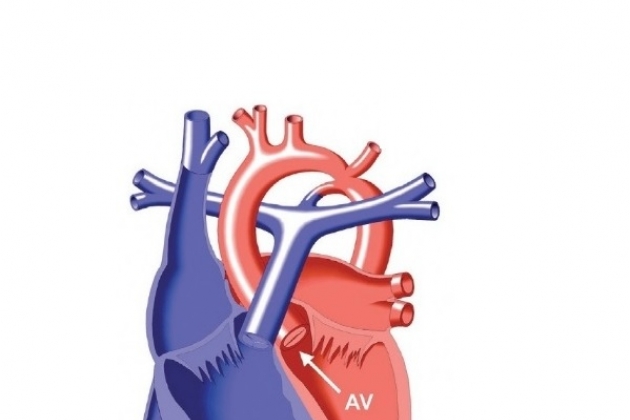
Перерыв дуги аорты – редкий порок, который характеризуется полным отсутствием анатомической связи между поперечной дугой аорты или перешейком и нисходящей грудной аортой с различными вариантами отхождения брахиоцефальных артерий. Впервые он был описан Morgagni в 1760 г. Перерыв дуги аорты следует отличать от атрезии дуги, при которой существует анатомическая связь между сегментами дуги в виде фиброзного тяжа различной длины без просвета. Гемодинамические и физиологические проявления этих аномалий идентичны. Единственным источником поступления крови в нисходящую аорту служит функционирующий боталлов проток, являющийся продолжением ствола легочной артерии.

Частота
Аномалия редко бывает изолированной. Она составляет 0,38-0,9% всех ВПС, или 0,019 случаев на 1000 родившихся живыми детей.
Эмбриогенез
Перерыв дуги аорты входит в группу эмбрионально связанных аномалий, которые ограничивают кровоток в IV аортальные дуги. Это различные пороки, среди которых – ДМЖП со смещением инфундибулярной перегородки кзади и субаортальным стенозом, ОАС, аортолегочное окно, полная транспозиция магистральных артерий, отхождение магистральных артерий от правого желудочка типа Taussig-Bing, синдром гипоплазии левых отделов сердца и некоторые формы двуприточного единственного желудочка.
Существует тесная зависимость между перерывом дуги аорты и синдромом Di George. Предполагается, что обе аномалии связаны с нарушением развития неврального гребешка. У пациентов с перерывом типа В обнаружена микроделеция хромосомы 22q11. Этим объясняется отставание в развитии познавательной функции и речи, что отражается на поведении ребенка.
Тип А перерыва является следствием инволюции обеих дорсальных аорт дистальнее IV дуг и проксимальнее персистирующей VI дуги, которая кровоснабжает нисходящую аорту в месте IV дуги.
Тип В является следствием недоразвития одной IV дуги и одной дорсальной аорты между IV и VI дугами или – в нередких случаях, когда обе подключичные артерии расположены дистальнее перерыва – происходит инволюция обеих IV дуг и VI дуги на противоположной стороне от нисходящей аорты.
Тип С обусловлен инволюцией одной ветви трункоаортального мешка с проксимальной III дугой и всей IV дугой при нормальной инволюции дорсальной аорты между III и IV дугами – так называемый каротидный проток.
Практически все случаи перерыва между сонными и подключичной артерией сочетаются с аномалиями конотрункуса, при которых гипоплазия субаортальной области создаёт субаортальное сужение, и с дефектом конусной перегородки несоосного типа.
Анатомия
Первая классификация перерыва дуги аорты была предложена Celoria и Patton. Она отражает место перерыва дуги:
-
тип А – дистальнее левой подключичной артерии;
-
тип В – между левой общей сонной артерией и левой подключичной артерией. При этом типе часто встречается аберрантная подключичная артерия. У 50% больных имеется синдром Di George;
-
тип С – между безымянной артерией и левой общей сонной артерией.
Тип А перерыва может сочетаться с открытым аортолегочным окном и интактной межжелудочковой перегородкой. Это сочетание непропорционально часто встречается у пациентов с ТМА и перерывом дуги аорты.
Тип В наблюдается гораздо чаще, чем тип А, и обычно сопровождает аномалии конотрункуса с нормальной ориентацией магистральных артерий и большим несоосным ДМЖП, сочетающимся с отклонением инфундибулярной перегородки кзади и субаортальной обструкцией. У пациентов с Di George синдромом и перерывом дуги аорты, как правило, имеется тип В.
Тип С встречается достаточно редко, без закономерных сочетаний.
Сопутствующие аномалии
Перерыв дуги аорты выступает в изолированном виде только у 2% пациентов. Обычно он сопровождается ОАП и ДМЖП, у 60% больных – двустворчатым аортальным клапаном. У 10 % пациентов отмечается деформация митрального клапана, у 10% – ОАС, у 20% – субаортальный стеноз. Реже сочетаются с данной аномалией атрезия аорты с аортолегочным окном и артериальным протоком или с V аортальной дугой как источником крови для восходящей аорты; атриовентрикулярной дискордантностью, отхождением правой легочной артерии от аорты. Встречаются также казуистические случаи, когда перерыв дуги аорты находили у больных с тяжелым стенозом легочной артерии или тетрадой Фалло. Находки билатеральной обструкции выводного тракта противоречат привычной теории морфогенеза. При перерыве дуги аорты описано отхождение подключичной артерии от боталлова протока, что подразумевает наличие двустороннего артериального протока. Имеется сообщение об аномальном отхождении левой передней нисходящей коронарной артерии от легочного ствола у больного с перерывом дуги аорты типа В. Редко перерыв дуги аорты сопровождает ТМА с ДМЖП, одножелудочковое атриовентрикулярное соединение, правый желудочек с двумя выходами, АВСД, корригированную транспозицию магистральных артерий.
Дефект межжелудочковой перегородки и обструкция выводного тракта левого желудочка
У пациентов с бивентрикулярным сердцем и нормальной сегментарной анатомией почти всегда имеет место ДМЖП, за исключением случаев аортолегочного септального дефекта и изолированного перерыва дуги. Во внутриутробном периоде дефект перегородки ухудшает ток крови в восходящую аорту. Для перерыва дуги аорты характерно смещение инфундибулярной перегородки кзади, что создает препятствие в выводном тракте левого желудочка.
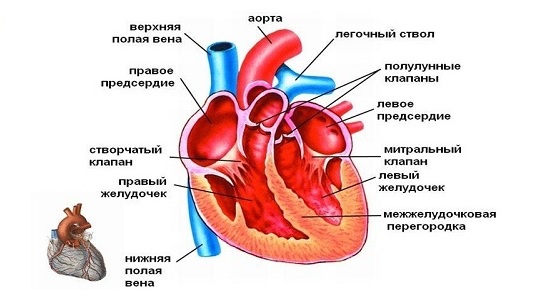
Смещение перегородки сравнивают с дверью, открывающейся в сторону левого желудочка. «Петли» этой двери располагаются вдоль вентрикулоинфундибулярной складки, если смотреть со стороны правого желудочка, и вдоль клапанного кольца аорты, если смотреть со стороны левого желудочка. Дефекты могут располагаться в различных отделах перегородки: в субартериальной и в перимембранозной области.
Нередко встречается перимембранозный дефект с нависающей аортой. Праводеленность аорты и наличие ткани трехстворчатого клапана, частично перекрывающей дефект, способствуют дальнейшему сужению выводного тракта левого желудочка. Оно может быть настолько выраженным, что бивентрикулярная коррекция становится невозможной. У больных с единственным желудочком и дискордантным вентрикулоартериальным соединением рестриктивный ДМЖП фактически является субаортальным стенозом.
Механизмы образования сужения выводного тракта левого желудочка при перерыве дуги аорты, среди прочих, включают:
-
смещение инфундибулярной перегородки кзади;
-
переднелатеральный мышечный пучок Moulaert;
-
клапанный стеноз аорты;
-
гипоплазию аортального клапанного кольца;
-
дополнительные ткани трехстворчатого клапана.
Перерыв дуги аорты и сдавление бронхов
Бронхи могут быть сдавлены резко расширенным левым предсердием, двусторонними артериальными протоками или правосторонней нисходящей грудной аортой.
Патофизиология
При всех типах атрезии дуги аорты кровообращение в нижней половине туловища зависит от наличия функционирующего боталлова протока. По мере его облитерации в раннем периоде новорожденности у ребенка развиваются симптомы гипоперфузии нижней половины туловища, в первую очередь органов брюшной полости, с последующим развитием почечной недостаточности и метаболического ацидоза. Снижение сопротивления в малом кругу кровообращения приводит к тому, что большая часть минутного объема сердца попадает в систему легочной артерии, в связи с чем у новорожденного нарастают симптомы как лево-, так и правожелудочковой недостаточности. Без хирургической коррекции порок приводит к ранней гибели новорожденного.
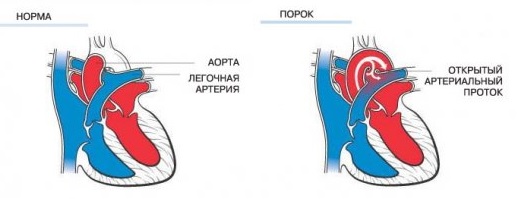
Клиника, диагноз
Порок проявляется у новорожденных при сужении или закрытии артериального протока, хотя некоторые больные доживают до взрослого возраста. Симптоматика отражает нарушение кровообращения в бассейне, который кровоснабжается через боталлов проток до его функционального закрытия.
Как и при других пороках с дуктусзависимым системным кровотоком, дети поступают в состоянии сердечно-сосудистого шока или сердечной недостаточности после спонтанного закрытия артериального протока в первые дни жизни. Прежде всего проводят энергичные мероприятия для стабилизации состояния:
-
восстанавливают объём циркулирующей крови;
-
начинают инфузию ПГЕ1;
-
если необходимо, стабилизируют гемодинамику инотропной поддержкой.
Характерным клиническим признаком является различие пульса на обеих руках, зависящее от типа перерыва, которое можно определить после восстановления удовлетворительного сердечного выброса. Отсутствие пульса на всех конечностях указывает на возможность перерыва типа В с аномальной подключичной артерией, т.е. когда обе сонные артерии отходят проксимальнее, а обе подключичные артерии – дистальнее перерыва. Сильная каротидная пульсация позволяет дифференцировать перерыв дуги от критического аортального стеноза, при котором пульс ослаблен. Дифференциальный цианоз теоретически возможен, однако наблюдается нечасто, поскольку кровь в легочной артерии и, следовательно, в артериальном протоке хорошо насыщена кислородом из-за большого лево-правого сброса через ДМЖП.
На рентгенограмме:
-
кардиомегалия;
-
усиленный легочной рисунок;
-
легочно-венозный застой или отек.
Верхнее средостение может быть суженным из-за отсутствия вилочковой железы, как обычно бывает при Di George синдроме. На ЭКГ – гипертрофия правого желудочка.
Двухмерная ЭхоКГ является наиболее важным методом диагностики перерыва дуги. Из подреберного переднего доступа порок может быть заподозрен по выраженному несоответствию размеров восходящей аорты и легочного ствола при наличии типичного несоосного ДМЖП вследствие отклонения кзади конусной перегородки. Последняя лучше видна по парастернальной длинной оси. Исследование дуги из надключичного или высокого парастернального доступа позволяет определить характер отхождения брахиоцефальных сосудов и проходимость. В отличие от нормального направления дуги аорты кзади, при перерыве дуги, особенно при типе В, курс сонных артерий направлен кверху.
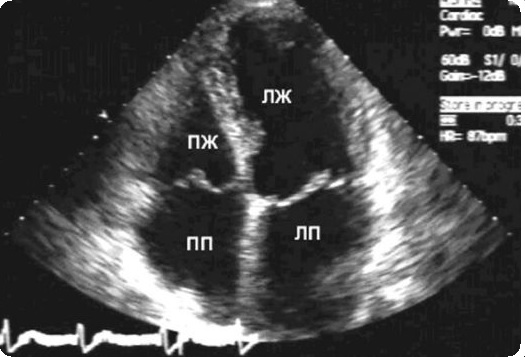
Во многих центрах для подтверждения диагноза еще используется ангиокардиография, однако ток крови через ДМЖП затрудняет получение высококачественного изображения восходящей аорты, чтобы отличить перерыв от тяжелой гипоплазии дуги. Перерыв может быть безошибочно диагностирован при ангиографии, когда обе каротидные артерии отходят проксимально, а обе подключичные артерии – дистально по отношению к месту перерыва и боталлову протоку. Большое расстояние между сонными артериями и нисходящей аортой однозначно указывает на перерыв.
Трехмерное изображение на МРТ может продемонстрировать характер отхождения сонных артерий и отсутствие связи между проксимальной и дистальной аортой. Однако этот метод не позволяет отличить перерыв от тяжелой гипоплазии дуги.
Естественное течение
Естественное течение порока неблагоприятное. В течение первой недели жизни умирают 42,1% младенцев, к 6 мес. выживаемость снижается до 26,3% и сохраняется на этом уровне до 15-летнего возраста.
Лечение
Дохирургическое лечение
В первые несколько дней внутривенно вводят ПГЕ1, интубируют, проводят искусственную вентиляцию легких с кислородом. Корригируют концентрацию сывороточного кальция. Следует избегать гипервентиляции и дыхательного алкалоза для профилактики судорожной готовности. Больным с Di George синдромом нельзя переливать цитратную кровь, так как она потребляет сывороточный кальций.
Хирургическое лечение
Целью хирургической коррекции порока является создание непрерывности аорты с восстановлением физиологического кровотока в области ее дуги, устранение субаортального стеноза, а также разобщение большого и малого кругов кровообращения. Хирургическая коррекция может быть как одно-, так и двухэтапной.
Двухэтапный метод хирургической коррекции
Двухэтапный метод хирургической коррекции заключается в восстановлении целостности аорты за счет собственных тканей или путем имплантации сосудистого протеза с одновременной перевязкой ОАП и суживанием легочной артерии. Во время второго этапа коррекции порока закрывают ДМЖП и производят дебандаж легочной артерии. Подобная двухэтапная коррекция требует двух торакотомий:
-
на первом этапе выполняют левостороннюю торакотомию;
-
на втором – стернотомию.
У больных с атрезией дуги аорты типа А для восстановления целостности аорты используют левую подключичную артерию, которую соединяют «конец в конец» или «конец в бок» с верхним отделом нисходящей аорты. Иногда имеется возможность непосредственного анастомоза участков аорты между собой. При атрезии дуги аорты типа В существует два варианта оперативного вмешательства с использованием собственных сосудов для реконструкции аорты: левую сонную артерию анастомозируют с дистальным отделом аорты либо левую подключичную артерию анастомозируют с проксимальным отделом аорты. Описаны также методики с использованием обеих вышеуказанных артерий. Иногда при типе В возникает необходимость протезирования аорты, особенно когда левая сонная и подключичная артерии сужены. Необходимо учитывать, что при использовании искусственного протеза в последующем неизбежно повторное вмешательство.
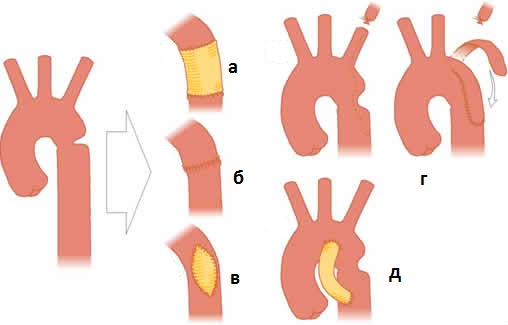
Хирургическая тактика зависит от степени субаортального сужения. Диаметр подаортального отверстия 5-6 мм и более позволяет выполнить первичную внутрисердечную коррекцию, т.е. закрытие ДМЖП заплатой в сочетании с реконструкцией дуги аорты. Диаметр выводного тракта менее 3 мм недостаточен для обеспечения нормального сердечного выброса у доношенных детей. При нормальной ориентации магистральных артерий субаортальное сужение следует обойти. Предпочтительным методом является соединение проксимального конца пересеченного легочного ствола с восходящей аортой с помощью гомографта, позволяющее одновременно реконструировать аорту, как при синдроме гипоплазии левых отделов сердца. Легочный кровоток обеспечивают из аорты с помощью сосудистого протеза из Gore-Tex, если ДМЖП остается открытым, или путем имплантации кондуита между правым желудочком и бифуркацией легочной артерии, если желудочки разделены заплатой, направляющей ток крови из левого желудочка в легочную артерию через ДМЖП. Когда перерыв дуги аорты сочетается с ТМА, выполняют операцию артериального переключения в комбинации с трансанулярной заплатой в неолегочном выводном тракте.
Дугу аорты почти всегда можно реконструировать путем препаровки тканей вокруг двух компонентов дуги и выполнения прямого анастомоза концов аорты, при необходимости используя гомографт для адекватного расширения аорты. Применение трубчатого гомографта для создания проксимальной и дистальной аорты следует по возможности избегать во время первичной операции в младенческом возрасте, так как при быстром росте ребенка и образовании фиброзного футляра вокруг нативной аорты усложняется анастомоз "конец в конец" при последующей операции.
Суживание легочной артерии является не лучшим методом паллиативного этапа лечения ДМЖП с перерывом дуги аорты вследствие развития гипертрофии обоих желудочков с прогрессированием субаортального стеноза, осложняющего окончательную отсроченную коррекцию любым методом.
Первичная полная коррекция при сопутствующем ДМЖП
Хирургическое лечение перерыва дуги аорты претерпело эволюцию от этапного до одномоментного. В Бостонской клинике предпочитают одноэтапную коррекцию в неонатальном периоде с использованием прямого анастомозирования нисходящей аорты с дугой или восходящей аортой.
На предоперационном этапе соблюдают принципы ведения, принятые для больных с дуктусзависимым системным кровотоком – дыхание комнатным воздухом без гипервентиляции. Кроме обычного мониторирования особое внимание уделяют измерению артериального давления выше и ниже будущего анастомоза, например, в лучевой и пупочной артериях. Это позволяет не только оценить градиент давления на анастомозе, но и адекватность перфузии верхнего и нижнего артериальных бассейнов во время фазы охлаждения при искусственном кровообращении.
Операцию выполняют через срединную стернотомию в условиях искусственного кровообращения и короткого периода остановки кровообращения. После стернотомии удаляют вилочковую железу и открывают полость перикарда. Тщательно выделяют сосуды дуги, ветви легочной артерии, артериальный проток и проксимальную часть нисходящей аорты. Идентифицируют и оберегают от повреждения возвратный глоточный нерв.
Принципиальное значение имеет канюляция артериальной системы. Для равномерного охлаждения больного канюлируют восходящую аорту и легочный ствол или проток. Место канюляции – по правой стороне восходящей аорты чуть ниже основания безымянной артерии. Конец канюли должен быть введен в просвет аорты не глубже чем на 1,5-2 мм, чтобы обеспечить антеградную перфузию мозга и ретроградный кровоток в коронарные артерии. Если сосуды дуги достаточно широкие, альтернативным местом канюляции является одна из сонных артерий. Это позволит обеспечить антеградный мозговой кровоток во время выполнения аортального анастомоза и избежать остановки кровообращения, но может стать причиной избыточной перфузии мозга и стенозирования места канюляции. Поскольку аортальный анастомоз несложен и может быть выполнен быстро, остановка кровообращения сопровождается минимальным риском и значительно облегчает эту часть операции.
Канюли в аорте и легочном стволе соединяют с помощью V-образного коннектора. Венозный дренаж осуществляют через одну или две канюли в правом предсердии или полых венах. Сразу после начала искусственного кровообращения турникетами обжимают обе ветви легочной артерии для предотвращения утечки артериальной крови в легочные сосуды. В нисходящую аорту кровь из аппарата поступает через ОАП. Во время фазы охлаждения следует проводить инфузию ПГЕ1. Продолжают выделение восходящей аорты и её ветвей, артериального протока и нисходящей аорты для уменьшения натяжения анастомоза и снижения риска кровотечения из линии шва. С этой же целью пересекают аберрантную правую подключичную артерию, отходящую от нисходящей аорты, если она есть, а также левую подключичную артерию при типе В перерыва дуги.
При температуре 18-20 0С в прямой кишке кровообращение останавливают. Затягивают турникеты на сосудах дуги и ослабляют на легочных артериях. Вводят кардиоплегический раствор через аортальную канюлю. После этого обе аортальные и венозную канюли удаляют, если предполагается выполнять аортальный анастомоз при остановленном кровообращении. Опыт показывает, что с разных точек зрения это лучше делать в условиях перфузии мозга. С помощью проводника аортальную канюлю проводят в один из плечеголовных сосудов, обжимают турникетом и начинают перфузию мозга с низкой объёмной скоростью.
Артериальный проток лигируют и пересекают в месте его соединения с нисходящей аортой. Иссекают остатки ткани протока. Нисходящую аорту пережимают С-образным зажимом и подтягивают к месту будущего анастомоза. Анастомоз выполняют на восходящей аорте, в месте, где она наиболее подвижна, благодаря чему уменьшается степень натяжения шва. Верхний край разреза обычно простирается до основания сосудов дуги. Анастомоз должен находиться точно напротив места канюляции аорты, его накладывают 6/0-7/0 проленом. При наличии сужения восходящей аорты место анастомозирования может быть расширено лоскутом перикарда или стенкой гомографта.
Перед реперфузией освобождают тесемки с плечеголовных сосудов, аортальную канюлю подтягивают, чтобы её конец находился в просвете аорты. Удаляют воздух из восходящей аорты, дуги и нисходящей аорты. Пережимают восходящую аорту проксимальнее канюли и снимают зажим с нисходящей аорты. Не вводя очередную дозу кардиоплегического раствора, открывают правое предсердие или легочный ствол или правый желудочек поперечным разрезом в зависимости от локализации дефекта и закрывают его ушиванием или с помощью заплаты из аутоперикарда. Локализация дефекта должна быть установлена по ЭхоКГ до операции. Заплату фиксируют отдельными матрацными швами с прокладками таким образом, чтобы ее верхний край располагался на левой стороне инфундибулярной перегородки для отклонения перегородки от выводного тракта левого желудочка. После закрытия дефекта канюлируют предсердие и возобновляют искусственное кровообращение. При длительной остановке кровообращения может быть применена промежуточная реперфузия в течение 5-10 мин с объёмной скоростью 100 мл/кг/мин. Если дефект закрывают доступом через легочный ствол, останавливать кровообращение нет необходимости. Достаточно проводить перфузию со скоростью 50 мл/кг/мин.
У многих пациентов с перерывом дуги аорты растяжимость левого желудочка снижена, что способствует увеличению сброса крови на предсердном уровне, поэтому овальное окно следует закрыть в период гипотермической остановки кровообращения.
После закрытия дефектов эвакуируют воздух из левых отделов сердца, снимают зажим с аорты, начинают согревание и ушивают разрезы легочного ствола или правого предсердия. В левом предсердии оставляют катетер для послеоперационного мониторирования. Пациента согревают до 36 0С и отлучают от аппарата обычно с минимальной инотропной поддержкой.
Хирургическая летальность при первичной операции составляет около 10%.
При атрезии дуги аорты в секторе А облитерированный участок перешейка аорты завязывают и пересекают. В условиях перфузии головного мозга иссекают артериальный проток и нисходящую аорту анастомозируют с вогнутой частью дуги.
Коррекция перерыва дуги аорты, сочетающегося с ОАС
После ДМЖП общий артериальный ствол является наиболее частым сопутствующим пороком при перерыве дуги аорты. Полная коррекция предусматривает одновременное устранение обоих пороков. Канюляция аорты упрощается использованием одной артериальной канюли, которую вводят в дистальную часть восходящей аорты или в легочный ствол, являющийся компонентом ОАС. При включении аппарата искусственного кровообращения пережимают турникетами ветви легочной артерии. По достижении температуры 18 0С сосуды мозга пережимают и останавливают кровообращение. Артериальный проток перевязывают и пересекают. Легочный компонент общего ствола отсекают от корня ствола.
Восходящую аорту рассекают вертикально, включая начальные 5 мм левой общей сонной артерии. Все ткани артериального протока удаляют из нисходящей аорты, оставляя левую подключичную артерию. В ее основании делают надрез длиной приблизительно 5 мм. При условии хорошей мобилизации левой общей сонной, левой подключичной артерии и проксимальной части нисходящей аорты разрезы обеих артерий сшивают 7/0 проленом. В разрез аорты и основания общего ствола вшивают клиновидную вставку из гомолегочной артерии или аорты аналогично тому, как это делают при выполнении операции Nortwood-1 у пациентов с синдромом гипоплазии левых отделов сердца. На этом этапе возобновляют искусственное кровообращение и пациента согревают. Через вертикальный разрез правого желудочка, начатый непосредственно под клапаном ствола, закрывают заплатой ДМЖП. Правый желудочек соединяют с бифуркацией легочной артерии с помощью клапанного легочного или аортального гомографта.
Коррекция перерыва дуги аорты, сочетающегося с транспозицией магистральных артерий
Когда перерыв дуги аорты сочетается с ТМА или аномалией Taussig-Bing, реконструкцию дуги комбинируют с процедурой артериального переключения. В связи со значительной несоразмерностью магистральных артерий у этих пациентов аорту пересекают непосредственно над синусами Вальсавы и разворачивают влево и кзади, чтобы анастомозировать «конец в конец» с нисходящей аортой. Производят продольный разрез по нижнему краю этой неоаортальной дуги. Широкую проксимальную неоаорту с имплантированными коронарными пуговицами анастомозируют с разрезом неоаортальной дуги «конец в бок». После возобновления искусственного кровообращения закрывают ДМЖП через правую вентрикулотомию, ДМПП ушивают через короткий разрез правого предсердия. Проксимальную неолегочную артерию анастомозируют с легочной бифуркацией или с правой легочной артерией с использованием маневра Lecompte при переднезаднем расположении магистральных артерий или без него при ориентации крупных сосудов «бок о бок».
Результаты хирургического лечения
В связи с высокой естественной смертностью и редкой встречаемостью перерыва дуги аорты в литературе представлены результаты хирургического лечения в малых сериях. Согласно опубликованному в 1988 г. исследованию, в котором представлен опыт лечения 63 больных, 30-дневная, 1-, 5- и 10-летняя выживаемость составила 61, 52, 48 и 47% соответственно. Результаты улучшились с накоплением опыта, и к 1986 г. вероятность смерти после операции, выполненной детям до 2-недельного возраста, составила всего 6%. Из 33 больных, у которых перерыв дуги сочетался с ДМЖП, обструкция выводного тракта левого желудочка выявлена у 8 пациентов, 7 из которых были подвергнуты повторным операциям. Отсутствие этого осложнения к 1 мес., 1 году и 3 годам составило 97, 78 и 58% соответственно. Рецидив или сохранение обструкции дуги были обнаружены у 15 больных и отмечались более часто у пациентов, которым был выполнен прямой анастомоз, чем у тех, которым был имплантирован трубчатый протез.
Согласно многоцентровым исследованиям, представленным в 1994 г., из 183 новорожденных с перерывом дуги аорты и ДМЖП 9 умерли перед хирургическим вмешательством. Выживаемость среди 172 оставшихся была 73, 65, 63 и 63%, соответственно к 1 мес., 1, 3 и 4 годам после коррекции. Факторами риска смерти оказались малая масса при рождении, более ранний возраст на момент операции, тип В перерыва, расположение дефекта в тракте оттока и в трабекулярной части перегородки, малые размеры дефекта и субаортальное сужение. Факторами риска, связанными с технической стороной вмешательства, были:
-
коррекция без сопутствующих процедур у пациентов с наличием других сужений между левым желудочком и аортой;
-
анастомоз Damus-Kaye-Stansel;
-
миотомия или миэктомия при субаортальном стенозе.
Эти данные были получены 15 лет назад. Вероятно, что некоторые технические погрешности к настоящему времени устранены.
В другой сводной статистике, охватывающей 300 наблюдений, представлена удельная частота различных сочетаний пороков с перерывом дуги. У 208 пациентов был простой перерыв – сочетание с ДМЖП и артериальным протоком, у 92 – сложный перерыв: ОАС – у 36 больных, атрезия трехстворчатого клапана – у 8, транспозиция – у 8, атрезия митрального клапана – у 6, другие формы единственного желудочка – у 6, аортолегочное окно – у 6 и отхождение обеих магистральных артерий от правого желудочка – у 5 больных. У оставшихся 17 пациентов имели место сложные сочетания различных пороков. Перерыв дуги типа А наблюдался у 37% больных, типа В – у 62% и типа С у 1%. Аберрантная правая подключичная артерия была обнаружена у 8% пациентов при типе А и у 20% – при типе В. Перерыв правосторонней дуги аорты имел место у 2,7% пациентов.
Общая хирургическая летальность составила 35%. В группе больных с простой транспозицией, у которых была выполнена первичная коррекция или проведено этапное лечение летальность составила 30%. Среди пациентов, у которых перерыв дуги сочетался со сложными пороками, летальность составила в среднем 46%, в частности при общем артериальном стволе она достигала 67%. Аналогичные результаты получены и в других центрах. Так, в Детском госпитале Торонто средняя выживаемость в возрасте 1 мес. составила 50%, к 1 и 5 годам жизни – 34%. После 1993 г. 5-летняя выживаемость после одноэтапной коррекции неосложненного перерыва дуги достигла 93%, а отсутствие необходимости в повторных операциях составило 69%.
На протяжении многих лет летальность не уменьшилась. Среди пациентов с простым перерывом были применены два протокола: первичная коррекция с летальностью 37% и двухэтапное лечение с летальностью 46%.
Результаты лечения перерыва дуги аорты улучшились после внедрения простогландина для стабилизации состояния детей перед операцией. Существенную роль в уменьшении безопасности лечения этих крайне тяжелых детей сыграла эволюция диагностических методов от инвазивных до неинвазивных.
Коррекция перерыва дуги аорты и сопутствующих аномалий до настоящего времени остается трудной проблемой. Большинство пациентов находятся в тяжелом состоянии, с выраженной сердечной недостаточностью, осложненной анурией или олигурией у каждого третьего пациента. В этих случаях требуется неотложная операция в раннем неонатальном периоде.
Особую проблему составляет стеноз выводного тракта левого желудочка. Различные формы субаортального стеноза встречаются в половине случаев. До настоящего времени нет единого мнения по вопросам о том, влияет ли обструкция выводного тракта левого желудочка на исходы коррекции перерыва дуги аорты и есть ли необходимость устранять сужение во время первичной коррекции, а также какой метод операции предпочтителен. Некоторые хирурги во время первой операции не предпринимали попыток устранить субаортальную обструкцию вне зависимости от выраженности сужения и получили результаты сравнимые, с таковыми при более агрессивной тактике. Другие считают, что включение в протокол вмешательства одновременного устранения субаортального стеноза не увеличивает хирургический риск и поэтому оправдано.
Тяжелая обструкция не оставляет хирургу выбора. В некоторых центрах для создания свободного выхода прибегают даже к операции Norwood. Имеются сообщения о небольшой группе пациентов, которые перенесли успешную бивентрикулярную коррекцию после первичной операции Norwood, выполненной по поводу перерыва дуги аорты с выраженным субаортальным стенозом. При тяжелой обструкции с гипоплазией левого желудочка прибегают к этапному лечению, вначале выполняя операцию Norwood, затем операцию Rastelli. Остается неясным, имеет ли преимущество этот тип вмешательства перед субаортальной резекцией.
Большая вероятность развития рецидива сужения выхода из левого желудочка и реконструированной дуги аорты требует постоянного наблюдения за динамикой этого процесса. Возможно формирование недостаточности аортального клапана. В некоторых случаях развивается обструкция дыхательных путей.
Отклонение инфундибулярной перегородки кзади может стать причиной позднего субаортального сужения и повторной операции.
В отдаленном периоде высока частота реопераций по поводу рекоарктации, сдавления бронхов, обструкции кондуита, субаортального стеноза, а также этапных вмешательств и других редких операций.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания










Комментарии