Осложнения искусственного кровообращения
Глубокая гипотермия с остановкой кровообращения
Существует определенная подгруппа новорожденных, младенцев и детей с такими врожденными пороками сердца, которые требуют обширной коррекции сложных ВПС с использованием глубокой гипотермии и циркуляторного ареста. Такая методика способствует выполнению точной хирургической коррекции при оптимальных условиях в операционном поле без крови или канюль, обеспечивая максимальную защиту органов и часто способствуя сокращению общего времени искусственного кровообращения. Научное обоснование для использования глубокой гипотермии опирается в основном на температурно-опосредованное снижение метаболизма. Общее и мозговое потребление кислорода в ходе индуцированной гипотермии снижает скорость метаболизма кислорода в 2-2,5 раза на каждые 10°C понижения температуры. Эти результаты соответствуют модельным результатам, полученным in vitro, которые соотносят снижение температуры с понижением константы скорости химических реакций, как первоначально было описано Arrhenius с использованием уравнения k = Ae-RT. В условиях глубокой гипотермии снижение доставки кислорода в ходе низкопоточного искусственного кровообращения сопряжено с преимущественным повышением перфузии жизненно важных органов (например, головного мозга) и усиленной экстракцией кислорода. Поэтому, в определенной степени, низкопоточное искусственное кровообращение в условиях глубокой гипотермии оказывает защитный эффект за счет снижения скорости аэробного метаболизма, обеспечивая преимущественно органную перфузию и повышая тканевую экстракцию кислорода. Длительность безопасного периода DHCA не была четко очерчена. Несмотря на то, что все системы органов находятся в зоне риска развития ишемического и реперфузионного повреждения, проявляющегося продукцией лактата и пирувата в ходе DHCA, головной мозг, по-видимому, является наиболее чувствительным и наименее устойчивым к данным воздействиям. Стволовые и корковые вызванные потенциалы, так же как обработанные электроэнцефалограммы, изменяются после DHCA. По-видимому, отклонения в вызванных потенциалах связаны с длительностью DHCA и объясняются измененным метаболизмом. У новорожденных и младенцев в ходе реперфузии после периода остановки кровообращения мозговой кровоток и метаболизм остаются угнетенными. Важно отметить, что в ходе использования такой экстремально низкой температуры утрачивается ауторегуляция, а мозговая перфузия становится очень зависимой от параметров экстракорпоральной перфузии и, вероятно, от постперфузионной гемодинамической производительности.
Потенциально вредоносные эффекты длительной DHCA у новорожденных и младенцев хорошо описаны. В целом, принято считать, что очень длительные периоды беспрерывной DHCA могут иметь неблагоприятные неврологические исходы. Однако имеется существенное расхождение во мнении о том, существует ли «безопасный» период у DHCA и могут ли какие-либо особенности со стороны пациента или конкретные методы, или послеоперационные стратегии ведения ослаблять или стимулировать повреждение ЦНС от DHCA. Имеются некоторые сообщения о неблагоприятных эффектах DHCA с разнообразными исходами относительно центральной нервной системы и других систем, о противоречивых эффектах или отсутствии таковых.
Со временем определились три аспекта:
-
эффекты кратковременной DHCА противоречиво связаны с неблагоприятными исходами;
-
эффекты DHCA не являются линейными явлениями;
-
эффекты DHCА, наиболее вероятно, трансформируются другими дооперационными и послеоперационными факторами, зависящими от пациента.
Регионарная мозговая перфузия
Поскольку многие исследования говорят о негативном эффекте, ряд хирургов разработал новаторские и многообещающие методики для обеспечения постоянной мозговой перфузии в ходе сложных реконструкций дуги аорты или внутрисердечных коррекций с тем, чтобы избежать, или минимизировать использование DHCA. Однако при отказе от DHCA длительность искусственного кровообращения неизбежно увеличивается, а большая продолжительность искусственного кровообращения показала ее неблагоприятное влияние, как на краткосрочные, так и на отдаленные результаты. Относительные риски и преимущества более продолжительного искусственного кровообращения в сравнении с коротким (или без) DHCA остаются предметом дискуссии.
В попытке изучить новейшую стратегию техника региональной мозговой перфузии была оценена в двух современных исследованиях.
В одном нерандомизированном исследовании из Бостона Wypij и соавт. наблюдали 29 пациентов раннего возраста, перенесших первый этап паллиативной коррекции, 9 из которых подверглись региональной мозговой перфузии с объемной скоростью от 30 до 40 мл/кг/мин. Авторами отмечено отсутствие разницы в индексах умственного и психомоторного развития к годовалому возрасту между группой пациентов с региональной церебральной перфузией и пациентами, перенесшими DHCA в качестве основной стратегии.
Группа авторов из Мичиганского университета опубликовала крупное рандомизированное исследование с DHCA ± региональная мозговая перфузия с объемной скоростью 20 мл/кг/мин у пациентов с функционально единственным желудочком, с отдаленными исследованиями на запланированных этапах. В исследование было включено всего 77 пациентов со схожими параметрами выживаемости к моменту выписки из стационара (88%) и к годовалому возрасту (75%). Было отмечено отсутствие существенной разницы в индексах психомоторного и умственного развития между двумя группами во всех временных интервалах, хотя в группе региональной церебральной перфузии показатели имели тенденцию к меньшим значениям.
Коррекция глюкозы
Достаточно много клинических и экспериментальных данных, которые продемонстрировали убедительные доказательства неблагоприятных эффектов гипергликемии в ходе полной, неполной или фокальной мозговой ишемии. Роль глюкозы в потенцирующем повреждении мозга опирается на два фактора: на утилизацию аденозинтрифосфата (АТФ) и лактатный ацидоз. Анаэробный метаболизм глюкозы требует фосфорилирования и расходования двух молекул АТФ, прежде чем может произойти продукция АТФ. Это первоначальное расходование АТФ может привести к быстрому ее истощению и может объяснить, почему гипергликемия ухудшает неврологическое повреждение. Лактатный ацидоз также является важным фактором в механизме повреждения мозга, вызванным высоким уровнем глюкозы. Однако его важная роль может быть связана с его способностью ингибировать гликолитический фермент. Ингибированием гликолиза лактат замедляет анаэробную продукцию АТФ непосредственно после того, как АТФ расходуется на фосфорилирование глюкозы.
По поводу вредных эффектов гипергликемии у детей в ходе ишемии может быть приведен убедительный научный довод, однако имеется очень мало указаний на взаимосвязь между ухудшающимися неврологическими исходами и гипергликемией в ходе искусственного кровообращения или DHCA. Хотя ретроспективное наблюдение 34 детей, перенесших DHCA наводит на мысль о худших неврологических результатах у детей с гипергликемией, результаты были представлены как несущественная статистическая тенденция. Обзор приобретенных неврологических поражений у пациентов после операции Норвуда по поводу синдрома гипоплазии левых отделов сердца говорит о гипергликемии, как о значимом ассоциированном показателе у пациентов с обширным церебральным некрозом или внутрижелудочковым кровоизлиянием. Множество других потенциально повреждающих факторов (например, период гипоксии, низкое диастолическое и систолическое давление, тромбоцитопения) были статистически связаны с наблюдаемой нейропатологией. Поскольку гипергликемия сопровождает системный стрессовый ответ, эти данные литературы не дали возможности определить, вносит ли глюкоза непосредственно свой вклад в неврологическое повреждение или просто служит маркером для популяции риска, у которой в конечном счете возникает неврологический ущерб в результате других факторов.
У новорожденных в течение периоперационного периода гипогликемия является частой проблемой. Сниженный печеночный гликонеогенез в совокупности с уменьшенными запасами гликогена ставит новорожденных в зону повышенного риска по возникновению гипогликемических эпизодов. У новорожденных с врожденными пороками сердца пониженная системная перфузия (как например, критическая коарктация, синдром гипоплазии левых отделов сердца, критический аортальный стеноз) может приводить к ухудшению печеночного биосинтеза и способствовать сниженной продукции глюкозы. Эти пациенты могут быть полностью зависимы от экзогенной глюкозы; следовательно, для них не является редкой необходимость инфузии 20-30% глюкозы для поддержания нормогликемии в дооперационном периоде. Дети старшего возраста также не защищены от гипогликемических состояний и, следовательно, являются восприимчивыми к неврологическому повреждению, вызванному гипогликемией. Пациенты с низким сердечным выбросом (кардиомиопатии, пациенты перед трансплантацией, пациенты в критическом состоянии послеоперационного периода), требующие повторной операции и получающие существенную инотропную поддержку, подвергаются риску снижения запасов гликогена и развитию интраоперационной гипогликемии.
Влияние гипогликемии во время искусственного кровообращения, кроме того, осложняется последствиями гипотермии, динамикой СО2 и другими факторами, которые могут изменять нормальные цереброваскулярные реакции. При изучении на собаках гипогликемия, индуцированная инсулином до уровня 1,7 ммоль/л, не изменила электроэнцефалографические данные. Однако после 10 мин гипогликемии в условиях гипокапнии электроэнцефалограмма стала уплощенной. При изучении регионарного кровотока у этих же животных кортикальный и гиппокампальный кровоток оставался нормальным, тогда как в других областях мозга имелось снижение кровотока. Потеря электроэнцефалографической активности только из-за одной гипогликемии обычно не происходит при уровне глюкозы выше 0,44 ммоль/л.
В ходе искусственного кровообращения в условиях глубокой гипотермии и DHCA мозговой кровоток и метаболизм изменяются. Дополнительный эффект гипогликемии, даже легкой, может вызвать изменения в мозговой ауторегуляции и завершиться увеличением кортикального повреждения. Распространенная практика использования гипервентиляции для снижения легочного сосудистого сопротивления у новорожденных и младенцев в процессе отлучения от искусственного кровообращения и в раннем постперфузионном периоде может усугубить гипогликемическое повреждение. Мониторинг глюкозы и строгое поддержание нормогликемии является важной частью управления искусственным кровообращением у пациентов с врожденными пороками сердца.
Влияние искусственного кровообращения на почки
После искусственного кровообращения комбинированные эффекты гипотермии, непульсирующего потока и редуцированного среднего артериального давления могут быть причинами высвобождения ангиотензина, ренина, катехоламинов и антидиуретического гормона. Эти циркулирующие гормоны способствуют ренальной вазоконстрикции и снижению почечного кровотока. Однако, несмотря на негативное влияние искусственного кровообращения на почечную функцию, в исследованиях не удалось определить связь между низкопоточной перфузией, пониженным давлением и непульсирующим потоком с послеоперационной почечной дисфункцией. Факторами, которые наилучшим образом коррелируют с послеоперационной почечной дисфункцией, являются дооперационная почечная дисфункция и критическое снижение сердечного выброса в постперфузионном периоде. Дооперационные факторы включают:
-
исходное заболевание почек;
-
низкий сердечный выброс;
-
индуцированное контрастом повреждение почек после катетеризации сердца.
Частота острой почечной недостаточности после кардиохирургических вмешательств у детей составляет примерно 8%. Множественные причинные факторы являются вовлеченными в этот процесс, но частым финальным результатом являются олигурия и повышенный уровень креатинина в плазме. Диуретики являются основой активации мочевыделения после искусственного кровообращения у детей. Фуросемид в дозе 1-2 мг/кг или этакриновая кислота в дозе 1 мг/кг каждые 4-6 ч, или их комбинация стимулируют диурез и могут предотвратить развитие кортикальной почечной ишемии, связанной с искусственным кровообращением. После DHCA нередко возникает ситуация, когда в течение 24 ч наблюдается олигоурия или анурия, которая разрешается по прошествии следующих 12-24 ч. Использование диуретиков является эффективным только после того, как у таких пациентов появился спонтанный диурез.
Скорость клубочковой фильтрации, клиренс креатинина и медуллярная концентрационная способность существенно снижаются у новорожденных и младенцев. Следовательно, использование искусственного кровообращения у этих пациентов ассоциируется с большей задержкой жидкости, чем это обычно наблюдается у детей старшего возраста и взрослых. Конечный результат может проявляться большими общими отеками, увеличением массы органов (например, легких, сердца) и большими сложностями с послеоперационным отлучением от искусственной вентиляции легких. Использование ультрафильтрации в течение согревания или после окончания искусственного кровообращения является эффективным средством для уменьшения общих отеков, с ограничением повреждающих эффектов искусственного кровообращения и сокращением послеоперационного периода искусственной вентиляции легких.
Легочные эффекты искусственного кровообращения
Кардиоплегия защищает сердце, но не предоставляет параллельную защиту легким в течение перфузии. Легочная дисфункция является часто встречающейся проблемой после искусственного кровообращения, а ее патогенез является мало изученным. В широком смысле, легочное повреждение опосредовано одним из двух путей:
-
во-первых, за счет воспалительного ответа вследствие активации лейкоцитов и комплемента;
-
во-вторых, за счет механического воздействия, приводящего к потере сурфактанта, к ателектазам с вентиляционно-перфузионными нарушениями, к сокращению легочного объема и изменению механики дыхания.
Легочная функция после искусственного кровообращения характеризуется редуцированным статическим и динамическим комплайнсом, редуцированной функциональной остаточной емкостью, дефицитом сурфактанта и повышенным альвеолярно-артериальным градиентом. Наиболее вероятными причинами этих изменений являются ателектазы и повышенная капиллярная утечка из-за гемодилюции и гипотермического искусственного кровообращения. Гемодилюция снижает уровень циркулирующих белков плазмы, уменьшая внутрисосудистое онкотическое давление, способствуя транссудации жидкости во внесосудистое пространство. Гипотермическое искусственное кровообращение вызывает активацию комплемента и дегрануляцию лейкоцитов. Лейкоциты и комплемент являются важными факторами в повреждении альвеолярно-капиллярной мембраны и развитии микрососудистой дисфункции вследствие закупорки тромбоцитами и высвобождения медиаторов, которые повышают легочное сосудистое сопротивление. Модифицированная ультрафильтрация (МУФ) является высокоэффективным методом для уменьшения содержания воды в легочной ткани и легочных осложнений в течение послеоперационного периода.
Стрессовый ответ и искусственное кровообращение
Высвобождение большого числа метаболических и гормональных веществ, включая катехоламины, кортизол, гормон роста, простагландины, комплемент, глюкозу, инсулин, эндорфины и другие вещества, характеризует стрессовый ответ в ходе гипотермического искусственного кровообращения (ИК). Вероятными причинами выработки этих веществ является:
-
контакт крови с неэндотелизированными поверхностями экстракорпорального контура и оксигенатора;
-
непульсирующий поток;
-
низкое перфузионное давление;
-
гемодилюция; гипотермия;
-
поверхностная глубина анестезии.
Другие факторы, которые могут способствовать повышению уровня стрессовых гормонов, включают замедленный почечный и печеночный клиренс в ходе гипотермического искусственного кровообращения, миокардиальное повреждение и исключение легочной циркуляции из кровотока во время ИК. Легкие ответственны за метаболизм и элиминацию многих из этих стрессовых гормонов. Стрессовый ответ обычно достигает максимума на стадии согревания. Имеются убедительные доказательства того, что стрессовый ответ может быть ослаблен углублением анестезии.
Остается неясным, какой уровень повышенных циркулирующих стрессовых гормонов, естественных для адаптивного ответа новорожденного, становится вредным. Нет сомнений в том, что данные вещества могут обусловливать нежелательные эффекты, такие как миокардиальное повреждение (катехоламины), системную и легочную гипертензию (катехоламины, простагландины), повреждение эндотелия легких (комплемент, простагландины) и реактивность легочных сосудов (тромбоксан). Были продемонстрированы преимущества контролирования стрессового ответа фентанилом у недоношенных детей при лигировании ОАП и суфентанилом у новорожденных со сложными врожденными пороками сердца. Несмотря на то, что притупление стрессового ответа представляется обоснованным, имеются дополнительные доказательства, предполагающие, что стрессовый ответ новорожденного, особенно эндогенное высвобождение катехоламинов, может являться адаптивным метаболическим ответом, необходимым для выживания при рождении. Следовательно, полное устранение адаптивного стрессового ответа может быть нежелательным. В настоящее время неизвестно, насколько тяжелобольные новорожденные с врожденными пороками сердца зависят от стрессового ответа для поддержания гемодинамической стабильности.
Поэтому логично утверждать, что глубина анестезии должна быть адекватной тому, чтобы уменьшить стрессовый ответ, но не пытаться заблокировать ответ в целом. Достаточный уровень анестезии в ходе искусственного кровообращения может быть наилучшим образом достигнут, постоянным назначением ингаляционного анестетика с помощью испарителя, соединенного с оксигенатором, осторожным титрованием возрастающих доз опиоидов или назначением определенной разовой дозы опиоида, или сочетанием опиоида с бензодиазепином путем постоянной инфузии. По сравнению с базовой анестезией галотаном, использование опиоидов в качестве базового метода анестезии снижает высвобождение стрессовых гормонов, уменьшает послеоперационный метаболический ацидоз и продукцию лактата и поэтому может быть предпочтительным у пациентов со сложными врожденными пороками сердца. Если адекватная глубина анестезии достигается назначением очень больших доз опиоидов (например, фентанила или суфентанила), будет необходима послеоперационная искусственная вентиляция легких. В отличие от опиоидной техники при использовании в качестве базовых ингаляционных анестетиков, их остаточные уровни (например, галотана или изофлурана) могут вызывать транзиторное угнетение миокарда к концу искусственного кровообращения, осложняя процесс отлучения от него. С усовершенствованием хирургической техники и уменьшением травматичности искусственного кровообращения высокие дозы опиоидных аналгетиков теперь редко используются в нашей практике.
Прекращение искусственного кровообращения
При отлучении пациента от искусственного кровообращения объем циркулирующей крови оценивается прямой визуализацией сердца и контролем правопредсердного и левопредсердного давления наполнения. Когда давление наполнения становится адекватным, пациент полностью согрет, когда нормализован кислотно-основной статус, достаточна частота сердечных сокращений и, когда достигнут синусовый ритм, венозный дренаж прекращается и пациент может быть отлучен от искусственного кровообращения. Артериальная канюля оставляется на месте с тем, чтобы для оптимизации давления наполнения можно было использовать медленную инфузию крови, оставшейся в аппарате искусственного кровообращения. Для оценки функции миокарда используется прямое визуальное наблюдение, мониторинг давления с помощью трансторакального правопредсердного или левопредсердного катетера, чрезкожного катетера во внутренней яремной вене или интраоперационная эхокардиография. Пульсооксиметрия также может использоваться для оценки адекватности сердечного выброса. Низкая системная артериальная сатурация или неспособность пульсоксиметра регистрировать пульс может быть признаком крайне низкого выброса и высокого системного сосудистого сопротивления.
После коррекции сложных врожденных пороков сердца анестезиолог и хирург могут столкнуться с трудностью отключения пациента от аппарата искусственного кровообращения. В этих обстоятельствах необходимо поставить диагноз, принимая к рассмотрению:
-
неадекватный результат операции с наличием остаточного дефекта или стеноза, требующего коррекции;
-
наличие легочной гипертензии;
-
наличие дисфункции правого или левого желудочка.
Для уточнения диагноза обычно используются два основных подхода раздельно или в сочетании. Возможно выполнение интраоперационной «катетеризации сердца» с тем, чтобы оценить данные показателей давления в различных магистральных сосудах и камерах сердца (например, измерение давлений в различных отделах путем подтягивания катетера или прямая пункция иглой для оценки остаточного градиента давления на восстановленных клапанах, в местах стенозов и кондуитах, а также уровень насыщения крови кислородом для определения остаточных шунтов). В качестве альтернативы, может быть использована допплер-эхокардиография для отображения интраоперационных структурных и функциональных нарушений, помогая оценке качества послеоперационной коррекции. Если в процессе обследования выявляются структурные нарушения, искусственное кровообращение может быть вновь возобновлено и остаточные дефекты устранены до того, как пациент покинет операционную. Сохранение значимых остаточных структурных дефектов неблагоприятно влияет на выживаемость и увеличивает тяжесть послеоперационного течения у пациента. Допплер-эхокардиография может быстро выявить дисфункцию правого и левого желудочка и предположить наличие легочной гипертензии. В дополнение ко всему, допплер-эхокардиография может выявить локальные нарушения сократимости, вызванные ишемией или воздухом внутри миокарда, что будет помогать выбору специфической фармакологической терапии и обеспечивать возможность оценки результатов этих вмешательств.
Ультрафильтрация искусственного кровообращения у новорожденных и младенцев
Применение искусственного кровообращения у новорожденных и младенцев вызывает тяжелую воспалительную реакцию и выраженную гемодилюцию. Это может привести к развитию постперфузионных осложнений и летальности в результате ухудшения органных функций. Наиболее подверженными этому влиянию являются сердце, легкие и головной мозг. Несмотря на то, что контакт между кровью пациента и чужеродной поверхностью перфузионного контура является мощным триггером, запускающим воспалительный каскад, другие факторы также играют важную роль в его возникновении, включая ишемию, глубокую гипотермию, согревание и хирургическую травму. Такие воспалительные медиаторы, как комплементарные анафилотоксины, вазоактивные амины и цитокины (например, фактор некроза опухоли-а, TNF-a), ведут к увеличению сосудистой проницаемости. Гемодилюция возникает с началом искусственного кровообращения, несмотря на использование физиологически сбалансированного заправочного раствора, который включает кровь, кристаллоидный раствор, альбумин и буфер в максимально уменьшенном объеме экстракорпорального контура. Гемодилюция, однако, может оказаться полезной для тех пациентов, которые оперируются в диапазоне от умеренных гипотермических температур до глубокой гипотермии с остановкой кровообращения. Начало искусственного кровообращения будет изменять вязкостно-эластические свойства крови, и, как было показано, эти изменения сохраняются и в постперфузионном периоде. Хотя режим перфузии, работа кардиотомических отсосов, использование артериального насоса роликового типа и силы сдвига в перфузионном контуре являются важными факторами, наибольшую роль в изменении вязкостно-эластических свойств крови играют температура и гематокрит. Показано, что низкая температура и высокий гематокрит ведут к более высокой вязкости. Повышенная вязкость может приводить к изменению органной перфузии, особенно головного мозга. Таким образом, с учетом данных, касающихся изменения вязкости крови, гемодилюция допустима при искусственном кровообращении на этапе охлаждения. Несмотря на ее преимущество в начале перфузии, гемодилюция в сочетании с воспалительным ответом приведет к транссудации жидкости во внесосудистое пространство, что в свою очередь потенциально может стать причиной дисфункции органов, которой избежали ранее. Профилактика дисфункции органов и улучшение оксигенации за счет удаления избыточной жидкости и медиаторов воспаления являются по этой причине обоснованием для использования ультрафильтрации. Конечным результатом является удаление из плазмы воды и низкомолекулярных веществ через полупроницаемую мембрану.
В современной перфузионной практике используются пять видов ультрафильтрации, три из которых применяются в ходе искусственного кровообращения.
-
Ультрафильтрация прайма.
Ультрафильтрация прайма (prime ultrafiltration - PUF) используется при добавлении донорской эритроцитарной массы к первичному раствору и выполняется на доперфузионном этапе. Целью PUF является замещение кристаллоидного прайма на прайм с эритроцитами, регуляция рН, изменение концентрации электролитов до безопасного уровня и устранение медиаторов воспаления, которые могут присутствовать в донорской крови. Традиционная ультрафильтрация (conventional ultrafiltration - CUF) заключается в удалении жидкости в любое время, пока пациент находится на перфузионной поддержке. При использовании этого метода обычно удаляется объем жидкости, равный объему использованной кардиоплегии. Традиционная ультрафильтрация может выполняться в ходе всех этапов искусственного кровообращения. Методика предполагает расположение фильтра в перфузион- ном контуре, который соединяется либо с венозной магистралью, либо с венозным резервуаром. Избыточное удаление ультрафильтрата может создать проблемы, вызванные понижением уровня в венозном резервуаре за счет создавшегося дефицита объема.
-
Ультрафильтрация с нулевым балансом.
При ультрафильтрации с нулевым балансом (zero balance ultrafiltration - ZBUF), удаленная жидкость замещается кристаллоидом с тем, чтобы избежать проблем с дефицитом объема в венозном резервуаре, и, таким образом, не происходит никакого удаления объема.
-
Дилюционная ультрафильтрация.
Третьим методом ультрафильтрации в течение перфузии является дилюционная ультрафильтрация (dilutional ultrafiltration - DUF), которая применяется в тех случаях, когда концентрация исходных электролитов (например, калия) считается повышенной. Этот метод предполагает удаление ультрафильтрата с замещением его разведенным наполовину физиологическим раствором и, следовательно, разбавлением его исходной концентрации до безопасного уровня. Описывая методы ультрафильтрации, используемые в ходе искусственного кровообращения, следует отметить, что несмотря на то, что эти методы имеют различные названия, у них похожая конечная цель, которая состоит в удалении избытка жидкости (clear fluid), приводящем к гемоконцентрации, в удалении медиаторов воспаления и возможность управления концентрациями электролитов на безопасном уровне.
Техника MUF
Техника MUF, изначально описанная Nakik и соавт. в 1991 г., заключалась в фильтрации крови непосредственно после отключения пациента от искусственного кровообращения. Это может быть реализовано с использованием вено-венозной техники, при использовании которой кровь забирается и возвращается концентрированной в предсердие, либо артерио-венозной, когда кровь забирается из аортальной канюли, а возвращается через венозную магистраль. Детально, при использовании этой техники, кровь забирается ретроградно из аортальной канюли, далее проходит через фильтр, не затрагивая объема экстракорпорального контура в венозном резервуаре и оксигенаторе, и возвращается в правое предсердие. Перекачивание крови через фильтр поддерживается роликовым насосом со скоростью потока 10-30 мл/кг/мин. При более медленной скорости, которая обеспечивает более плавное изменение во внутрисосудистом секторе, эта процедура потенциально лучше переносится пациентами. В течение всей процедуры поддерживается постоянное давление в предсердии добавлением кристаллоида в венозный резервуар по мере необходимости. Подключение вакуума к фильтрационному порту позволяет добиться максимального трансмембранного давления, достигая скорости ультрафильтрации от 100 до 150 мл/мин. Конечными ориентирами для процедуры MUF является время (15-20 мин) и достижение целевого гематокрита (обычно 40%) по мере того, как объем экстракорпорального контура будет замещен кристаллоидом, или в случае гемодинамической непереносимости процедуры пациентом.
Такая скорость «добычи» ультрафильтрата может быть опасной не только для ребенка, но и для взрослого пациента. Такая скорость практически не достижима у детей при использовании возрастных размеров гемоконцентраторов. Здесь следует указать, что такие скорости не должны использоваться у детей. Возможно, это ошибка, состоящая в том, что приведенная здесь цифра 100-150 относится не к объему получения ультрафильтата в минуту, а к разряжению в фильтрационной секции гемоконцентратора (фильтра, как они его называют), которая обычно действительно поддерживается в диапазоне 100-150 мм рт. ст. Если следовать точно смыслу авторского текста, то вместо «от 100 до 150 мл/мин» следовало бы поставить «от 20 до 100 мл/мин».
Кардиохирургические вмешательства в младенческом возрасте могут быть очень сложными с потенциально длительным временем искусственного кровообращения и пережатия аорты. Поэтому неудивительно, что после отлучения от искусственного кровообращения производительность миокарда оказывается пониженной. Несмотря на то, что ультрафильтрация используется в течение искусственного кровообращения с целью удаления избытка жидкости из организма, из исследований явствует, что использование MUF существенно улучшает производительность миокарда. Используя эхокардиографические измерения при обследовании младенцев, подвергающихся оперативному лечению без использования гипотермии с остановкой кровообращения, Davies и соавт. обнаружили улучшение систолической и диастолической функции у детей. Они нашли, что мобилизуемая преднагрузкой ударная работа, которая независима от нагрузки, улучшалась после MUF и была хорошим индикатором улучшения систолической функции.
То же исследование показало, что после MUF отмечается уменьшение толщины стенки миокарда и площади его поперечного сечения, которое отсутствовало в контрольной группе пациентов без ультрафильтрации. Эти изменения приводят к увеличению конечно-диастолической длины и падению конечно-диастолического давления, что является индикаторами улучшения диастолической функции. Хотя причиной данных улучшений, по-видимому, было снижение отека миокарда, а также наблюдаемое повышение гематокрита, что тоже вносило свой вклад в совместное улучшение кислородно-транспортной емкости. Представляет интерес тот факт, что по данным Davies эти положительные эффекты не наблюдались по прошествии 24 ч, когда диурез и инотропная поддержка были одинаковыми в обеих группах. Это подвигло ряд комментаторов подвергнуть сомнению абсолютность преимущества MUF.
Легочная дисфункция является одним из наиболее частых негативных эффектов искусственного кровообращения. Использование ультрафильтрации и MUF улучшает оксигенацию и снижает негативные эффекты медиаторов воспаления на альвеолярно-капиллярную мембрану и реактивность легочных сосудов. Исследования показали, что пациенты, у которых были использованы традиционная ультрафильтрация и MUF, имели улучшение легочного комплайнса, снижение сопротивления дыхательных путей, понижение реактивности легочных артерий и улучшение оксигенации. Из этого очевидно, почему эти методы нашли такое широкое признание в детской кардиохирургии, особенно у тех пациентов, для которых нормальный комплайнс с низким легочным сосудистым сопротивлением является жизненно важным (например, дети с физиологией единственного желудочка). Хотя исследования обычно находят, что имеется улучшение легочной функции непосредственно после отлучения от искусственного кровообращения и окончания MUF, существует разногласие в отношении того, приводят ли эти эффекты к улучшению функции в полной мере по прошествии 6 ч, и имеется ли какая-нибудь выгода на протяжении 24 ч. Однако заключение по этим исследованиям состоит в том, что комбинация ультрафильтрации с MUF в ходе искусственного кровообращения дает наилучшие результаты в раннем постперфузионном периоде.
Исследования отдаленных эффектов искусственного кровообращения и, конечно, влияния DHCA на головной мозг детей продолжаются.
В исследовании, выполненном на свиной модели с DHCA, использование MUF после искусственного кровообращения улучшило гематокрит, церебральную доставку кислорода и потребление мозгом кислорода, таким образом, создавая возможность потенциального уменьшения повреждения мозга. В дальнейших исследованиях были сделаны похожие выводы. В этом исследовании было показано, что для улучшения мозговой оксигенации представляют важность четыре показателя:
-
РСО2;
-
среднее артериальное давление;
-
гематокрит;
-
скорость потока MUF.

Повышение всех параметров, за исключением скорости потока MUF, улучшает доставку кислорода. Увеличение скорости потока, по-видимому, вызывает феномен обкрадывания, при котором имелся очевидный диастолический отток крови в контур MUF из аортальной канюли. Таким образом, несмотря на то, что MUF является важным методом для восстановления нормальной мозговой функции, необходима осторожность в его использовании, чтобы не свести на нет преимущества снижения времени MUF за счет повышения скорости потока.
Улучшению сердечной и легочной функции обычно сопутствует снижение медиаторов воспаления, наблюдаемое после ультрафильтрации. Исследования показали, что ультрафильтрат содержит широкий спектр низкомолекулярных медиаторов воспаления, включая C3a, C5a, интерлейкин (IL)-6, IL-8, фактор некроза опухоли, фактор, подавляющий миокардиальную функцию, и эндотелин. Удаление эндотелина-1 после MUF приводит к улучшению легочной сосудистой реактивности, которая имеет огромное значение, особенно у детей младше 4-6 месяцев, когда имеется высокая легочная сосудистая реактивность, а также у пациентов с этапными кавапульмональными реконструкциями. Фактор некроза опухоли является мощным медиатором воспаления, который участвует в развитии синдрома капиллярной утечки, наблюдаемой после искусственного кровообращения, и, как оказалось, лучше всего удаляется MUF. Несмотря на эти положительные эффекты MUF, источники литературы не дают однозначного преимущества одному виду ультрафильтрации перед другими, и, возможно, комбинация этих методов еще раз выявит лучший потенциальный результат.
Другой важной постперфузионной проблемой является продолжающееся кровотечение. Не приходится сомневаться в том, что использование MUF приведет к увеличению гематокрита пациента за счет удаления избытка общей воды, как это уже обсуждалось. Кроме того, MUF ведет к сокращению использования донорской крови и, как отмечено, к меньшему послеоперационному кровотечению. Даже более того, у детей старшего возраста могут предприниматься попытки совсем избежать использования донорской крови.
Следует иметь в виду и недостатки этих методов. Добавление фильтра к экстракорпоральному контуру добавляет к схеме уровень сложности, и, таким образом, появляется другая потенциальная область, в которой могут произойти связанные с контуром осложнения.
Противники MUF отмечают также следующие потенциальные проблемы:
-
возможность засасывания воздуха в артериальную канюлю;
-
дополнительное время пребывания пациента в состоянии гепаринизации;
-
возможность возникновения гиповолемии, поскольку из пациента удаляется жидкость;
-
гипотермия, так как фильтрующийся объем не проходит через теплообменник оксигенатора;
-
возможность повышения плазменной концентрации медикаментов (например, фентанила).
Другим интересным осложнением, потенциально связанным с ультрафильтрацией, является снижение тиреоидного гормона. Острый гипотиреоз может привести к снижению сократимости миокарда, частоты сердечных сокращений, сердечного выброса и повышению системного сосудистого сопротивления, которые, несомненно, будут прямо влиять на течение постперфузионного периода. Как и у других методов в медицине, преимущества и недостатки этого метода должны быть рассмотрены со всей серьезностью, однако на основании представленных данных, использование ультрафильтрации в процессе искусственного кровообращения, как и после его окончания, является чрезвычайно полезным, а сами методы часто используются в современной детской кардиохирургической практике с хорошим результатом и небольшим количеством осложнений.
К сожалению, сравнение широкого спектра пациентов с разными оперативными вмешательствами в различных условиях затруднительно, поэтому, можно сделать выводы о том, что для достижения задач по снижению общего содержания воды, удалению медиаторов воспаления, улучшению гематокрита, соответственно, кислородно-транспортной емкости крови и сохранению функции жизненно важных органов лучшей стратегией будет использование как ультрафильтрации в процессе перфузии, так и MUF, сразу, как только пациент будет отключен от искусственного кровообращения.
Дисфункция левого желудочка
Сократимость левого желудочка после операции может быть снижена. Это состояние обусловлено хирургически индуцированной ишемией в ходе коррекции, дооперационным состоянием миокарда, влияниями глубокой гипотермии и остановки кровообращения на комплайнс миокарда, а также новыми, измененными условиями нагрузки на ЛЖ, вызванными коррекцией. Дисфункция левого желудочка может быть устранена оптимизацией преднагрузки, повышением частоты сердечных сокращений, увеличением коронарного перфузионного давления, коррекцией уровня ионизированного кальция и добавлением инотропной поддержки. Зависимый от частоты сердечного ритма сердечный выброс новорожденного, пониженная способность миокарда к расслаблению, слабый ответ на кальций и катехоламины – факторы, указывающие на потребность в инотропной поддержке. Инотропная поддержка, как правило, начинается с допамина (3-10 мкг/кг/мин). Ряд исследований полагает, что эффект допамина у детей является зависимым от возраста. У маленьких детей после операций на сердце допамин повышает сердечный выброс, который в большей степени коррелирует с повышением частоты сердечных сокращений, чем с приростом ударного объема, тогда как у взрослых допамин отчетливо увеличивает ударный объем. Тем не менее, новорожденные и дети младшего возраста благоприятно отвечают на инфузию допамина с повышением системного артериального давления, сердечного выброса и улучшением системной перфузии.
Важным фактором усиления сердечной сократимости является кальций. Хотя кальций попал в некоторую немилость из-за обеспокоенности реперфузионным повреждением, в педиатрии он остается важным компонентом терапии после кардиохирургических вмешательств. У детей колебание уровня ионизированного кальция часто наблюдается в ближайшем постперфузионном периоде. Наиболее часто это происходит из-за относительно большой трансфузии продуктов крови, обогащенных цитратом и альбумином, которые связывают кальций. Такими продуктами являются цельная кровь, свежезамороженная плазма, тромбоциты и криопреципитат, которые необходимы для достижения гемостаза. Рутинное использование кальция в ходе раннего постперфузионного периода особенно полезно у пациентов со сниженной функцией левого желудочка. У пациентов с замедленным синусовым или узловым ритмом, кальций должен назначаться с осторожностью из-за возможности возникновения значимого замедления атриовентрикулярного проведения.
Адреналин в дозе (0,02-0,2 мкг/кг/мин) используется у пациентов со значимой дисфункцией левого желудочка, у которых сохраняется гипотензия с высоким давлением наполнения левого предсердия или с признаками сниженной сократимости, или с наличием регионарной ишемии по данным допплер-эхокардиографии.
Милринон, мощный ингибитор фосфодиэстеразы III, также является эффективным инотропом и вазодилататором у детей. Исследования у новорожденных после операций на открытом сердце выявили значительное снижение системного и легочного сосудистого сопротивления и повышение сердечного индекса, главным образом за счет большего ударного объема. Дети демонстрируют больший объем распределения и клиренс милринона по сравнению с взрослыми; так, нагрузочная доза, необходимая для достижения терапевтического уровня, может достигать 100 мкг/кг. У новорожденных нагрузочная доза милринона во время искусственного кровообращения составляет 100 мкг/кг с последующей постоянной инфузией препарата. Для поддержания терапевтического уровня через 90 мин после введения нагрузочной дозы начинается постоянная инфузия милринона со скоростью 0,2 мкг/кг/мин. У более старших детей скорость постоянной инфузии выше и обычно составляет 0,5-1,0 мкг/кг/мин.
Добутамин для детей является эффективным, хотя и более слабым инотропом. Несмотря на то, что сообщается о меньшем хронотропном эффекте у новорожденных, чем у допамина, на его фоне возможно возникновение значимых тахиаритмий. Это может быть связано со структурным сходством между добутамином и изопротеренолом. У детей после кардиохирургических вмешательств добутамин повышает сердечный выброс, в основном, за счет увеличения частоты сердечных сокращений. Эффективность добутамина представляется редуцированной у незрелых животных. Это согласуется с редуцированным состоянием а-рецепторов и более высоким уровнем циркулирующих катехоламинов у новорожденных.
Дисфункция правого желудочка
У новорожденных и детей разного возраста первичная дисфункция правого желудочка часто наблюдается после искусственного кровообращения. Например, после коррекции тетрады Фалло исходно существующая гипертрофия правого желудочка, правосторонняя вентрикулотомия и создание трансанулярной заплаты в выходном отделе правого желудочка, приводящее к острой легочной регургитации и объемной перегрузке правого желудочка, являются частыми причинами послеоперационной дисфункции правого желудочка. Лечение правожелудочковой дисфункции состоит из мероприятий, направленных на понижение легочного сосудистого сопротивления и сохранение коронарной перфузии без расширения ПЖ. Метаболический ацидоз должен быть купирован, а инотропные препараты выбраны с учетом их вазодилатирующих свойств (например, допамин, амринон или милринон). В случаях крайне выраженной желудочковой дисфункции низкие дозы адреналина (0,01-0,03 мкг/кг/мин) могут обеспечить инотропный эффект без вазоконстрикции. Искусственная вентиляция легких должна быть настроена таким образом, чтобы помогать работе правого желудочка и минимизировать легочное сосудистое сопротивление.
В отличие от ЛЖ нормальный ПЖ за счет низкого внутриполостного давления в ходе систолы получает две трети объема крови коронарных сосудов. У пациентов с правожелудочковой дисфункцией поддержание нормального или слегка повышенного систолического артериального давления обеспечивает максимум коронарной перфузии ПЖ и усиливает его сократимость. Если необходимость инотропной поддержки сохраняется после окончания раннего постперфузионного периода, должна активно предприниматься критическая оценка других возможных структурных и функциональных нарушений. Преднагрузка должна поддерживаться на нормальном или слегка повышенном уровне. Поскольку сократимость правого желудочка уменьшается, важно максимально увеличить преднагрузку в самой высокой части кривой Старлинга. Однако перерастяжение плохо переносится правым желудочком при наличии сниженного комплайнса и диастолической дисфункции желудочка. Избыточная нагрузка объемом может привести к выраженной диастолической дисфункции, трикуспидальной недостаточности и ухудшению антеградного кровотока. Как правило, центральное венозное давление выше 12-14 мм рт. ст. плохо переносится новорожденными и младенцами, имеющими дисфункцию ПЖ. При выраженной правожелудочковой дисфункции грудина должна быть оставлена открытой. Это устраняет сопротивление грудной клетки и воздействие искусственной вентиляции легких, позволяя ПЖ максимально увеличить конечно-диастолический объем. Дополнительной стратегией, используемой у новорожденных, младенцев и детей с тяжелой постперфузионной дисфункцией правого желудочка, является сохранение (или создание) право-левого шунта на уровне предсердий. Типичными кандидатами, которые имеют преимущество от использования этой методики, являются новорожденные, переносящие коррекцию тетрады Фалло и общего артериального ствола. Оставление межпредсердного сообщения открытым позволяет крови шунтироваться справа налево, поддерживая сердечный выброс левым желудочком и доставку кислорода в системную циркуляцию. Несмотря на то, что у этих пациентов происходит некоторое снижение артериальной сатурации, системное перфузионное давление у них улучшается и поддерживается адекватная коронарная перфузия ПЖ за счет эффективного сердечного выброса и увеличивающейся доставки кислорода к тканям. После того, как функция правого желудочка улучшается, а давление в правом предсердии снижается, право-левое шунтирование уменьшается, а системная артериальная сатурация повышается.
Если правожелудочковая дисфункция сохраняется и прогрессирует до такой степени, что системный сердечный выброс ставится под угрозу, необходимо рассмотреть использование экстракорпоральных методов поддержки жизнеобеспечения (использование экстракорпоральной мембранной оксигенации - ЭКМО).
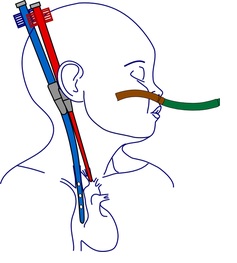
Когда ЭКМО используется для поддержки циркуляции, предпочтительной является вено-артериальная канюляция. Венозный и артериальный доступ может быть обеспечен через крупную центральную артерию и вену, для чего обычно используют сонную артерию и внутреннюю яремную вену, либо прямую канюляцию через грудную клетку. Считается, что при тяжелой дисфункции желудочка миокард, перенесший транзиторное повреждение (например, «оглушенный миокард»), со временем будет способен к восстановлению. ЭКМО используется для снижения напряжения стенки желудочка, для увеличения коронарного перфузионного давления и поддержания системной перфузии оксигенированной кровью. Также ЭКМО может применяться и при левожелудочковой недостаточности, хотя успех при данном состоянии встречается реже, чем при правожелудочковой дисфункции или легочной артериальной гипертензии. Пациенты, помещенные на ЭКМО в связи с невозможностью отлучения от искусственного кровообращения, демонстрируют значительно большую летальность, чем те пациенты, у которых ЭКМО была начата позднее в послеоперационном периоде. Пациенты, которые требуют ЭКМО после операции Фонтена, имеют наименьший процент выживаемости. Роль ЭКМО у пациентов с миокардиальным повреждением или легочной гипертензией состоит в обеспечении адекватного транспорта кислорода и системной перфузии, предоставляя желудочкам отдых и условия для восстановления. В послеоперационном периоде ЕСМО может быть даже эффективным методом реанимационного пособия, особенно, когда устанавливается быстро. У крупных младенцев с преимущественно правожелудочковой дисфункцией и удовлетворительной легочной функцией селективное правожелудочковое ассистирующее устройство может быть предпочтительнее ЭКМО.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии