Открытый артериальный проток. Хирургическое лечение порока
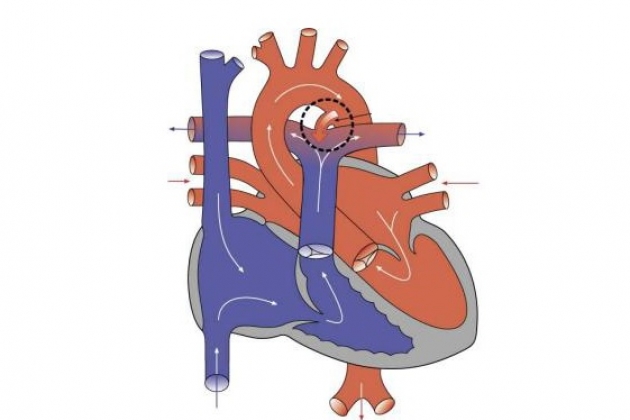
Артериальный проток у плода является неотъемлемым элементом плодного кровообращения. Он соединяет аорту с легочной артерией и вскоре после рождения закрывается, а затем облитерируется. Персистирование протока после истечения срока его закрытия приводит к гемодинамическим нарушениям и расценивается как псевдоврожденный порок.
Частота порока составляет около 20% всех врожденных аномалий сердца. Впервые данный порок упоминал Гален. Позднее его описывали de Capri, затем Aranzi и Fabrizzi и, наконец, Botallo в 1560 г., чьим именем был назван этот порок. Открытый артериальный проток у лиц женского пола встречается в 3 раза чаще, чем у лиц мужского пола. Он является характерной проблемой у недоношенных детей.
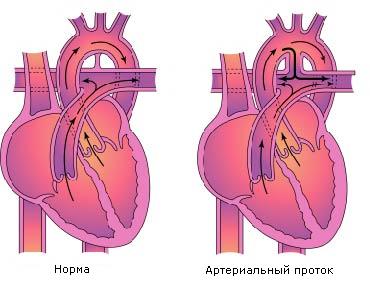
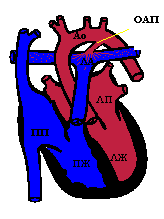
Анатомия
Открытый артериальный проток отходит от аорты сразу после отхождения от нее левой подключичной артерии и впадает в легочный ствол в месте бифуркации. Диаметр и длина его варьируют от 3-4 мм до 2-3 см. При левосторонней дуге аорты он чаще всего расположен слева, при правосторонней – справа. При наличии редких аномалий дуги аорты артериальный проток может быть двусторонним и иногда является составной частью сосудистого кольца. Проток имеет конусообразную форму, вершиной обращенную к легочной артерии, может быть коротким или длинным, прямым или извитым.
Проток может быть изолированным или сочетаться с другими ВПС. При так называемых дуктусзависимых пороках он выполняет функцию компенсаторного соединения, которое является жизненно необходимым. Артериальный проток остается незакрытым в течение нескольких месяцев у недоношенных детей, у каждого пятого ребенка он персистирует за период 1-2 года.
При инфузии ПГЕ1 в целях поддержания проходимости боталлова протока происходит артериализация его стенки. Структура стенки ОАП отличается от структуры остальных сосудов. Она более склонна к пролифирации и фиброзированию. Сохранение ткани протока при коррекции коарктации аорты в период новорожденности часто является причиной рецидива стеноза. У детей старшего возраста и взрослых ОАП может подвергаться кальцификации и становится хрупким, что создает повышенный риск кровотечения во время операции.
Патофизиология
После рождения ребенка с началом самостоятельного дыхания ЛСС снижается, что приводит к реверсии внутриутробного шунта крови из ствола легочной артерии в аорту на обратный – лево-правый. Изменение газового состава крови, протекающей по артериальному протоку, а также уменьшение концентрации ПГЕ1 и ПГЕ2 в крови приводят к повышению тонуса сосудистой стенки, ее спазму и облитерации протока с образованием артериальной связки.
В период внутриутробного развития основное количество крови поступает в большой круг кровообращения из правого желудочка и легочного ствола через артериальный проток. С первым вдохом родившегося ребенка легочное сопротивление падает и увеличивается давление в аорте. Направление потока крови по протоку меняется на противоположный. Насыщение кислородом крови, которая протекает по протоку, повышается после появления легочного дыхания. Это приводит к сокращению клеток гладкой мускулатуры в стенке протока. В механизме спазмирования протока принимают участие также брадикинин и ацетилхолин. Функциональное закрытие происходит в течение 15-20 ч, окончательная облитерация – на протяжении 2-10 нед.
Первичное нарушение гемодинамики связано с разницей давления в аорте и легочной артерии. Артериальная кровь поступает в легочную артерию в обе фазы сердечного цикла. У детей первых месяцев жизни сброс происходит только во время систолы, так как отсутствует диастолический градиент между аортой и легочным стволом. По мере физиологической инволюции строения легочных сосудов снижается общее ЛСС, увеличивается сброс артериальной крови в легочную артерию. Кровь поступает дальше в левые отделы сердца, создавая объемную перегрузку. При больших размерах протока объем легочного кровотока может в несколько раз превышать кровоток в большом кругу кровообращения.
Объем и направление сброса крови на протяжении жизни изменяются в зависимости от изменений общего легочного сопротивления. После рождения сопротивление большого и малого кругов кровообращения приблизительно равное, поэтому у новорожденных во время крика, плача и задержки дыхания направление тока крови может изменятся и вызывать появление временного цианоза. Небольшая разница давления является причиной временного отсутствия шума после рождения. По мере снижения ЛСС увеличивается объем лево-правого шунта. Повышение давления в левом предсердии и легочных венах приводит к рефлекторному спазму легочных артериол, а со временем – к склерозу легочных сосудов. Легочная гипертензия постепенно снижает градиент давления между аортой и легочным стволом сначала в диастолическую фазу, а затем и во время систолы. Объем артериовенозного шунта уменьшается вплоть до его исчезновения. В заключительной фазе гемодинамических нарушений возникает право-левый шунт.
Клиника, диагностика
Персистенция ОАП чаще всего отмечается у новорожденных с низкой массой тела и нарушением функции дыхания. У большинства новорожденных с данным пороком отсутствуют какие-либо симптомы заболевания. Боталлов проток большого диаметра сопровождается респираторной инфекцией, ателектазом, застойной сердечной недостаточностью и стойкой легочной гипертензией. При изменении направления сброса крови развивается цианоз в первую очередь нижних конечностей, так как артериальная кровь из дуги аорты смывает венозную кровь из артериального протока в нисходящую аорту.
Клинические проявления зависят от величины протока и стадии гемодинамических нарушений. Течение порока варьирует от бессимптомного, до крайне тяжелого. При больших размерах протока он проявляет себя уже с первых недель жизни признаками сердечной недостаточности, отставанием в физическом развитии.
К характерным признакам, на основании которых можно поставить диагноз, относятся непрерывный систолодиастолический шум во II-III межреберном промежутке слева от грудины и снижение диастолического артериального давления, иногда до нуля.
В связи с утечкой крови из аорты в легочную артерию увеличивается пульсовое давление. У новорожденных и грудных детей иногда определяется только систолический шум, который при возникновении пневмонии может исчезнуть. При развитии вторичной легочной гипертензии изменяется характер шума. С повышением давления в легочной артерии диастолический компонент шума уменьшается, а затем полностью исчезает. В этих случаях аускультативная картина состоит из короткого систолического шума во II межреберном промежутке по левому краю грудины и резкого акцента II тона над легочной артерией. В дальнейшем может исчезнуть и систолический шум.
На обзорной рентгенограмме грудной клетки отмечается увеличение тени сердца за счет расширения сначала левого, а затем обоих желудочков и левого предсердия, выбухание легочной артерии и усиление сосудистого рисунка. При отсутствии гипертензии изменений на рентгенограмме может не быть. При высоком общелегочном сопротивлении вследствие развития склеротических изменений в легочных сосудах и уменьшения объема сброса размеры сердца уменьшаются.
Электрокардиографическая картина также претерпевает изменения в зависимости от выраженности легочной гипертензии. При отсутствии высокой гипертензии на ЭКГ могут определяться признаки гипертрофии левого желудочка. При гиперволемической форме гипертензии могут быть признаки гипертрофии левого и правого желудочков, при склеротической стадии на первый план выступают признаки гипертрофии правого желудочка.
При ЭхоКГ-исследовании специфических признаков ОАП нет, поэтому используют косвенные признаки. Характерными являются увеличение полости левого желудочка и изменение соотношения размеров левого предсердия и диаметра аорты, которое в норме равно 1. При ОАП оно может составить 1,2 и больше. Иногда проток можно увидеть на ЭхоКГ.
В диагностике ОАП ведущее место принадлежит допплер-ЭхоКГ. Она позволяет определить шунтирование крови слева направо, а при обструктивной форме легочной гипертензии – противоположное, выявить увеличение полостей сердца, связанное с объемной перегрузкой левых отделов сердца. При помощи этого исследования можно провести дифференциальный диагноз между ОАП, дефектом аортолегочной перегородки и общим артериальным стволом, так как клиническая картина этих пороков может быть схожей.
Как правило, диагноз ОАП можно с уверенностью поставить по клиническим данным. При наличии легочной гипертензии клиническая картина теряет свои характерные признаки, поэтому возникает необходимость прибегнуть к рентгенохирургическому исследованию.
Если зонд из легочной артерии через проток проходит в аорту или на уровне легочной артерии определяется сброс артериальной крови, т.е. насыщение крови кислородом выше, чем в правом желудочке, можно заподозрить наличие ОАП. При введении контрастного вещества в область дуги аорты одновременное заполнение легочной артерии указывает на наличие лево-правого сброса через ОАП. Если контрастное вещество вводится в легочный ствол, и оно попадает в аорту, это свидетельствует о право-левом сбросе через проток.
Естественное течение
В отличие от недоношенных младенцев, у доношенных детей ОАП как порок обычно не закрывается спонтанно. Это обусловлено структурной аномалией гладкой мускулатуры его стенки, а не сниженной чувствительностью к кислороду. При больших ОАП развиваются сердечная недостаточность, рецидивирующие пневмонии. При малых протоках в большей степени, чем при больших, характерно осложнение септическим эндокардитом. Легочная гипертензия может привести к необратимым изменениям резистивных сосудов.
Течение порока крайне неблагоприятно у недоношенных детей. Перегрузка малого круга кровообращения и застойная сердечная недостаточность являются причиной смерти многих пациентов в первые несколько месяцев жизни. Впоследствии состояние стабилизируется. Средняя продолжительность жизни больных с ОАП составляет приблизительно 40 лет, а именно:
-
до З0 лет умирают 20 % больных;
-
до 45 лет – 42 %;
-
до 60 лет – 60 %.
Основными причинами летальных исходов являются:
-
сердечная недостаточность;
-
бактериальный эндокардит;
-
развитие и разрыв аневризмы протока.
Хирургическое лечение порока
Показания
Хирургическое закрытие артериального протока показано на всех стадиях заболевания, за исключением случаев высокой гипертензии с перекрестным или право-левым сбросом крови. В этих ситуациях ОАП способствует разгрузке правого желудочка и поэтому операция не только нецелесообразна, но и опасна.
Пациентам с явлениями сердечной недостаточности, особенно детям с малой массой тела, показано неотложное хирургическое вмешательство. Остальным детям выполняют операции в плановом порядке. Хирургическая операция необходима при любых размерах протока, за исключением случаев склеротической легочной гипертензии. Сроки операции определяются наличием сердечной недостаточности и гипертензии.
Недоношенным детям вначале проводят курс лечения индометацином, предложенный Heymann. При отсутствии эффекта ОАП закрывают хирургическим путем. У недоношенных детей операция в условиях острой инфекции противопоказана. У многих также недоразвита система коагуляции. Попытки нормализовать свертываемость крови переливанием свежезамороженной плазмы приводят к нежелательной объемной нагрузке и не являются необходимыми на дооперационном этапе.
Старшие дети или взрослые с большим артериальным протоком и сердечной недостаточностью или наличием право-левого шунта нуждаются в катетеризации для оценки ЛСС. При аневризме или кальцинировании протока показана аортография. Пациентам с бактериальным эндокардитом следует провести курс терапии антибиотиками. Если лечение позволило купировать инфекцию, проток можно закрыть спустя несколько месяцев. При наличии устойчивости к консервативному лечению операцию безотлагательно выполняют на высоте эндокардита.
Общие замечания к технике операции
Gross в 1938 г. впервые перевязал артериальный проток. Это было первое в истории сердечной хирургии вмешательство по поводу ВПС, стимулировавшее развитие клинической сердечно-сосудистой хирургии. Как и все новое в хирургии, закрытие боталлова протока казалось трудным и опасным вмешательством, особенно у пациентов с бактериальным эндокардитом и легочной гипертензией. Уже скоро операция потеряла эту репутацию. Однако в осложненных случаях может возникнуть сильное, быстро опустошающее кровотечение, вызывающее ужас даже у опытного хирурга. Поэтому врач, испытавший подобное осложнение в своей хирургической практике, всегда будет относиться к этому пороку с уважением. Операция должна выполняться с осторожностью и осмотрительностью. Наиболее опасным моментом является подведение изогнутого зажима под проток, чтобы захватить лигатуру. Неожиданно возникшее внезапное тяжелое кровотечение из задней стенки протока, трудно контролировать. Cooley в такой отчаянной ситуации предлагает чрезвычайный прием – искусственную фибрилляцию желудочков, дающую 5-8 минут более благоприятных условий для остановки кровотечения. Электрический фибриллятор для этих целей всегда наготове в его операционных.
Закрытие ОАП стандартным левосторонним доступом
Перевязка боталлова протока
Обычно операцию выполняют левосторонним заднебоковым доступом по IV межреберью. После оттеснения легкого вскрывают плевру средостения позади места прохождения блуждающего нерва, разрез продлевают вдоль нисходящей аорты в сторону левой подключичной артерии. Легкое удерживают в нужном положении при помощи швов-держалок, наложенных на передний край разреза плевры средостения. Если верхняя межреберная вена лежит на аорте, ее следует пересечь для улучшения экспозиции. Аккуратно сепарируют подключичную артерию, нисходящую аорту и дугу аорты. Необходимо четко определить, является ли выделенный сосуд артериальным протоком, так как описаны случаи ошибочного лигирования трахеи, аорты или левой легочной артерии.
Ориентирами для обнаружения протока являются блуждающий нерв и его возвратная гортанная ветвь, которая огибает артериальный проток. Если предполагаемый проток не огибается возвратным нервом, значит, это другой сосуд – дуга аорты, подключичная артерия или что-нибудь еще. Поэтому следует найти блуждающий нерв и, подтягивая его кверху и книзу, идентифицировать возвратный нерв. Боталлов проток находится здесь. Могут возникнуть трудности с обнаружением протока, когда он частично проходит внутри перикарда, поэтому перед обведением протока лигатурой перикард препарируют от его стенки и прилежащей левой главной легочной артерии. Рыхлые ткани выше и ниже протока разделяют ножницами, оставляя только узкую часть позади протока, который еще полностью не выделен. Когда оценены размеры и характер стенок протока, наиболее ответственное выделение задней поверхности выполняют с помощью изогнутого зажима. Проведение его снизу безопасно, но следует соблюдать осторожность. Необходимо следить за тем, чтобы кончик инструмента проходил глубже протока и поверх возвратного нерва. Под проток подводят толстую лигатуру и оставшиеся ткани разделяют для увеличения длины и возможности пережатия зажимом. Оттягивая кзади блуждающий и возвратный нервы, боталлов проток перевязывают у аортального конца. Затем перевязывают легочный конец, оставляя максимальное расстояние между лигатурами. Для надежного перекрытия просвета обычно прошивают проток между лигатурами и перевязывают обе его полуокружности. Вместо лигатур иногда используют кисетные швы, осторожно проведенные по адвентиции у обоих концов протока. Вначале перевязывают кисетный шов у аортального конца. Если проток достаточно велик, на короткое время пережимают перешеек аорты для снижения давления в момент перевязки первого шва. Подтягивая аорту латерально, завязывают шов у легочного конца.
Для лигирования протока используют также специальные металлические клипсы. В исключительных случаях ОАП предварительно прошивают швами с прокладками, а затем пересекают. Данный метод препятствует развитию реканализации протока, однако он отличается повышенным риском возникновения кровотечения и поэтому редко используется в практической кардиохирургии.
При закрытии протока у новорожденных следует соблюдать особую осторожность, оставляя на протоке окружающие его ткани.
У новорожденных с аневризматически расширенным артериальным протоком, прилегающим к нисходящей аорте и ее дуге, рекомендуется предварительно обвести тесемками аорту, а затем уже артериальный проток. При помощи изогнутого зажима под артериальный проток подводят две толстые лигатуры, которые затем завязывают и перекрывают просвет протока. Не исключена вероятность возникновения острого кровотечения, поэтому необходимо иметь наготове сосудистые зажимы и функционирующий отсос.
При появлении кровотечения проток прижимают небольшим плотным марлевым тампоном на зажиме. У анестезиолога всегда должна быть готова кровь для экстренного переливания. При необходимости торакотомический доступ должен быть увеличен. Быстро выделяют аорту выше и ниже протока и пережимают двумя изогнутыми зажимами. Прямое давление на проток теперь позволяет контролировать кровотечение. Изогнутым зажимом или марлевым тампоном перекрывают легочный конец протока. Отверстие в аорте ушивают 6/0 проленовым швом и снимают зажимы с аорты. Легочный конец дефекта закрывают непрерывным 6/0 проленовым швом под зажимом или медленно смещая марлевый тампон.
Пересечение артериального протока
Пересечение протока выполняют, если он слишком короток для подведения двух лигатур с расстоянием между ними хотя бы в несколько миллиметров. Выделяют блуждающий нерв и подводят под него держалки. Мобилизуют проток, перешеек и проксимальный отдел нисходящей аорты. Аорту подтягивают кпереди, что позволяет выделять заднюю поверхность протока под контролем зрения.
Аорту отжимают изогнутым зажимом в месте отхождения протока. Для пережатия легочного конца протока используют прямой зажим, отводя возвратный нерв медиально. Натяжение обоих зажимов недопустимо из-за риска соскальзывания. Наоборот, их следует толкать в сторону легочной артерии и аорты. Если проток слишком короток, аорту пережимают прямыми зажимами проксимальнее и дистальнее протока, одновременно пережимая проток. Последний пересекают и каждый конец ушивают проленовой нитью 5/0, используя сначала матрацный, затем обвивной шов.
Закрытие ОАП через трансстернальный доступ
Срединный доступ для закрытия ОАП применяют в случае, когда порок сопровождается другими врожденными внутрисердечными аномалиями, подлежащими коррекции с применением искусственного кровообращения. После типичного выделения сердца и подшивания перикарда к грудине ствол легочной артерии оттягивают книзу за адвентицию. Аккуратно препарируют структуры, находящиеся между аортой и стволом легочной артерии, выделяя правую ветвь легочной артерии. Для выделения левой легочной артерии и артериального протока разрезают верхний карман полости перикарда. При наличии короткого и широкого артериального протока важно не захватить в шов участок аорты. Для закрытия протока используют лигатуру либо накладывают полипропиленовый шов. При необходимости пересечения артериального протока лучше использовать шов с прокладками во избежание кровотечения, которое может возникнуть вследствие ослабления лигатуры на аортальном конце протока.
Серьезную хирургическую проблему представляет кальцинированный, воспаленный или аневризматически расширенный артериальный проток. Простое лигирование может оказаться трудным и опасным. В этих случаях проток закрывают изнутри легочного ствола в условиях искусственного кровообращения, гипотермии и сниженной объемной скорости перфузии. Во время охлаждения пациента пережимают пальцем артериальный проток или перекрывают ветви легочной артерии турникетами для предупреждения растяжения сердца. По достижении температуры 20-24 0С снижают объемную скорость перфузии до 1/4 исходной, но полностью кровообращение не останавливают из-за опасности попадания воздуха в аорту. Легочный ствол открывают дистально, продлевая разрез на левую ветвь. Устье протока ушивают или закрывают синтетической заплатой. Для уменьшения поступления крови в операционное поле можно временно перекрыть артериальный проток при помощи введенного в него баллон-катетера. Если устье боталлова протока широкое или есть необходимость удаления септических наслоений, предпочтительнее использовать краткосрочную остановку кровообращения в условиях глубокой гипотермии. При этом необходимо перекрыть турникетами безымянную и левую сонную артерии, пережать восходящую аорту и ввести кардиоплегический раствор для предупреждения воздушной эмболии. После вшивания заплаты восстанавливают кровообращение, удаляют воздух через пункционное отверстие в аорте, снимают зажим с восходящей аорты и освобождают турникеты на сосудах дуги. Во время согревания пациента ушивают проленом разрез легочной артерии.
Закрытие ОАП правосторонним доступом при левосторонней дуге аорты
Закрытие артериального протока возможно также через правосторонний доступ. Его используют при не диагностированной правосторонней дуге аорты во время операции из левостороннего доступа либо в том случае, когда необходимо проведение важной дополнительной операции с правой стороны при левостороннем расположении дуги аорты. После торакотомии вскрывают перикард кпереди от места прохождения диафрагмального нерва. На перикард накладывают швы-держалки, фиксирующие его к разрезу кожи. Аккуратно препарируют пространство между аортой и стволом легочной артерии, выделяют правую легочную артерию и устье левой легочной артерии. После этого выделяют артериальный проток и перевязывают его толстой лигатурой.
Распространенным вариантом вмешательства стало закрытие артериального протока доступом через торакоскопию. Это метод позволяет проводить операции даже у новорожденных со значительным дефицитом массы тела.
Закрытие артериального протока доступом чрез аорту
Альтернативная техника описана Johnson и Кron. Отверстие артериального протока закрывают изнутри аорты между двумя зажимами, наложенными проксимально и дистально от протока. Просвет протока со стороны легочной артерии перекрывают баллон-катетером.
Закрытие ОАП катетерным способом
Развитие интервенционной кардиологии позволило проводить закрытие артериального протока при помощи стента или нитиноловой пробки. Данный метод используется все чаще, даже у детей раннего возраста.
Впервые закрытие ОАП чрескожным путем было выполнено РоіІ8тапп и соавторами в 1967 г. Была использована специальная пробка. Техника предложенной процедуры была довольно сложной. Помимо методики баллонной атриосептостомии специалисты разработали методику закрытия просвета ОАП при помощи специального зонтика. В последующем техника процедуры была модифицирована. Согласно новой методике ОАП закрывали двумя отдельными зеркально расположенными зонтиками, которые доставлялии по венозной системе и раскрывали последовательно на аортальном и легочном концах ОАП. Высокая частота остаточного шунтирования, довольно сложная техника постановки и высокая стоимость процедуры явились причиной того, что в 90-х годах зонтики Rashkind перестали использовать в клинической практике. Однако они послужили прообразом нового поколения имплантатов, таких, как Cardio SEAL/Starflex. Для окклюзии ОАП особое значение имеют спирали. Они могут имплантироваться с венозной или более удобной артериальной стороны. Спираль раскрывается таким образом, что один виток спирали располагается в легочной артерии, а остальные в аортальном конце. Внутрисосудистые пружинки используются при ОАП малых и средних размеров, с достаточно широкой аортальной ампулой. При наличии широкого ОАП с расширенной аортальной ампулой наилучшие результаты получены при использовании Amplatzer Duct Septal Occluder . Пробки ADO состоят из нитиноловой сети, содержащей полиэфирные заплаты. Они имеют разные диаметры – 4, 6, 8, 10 и 12 мм, выпускаются с указанием соответствующих размеров и позволяют закрывать даже самые широкие ОАП при отсутствии персистирующей легочной гипертензии. С аналогичной целью можно использовать технику одновременной имплантации двух стентов венозным и артериальным доступом, но в этом случае процедура отличается высоким риском эмболии. При наличии широкого ОАП по типу окна лучшие результаты получены при использовании зеркально расположенных зонтиков. При туннелеобразных длинных ОАП можно использовать приспособление Gianturco-Grifk, однако более легкой является имплантация ADO. К осложнениям, которые возникают при чрескожном закрытии ОАП, относятся:
-
смещение имплантата с эмболизацией сосуда;
-
отсутствие пульса, чаще у детей младшего возраста.
Эмболизированные спирали можно относительно легко извлечь из просвета сосуда во время зондирования при помощи различных приспособлений.
Катетерное закрытие протока находится на стадии разработки, дает большее число осложнений, чем хирургическое, и является более дорогостоящим.
Послеоперационное течение
Послеоперационный период после закрытия изолированного артериального протока не отличается от такового после выполнения простых операций на органах грудной клетки. Плевральный дренаж при отсутствии осложнений удаляют на 2-е сутки. Особый контингент составляют больные с низкой массой тела и выраженной сердечной недостаточностью. Данной категории больных может потребоваться применение кардиотоников.
Крайне редко наблюдаются следующие осложнения:
-
лимфорея;
-
пневмо- и гемоторакс;
-
повреждение возвратного нерва;
-
послеоперационное нагноение раны.
Госпитальная летальность составляет менее 1%. В отдаленном периоде изредка отмечается реканализация, если проток был только перевязан и не был прошит или пересечен.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии