Опухоли лимфатической системы: виды, причины возникновения, последствия
Общей темой данной главы является мысль о том, что нарушение регуляции иммунной системы может приводить к внезапному появлению новообразований, особенно лимфоидных клеток. Это происходит у пациентов с первичными иммунодефицитными заболеваниями, СПИДом и иммуносупрессией после трансплантации органов. При этих состояниях особенно часто развиваются агрессивные В-клеточные лимфомы, часто ассоциированные с вирусом Эпштейна-Барр.
Лимфоидный лейкоз и лимфома были изначально отнесены к разным нозологиям на основании клеточной морфологии и клинических данных. Определение «лейкоз» подразумевает, что опухолевые клетки встречаются преимущественно в периферической крови и/или в костном мозге. Лимфома представляет собой твердые массы в лимфатических узлах, селезенке, тимусе или нелимфоидных органах. Иногда одни и те же типы опухолевых клеток могут встречаться во всех указанных местах (лейкоз/лимфома).
В 1996 г. Всемирная организация здравоохранения (ВОЗ) рекомендовала использовать классификацию опухолей, основанную на морфологии исходной клетки: В-клетки в противопоставление T/NK (Т-клетки/натуральные киллеры), и степени дифференцировки: незрелые (клетки-предшественники) в противоположность зрелым (периферическим). Считается, что опухоли вырастают из трансформированных лимфоидных клеток, которые останавливаются в своем развитии. Они имеют такие же поверхностные маркеры и многие другие свойства, как и соответствующие нормальные клетки на этой стадии развития. Опухолевые клетки, однако, могут не продолжать созревание и накапливаться в большом количестве; все они происходят от единого клона (т.е. они моноклональны). Они также будут занимать одни и те же участки и мигрировать теми же путям развития, что и их нормальные двойники, а именно костный мозг для незрелых В-клеток, тимус для незрелых Т-лимфоцитов и т.д.
Анализ ДНК, извлеченной из В- и Т-клеточных опухолей (Саузерн-блоттинг), выявляет одинаковый участок связывания и в гене иммуноглобулинов, и гене Т-клеточного рецептора соответственно. Такие данные свидетельствуют, что все опухолевые клетки имеют одинаковую реаранжировку этих генов, что и позволяет судить о моноклональности такого лимфоидного роста.
Для некоторых лимфоидных новообразований были определены уникальные молекулярные аномалии, которые могут способствовать трансформации этих клеток. Эти молекулярные изменения также внесены в схему классификации. Поскольку классификация ВОЗ основывается в большей степени на природе клеток, чем на клинических проявлениях, лейкозы и лимфомы не различают, если они представлены одинаковыми типами опухолевых клеток. Классификация ВОЗ имеет большое практическое значение, поскольку терапия лейкозов и лимфом часто одна и та же.
Лимфобластный лейкоз/лимфома из В-клеток-предшественников
В-клеточный острый лимфобластный лейкоз/лимфома (В-ОЛЛ) затрагивает про- и пре-В-клетки или все незрелые стадии развития В-клеток, что демонстрируется экспрессией поверхностных CD- маркеров и стадией реаранжировки гена Ig в каждом индивидуальном случае лейкоза. Опухолевые клетки могут экспрессировать маркеры бластов или маркер стволовых клеток CD34 (особенно про-В-клетки), а также «ранние» маркеры В-лимфоцитов: CD 10 и CD 19. Так же как и нормальные про-В- или пре-пре-В- и пре-В-клетки, соответствующие клетки ОЛЛ экспрессируют терминальную дезоксинуклеотидилтрансферазу (TdT) в ядрах. Экспрессия этого фермента, в норме необходимого для реаранжировки генов Ig, отражает тот факт, что эти клетки В-ОЛЛ находятся в процессе генной реаранжировки. Это значит, что они еще не экспрессируют полную молекулу lg на своей поверхности и имеют только цитоплазматические р-цепи, что соответствует стадии пре-В-клеток. При лечении детей с этим типом лейкоза наиболее эффективна химиотерапия.
Существует также вариант агрессивного незрелого В-ОЛЛ, который является лейкозным двойником лимфомы Беркитта, при котором имеются сходные характеристики транслокации генов. Эти клетки похожи на незрелые В-клетки, только что вышедшие на периферию из костного мозга. Они экспрессируют CD20, обладают «выключенной» TdT, их ген Ig полностью реаранжирован, а на клеточной поверхности находятся IgM.
Лимфома/лейкоз Беркитта
Лимфома Беркитта может проявляться и как лейкоз, и как лимфома. Она характеризуется транслокацией онкогена с-тус в локус гена Н-цепи Ig или одного из двух генов L-цепей — t(8; 14), t(8; 22) или t(2; 8). Белок с-тус в норме вовлекается в активацию генов для клеточной пролиферации, когда покоящаяся клетка получает сигнал к делению. Транслокация в гены Ig приводит к увеличению экспрессии с-тус и активации клеточной пролиферации. Возможно, антигенная стимуляция В-клеток инициирует повышение экспрессии с-тус под контролем гена Ig.
В экваториальной Африке эта лимфома является эндемичной и связана с инфицированием В-клеток вирусом Эпштейна-Барр. Лимфома Беркитта — это одна из опухолей, часто развивающихся у пациентов с иммуносупрессией (при СПИДе и медикаментозной иммуносупрессии). В клетках лимфомы Беркитта иногда обнаруживается геном вируса Эпштейна-Барр. Другая опухоль, диффузная крупноклеточная В-лимфома, обсуждается далее в этой статье.
Фолликулярная лимфома
Фолликулярная лимфома представляет собой трансформированные В-клетки, в норме обнаруживаемые в фолликулах лимфатических узлов. В-клетки стимулируются антигеном в фолликуле, образуя зародышевый центр. Они могут отвечать на эту стимуляцию пролиферацией, переключением изотипов иммуноглобулинов и дифференцировкой в плазматические клетки. Если их антитела плохо соответствуют этому антигену или имеют к нему низкую аффинность, то клетки подвергаются апоптозу, или программируемой клеточной гибели. При фолликулярных лимфомах ген bcl-2, который продуцирует белок, препятствующий апоптозу, транслоцируется в ген Н-цепи Ig t(14; 18). Это приводит к продолжительной экспрессии белка bcl-2, предотвращающего гибель клеток. Фактически, такие В-клеточные новообразования имеют только низкий уровень пролиферации, заболевание отличается длительным хроническим течением. Их фенотип (поверхностные CD-маркеры) соответствует фенотипу у нормальных В-клеток фолликулярного центра: CD19+, CD20+, CD10+ и поверхностные иммуноглобулины.
Лимфома из клеток мантийной зоны
В норме зародышевый центр окружен венцом малых покоящихся В-клеток, которые не ответили на антиген. Новообразования этих клеток мантийной зоны обладают таким же В-клеточным фенотипом, как и их нормальные двойники, CD19+, CD20+. CD5+, slgM. При многих лимфомах из мантийных клеток происходит транслокация гена bcl-1 в область гена Н-цепи Ig — t(ll; 14), приводящая к избыточной экспрессии белка циклина D1. Циклин D1 в норме отвечает за стимуляцию прогрессии клеточного цикла от фазы Gj к фазе S, приводящей к делению клетки. Эта лимфома обладает более высокой пролиферативной активностью и более агрессивным течением, чем фолликулярная.
Лимфома из клеток краевой зоны
Лимфомы из клеток краевой зоны наиболее часто встречаются в лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT), и, что интересно, могут быть связаны с хронической антигенной стимуляцией или аутоиммунным заболеванием этого органа. Например, хроническая инфекция Helicobacter pilory желудка может привести к развитию лимфомы желудка, которую, таким образом, можно предотвратить терапией антибиотиками. Сходным образом у пациентов с аутоиммунным тиреоидитом (mupeoudum Хашимото) и аутоиммунным заболеванием слюнных желез (синдром Шегрена) существует высокий риск развития В-клеточной лимфомы в пораженном органе.
Взаимосвязь между этими аутоиммунными заболеваниями или инфекцией и лимфомой позволяет предложить две интересные и не противоречащие друг другу гипотезы. Во-первых, хроническая антигенная стимуляция обеспечивает благоприятную почву для развития В-клеточной лимфомы. В-клетки, в которых гены иммуноглобулинов продолжают подвергаться соматическим мутациям, могут накапливать трансформирующие мутации при продолжительной стимуляции. Во- вторых, дефект в регуляции В-лимфоцитов ввиду то ли внутренних причин, то ли недостаточного подавления их активности Т-лимфоцитами приводит как к аутоиммунному заболеванию, так и, возможно, к лимфоме.
Опухолевые клетки иммунной системы мигрируют по тем же путям, что и их нормальные двойники. Лимфома краевой зоны долгое время остается локализованной, а затем повторяет движение нормальных клеток MALT, перемещаясь в другие участки MALT.
Хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов
Считается, что хронический лимфоцитарный лейкоз (ХЛЛ)/лимфома из малых лимфоцитов (ЛМЛ) является опухолевым перерождением субпопуляции В-лимфоцитов, известных как В-1-клетки. У некоторых пациентов ее первым клиническим проявлением является лейкоз (с первичным вовлечением крови и костного мозга), тогда как у других больных сначала вовлекаются лимфатические узлы. Так же как и нормальные В-1-клетки, клетки ХЛЛ/ЛМЛ экспрессируют маркеры зрелых В-клеток CD19 и CD20, а также CD5 и поверхностный lgM.
Хронический В-клеточный лейкоз — это наиболее распространенный лейкоз в Северной Америке и Западной Европе. Особенно часто он встречается у людей старших возрастных групп. Такие больные крайне чувствительны к инфекции, что наводит на мысль о том, что их неопухолевые клетки функционируют недостаточно хорошо. Характерно наличие аутоантител, особенно против эритроцитов, приводящих к развитию гемолитической анемии. Антитела могут синтезироваться опухолевым клоном или, что бывает чаще, неизмененными В-клетками. Взаимосвязь этих аутоиммунных состояний с лейкозом/лимфомой снова наводит на мысль о том, что лимфоидное новообразование возникает на месте нарушения иммунной регуляции или по причине ее возникновения. Заболевание характеризуется долгим клиническим течением, но возможно и массивное поражение каждого органа, периферической крови и костного мозга опухолевыми клетками.
Диффузная крупноклеточная лимфома из В-клеток
Диффузная крупноклеточная лимфома из В-клеток — это гетерогенная группа лимфом, которые могут возникать de novo на единственном участке и быть формой прогрессии одной из перечисленных медленно растущих лимфом (например, фолликулярной) или следствием плохо контролируемой инфекции вирусом Эпштейна-Барр в организме больных, получающих иммуносупрессивные препараты (например, у ВИЧ-позитивных лиц, больных после трансплантации органов или у пациентов с иммунодефицитом). Во всех случаях клетки экспрессируют В-клеточные маркеры CD 19 и CD20 и часто — поверхностный Ig. Одна подгруппа имеет транслокацию bcl-6 — протоонкогена, который в норме действует как супрессор транскрипции некоторых генов, необходимых для нормального развития В-лимфоцитов и зародышевых центров.
Поведение возникших de novo диффузных крупноклеточных В-клеточных лимфом непредсказуемо. Благодаря современному микроанализу кДНК для этих разновидностей опухолей лимфомы разделили на две крупные группы. Это разделение связано с различиями в образцах генной экспрессии (продукция и PH К), причем выявлена корреляция между этими молекулярными образцами и поведением опухоли. Такая молекулярная характеристика должна привести к лучшему пониманию биологии лимфом и разработке практических рекомендаций к лечению.
Взаимосвязь инфекции вирусом Эпштейна-Барр с диффузными крупноклеточными лимфомами из В-клеток и лимфомой Беркитта у пациентов с иммуносуппрессией наглядно показывает, каковы последствия нарушения саморегуляции иммунной системы. Инфекция В-клеток вирусом Эпштейна — Барр (через рецептор вируса CD21) приводит к поликлональной пролиферации В-лимфоцитов. У здоровых индивидуумов В-клетки, инфицированные вирусом Эпштейна-Барр, удаляются из организма цитотоксическими Т-лимфоцитами. Если Т-клеточный контроль оказывается недостаточным, инфицированные В-лимфоциты продолжают экспансивный рост, и в некоторых из них могут произойти дополнительные мутации, такие как транслокация гена с-туе, что вызовет злокачественную трансформацию клеток и последующий независимый рост. Например, вирус Эпштейна-Барр можно использовать для продления жизни В-клеток в тканевой культуре, в которой В-клетки не являются объектом, контролируемым Т-лимфоцитами. Это также важно в клинической практике: у пациентов, получающих иммуносупрессивную терапию, существует точка, в которой пока еще возможно предотвратить развитие В-клеточной лимфомы, прекратив терапию и разрешив иммунной системе организма сдерживать патологическую В-клеточную пролиферацию. Конечно, это невозможно у больных СПИД.
Опухоли плазматических клеток
Опухолевый рост плазматических клеток может происходить на ограниченном участке (изолированно), приводя к плазмоцитоме, или на многих, преимущественно в костях, и тогда он называется множественной или плазмоклеточной миеломой. Как и для нормальных плазматических клеток, фактором роста для миеломных клеток является IL-6.
Опухолевые плазматические клетки могут продолжать синтезировать и секретировать свои продукты — белки, составляющие иммуноглобулины. В большинстве случаев эти секретируемые моноклональные белки вызывают у пациента больше проблем, чем сами перерожденные клетки. Депозиты легких цепей, названные амилоидом, могут вызывать недостаточность разных органов, особенно почек. Выделение из мочи некоторых больных множественной миеломой свободных легких цепей иммуноглобулина — белка Бенс-Джонса — позволяет понять их структуру. Эти белки являются моноклональными; они определяются в сыворотке и иногда в моче в виде М-пика в у-области на электрофореграмме. Пик выше пограничной полосы формируется вследствие того, что все иммуноглобулины идентичны по размеру и заряду и мигрируют в одно и то же место. В большинстве случаев продуцируются моноклональные IgG; IgA являются следующим наиболее часто обнаруживаемым изотипом иммуноглобулина. Уровни других нормальных Ig у этих пациентов значительно снижаются, что делает их иммуносупрессивными по продукции антител и, таким образом, восприимчивыми к инфекции. До появления развернутой клинической картины миеломы у больных может появляться небольшое количество моноклональных Ig в течение многих лет. Многие пациенты остаются на этой стадии, и заболевание у них не прогрессирует. Маленькие М-пики могут быть обнаружены в ассоциации с другими лимфоидными новообразованиями, такими как ХЛЛ, и даже при неопухолевых состояниях.
Лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема)
Лимфоплазмацитарная лимфома/макроглобулине- мия Вальденстрема — это новообразование единственного клона В-клеток. При микроскопии оно выглядит как смесь лимфоцитов, плазматических клеток и чего-то промежуточного — лимфоплаз- моцитоидных клеток. Опухолевые клетки находятся в лимфатических узлах, костном мозге и селезенке. Хотя эти лимфомы встречаются нечасто, они представляют интерес для иммунологов вследствие гиперпродукции IgM. Крупный размер и высокая концентрация IgM в крови может сочетаться с медленным кровотоком и «засорением» сосудов их агломератами (синдром повышенной вязкости крови). У некоторых пациентов IgM имеют патологическую структуру, вследствие чего при охлаждении они выпадают в осадок (с образованием криоглобулинов) и вызывают расстройства микроциркуляции в конечностях больных (пальцы рук и ног).
Т-клеточные новообразования
Острый лимфобластный лейкоз/лимфома из Т-клеток-предшественников
Острый лимфобластный лейкоз из клеток-предшественников Т-лимфоцитов (Т-ОЛЛ) — это новообразование из незрелых Т-клеток с характеристиками незрелых тимоцитов, остановившихся в своем развитии. Клетки Т-ОЛЛ экспрессируют все Т-клеточные маркеры (CD2, CD5 и CD7), которые появляются на ранних стадиях развития Т-клеток. Некоторые Т-ОЛЛ обладают характеристиками незрелых клеток тимуса и не экспрессируют CD4 или CD8 (т.е. они дважды негативные). Большинство нормальных тимоцитов и клеток Т-ОЛЛ являются более зрелыми, экспрессируя оба маркера: и CD4, и CD8 (дважды позитивные); при этом CD3 на своей поверхности они экспрессируют в небольшом количестве или совсем не экспрессируют (их обозначают как общие тимоциты). В этих клетках еще не завершена реаранжировка генов их Т-клеточного рецептора (TCR) и все еще экспрессируется TdT. Острый лимфобластный лейкоз проявляется в виде лейкоза или тяжелого процесса в тимусе. Лечение не столь успешно, как при В-ОЛЛ.
Новообразования из периферических Т-клеток
Клинические проявления лимфом из периферических Т-клеток разнообразны. Они обнаруживаются там, куда обычно мигрируют Т-клетки, а именно в коже, легких, стенках сосудов, ЖКТ и лимфатических узлах. Они также сохраняют некоторые функции нормальных зрелых Т-клеток. Вследствие этого продукция цитокинов злокачественными клетками приводит к скоплению воспалительных клеток, в том числе эозинофилов, плазмоцитов и макрофагов. Часто лимфы из периферических Т-клеток более агрессивны, чем из В-клеток. Две болезни из этой группы рассмотрим подробнее.
Кожная Т-клеточная лимфома
Если опухоль ограничена пределами кожи, Т-клеточную кожную лимфому часто называют ее исторически сложившимся названием «грибовидный микоз», поскольку раньше считалось, что пациенты страдают от хронической грибковой инфекции, при которой отмечаются восковое перерождение и истончение кожи в течение многих лет. Сейчас понятно, что это кожное заболевание обусловлено инфильтрацией эпидермиса злокачественными С04+-Т-клетками. В дальнейшем клетки могут распространяться в лимфатические узлы и даже в кровь. Злокачественные Т-клетки, обнаруживаемые в кровотоке, называются клетками Сезари; соответственно, у больного развивается синдром Сезари.
Т-клеточная лимфома/лейкоз взрослых
Т-клеточная лимфома/лейкоз взрослых (ТЛЛВ) представляет собой агрессивное Т-клеточное новообразование. Его описали в 1970-е гг. в одной из областей Японии, где оно являлось эндемичным. Также его обнаружили у обитателей Карибских островов, в некоторых частях центральной Африки и в небольшой области на юго-востоке США. Обычно ТЛЛВ является новообразованием из зрелых С04+-Т-клеток. Для таких клеток аутокринным фактором роста является IL-2. При ранних попытках терапии показано, что это новообразование временно (несколько месяцев) отвечает на введение антител (названных как анти-Тас); как было выявлено позже, они являются специфичными для a-цепи рецептора к IL-2 (CD25).
Заболевание вызывается человеческим Т-клеточным лимфотропным вирусом I типа из семейства ретровирусов (human Т cell lymphotropic virus 1 — HTLV-1), который был описан и выделен еще до открытия СПИДа и ВИЧ. Геномная структура провируса похожа на ВИЧ; она тоже содержит регион LTR и кодирует структурные и регуляторные белки, а также вирусные ферменты (обратную транскриптазу, интегразу и протеазу). Вирусный белок Tax, который трансактивирует транскрипцию HTLV-1 путем связывания с областью LTR, активирует также и клеточные гены, в том числе те, которые кодируют IL-2, а-цепь IL-2R и гормон, подобный паратиреоидному (в обычных условиях не экспрессируется Т-клетками). Поэтому активация провирусной транскрипции связана с активацией и пролиферацией Т-клеток. У пациентов с ТЛЛВ часто отмечают значительно повышенную концентрацию кальция, что является результатом усиленного синтеза паратиреоидподобного гормона
Пути передачи HTLV-1 похожи на пути передачи ВИЧ в том смысле, что он передается через кровь и жидкости тела; наиболее эффективен путь передачи через грудное молоко. Поэтому многие пациенты инфицируются HTLV-1 в младенческом возрасте. Инкубационный период у этого вируса длительный, обычно 20-40 лет. В основном вирус инфицирует С04+-Т-клетки, а также поражает нервную систему. У некоторых пациентов заболевание имеет клинические черты неврологического процесса.
К счастью, только примерно у 1 % инфицированных пациентов развивается ТЛЛВ. Неясно, что инициирует развитие заболевания спустя так много лет. В СЕ)4+-Т-клетках вирус находится в покоящемся состоянии. В отличие от ВИЧ после активации вирус не является цитолитическим для этих клеток. Напротив, HTLV-1 ведет к трансформации Т-клеток. После установления диагноза больные ТЛЛВ, как правило, живут не более 6-12 мес. Продукты крови в США и Великобритании подвергаются скринингу для исключения инфекнии HTLV-1.
Лимфома Ходжкина (лимфогрануломатоз)
Лимфома Ходжкина характеризуется наличием относительно небольшого количества крупных двуядерных злокачественных клеток, называемых клетками Рид-Штернберга (описываются далее) в реактивном окружении, представленном мелкими Т-клетами, эозинофилами, плазматическими клетками, макрофагами, и фиброзом. Это реактивное микроокружение является результатом избыточной продукции цитокинов, в частности IL-5, опухолевыми клетками и/или окружающими клетками. У больных имеются клинические признаки избыточной продукции цитокинов, такие как лихорадка, потливость по ночам и уменьшение массы тела. В классических случаях определяются также признаки сниженного клеточноопосредованного иммунного ответа — отсутствуют реакции ГЗТ на наиболее распространенные тестовые аллергены, повышена восприимчивость к вирусным и паразитарным инфекциям.
Предметом продолжительной дискуссии является происхождение клеток Рид-Штернберга, поскольку они не экспрессируют маркеров никаких клеточных линий и характеризуются экспрессией только CD 15 и CD30. В последних исследованиях с использованием молекулярных технологий была показана возможность реаранжировки генов Ig, что подтверждает их происхождение из В-клеточной линии. Открытие гипермутации в генах иммуноглобулинов свидетельствует, что клетки Рид-Штернберга образовались из В-клеток, уже прошедших зародышевый центр. Хотя злокачественные клетки и были идентифицированы как В-клетки, по течению эти лимфомы отличаются от крупноклеточных В-клеточных лимфом, что и является причиной того, что их продолжают классифицировать как самостоятельную нозологию. Лимфомы, таким образом, подразделяют на лимфомы Ходжкина и неходжкинские.
Иммунотерапия
Увеличившиеся знания по биологии лимфом в сочетании с техническими возможностями производства моноклональных антител и белков привели к разработке нового поколения терапевтических средств. В настоящее время химерные и гуманизированные антитела, направленные, в частности, против CD20, широко используются в лечении В-клеточных лимфом. Если применяют только одни антитела («холодное» использование), они могут вызывать уничтожение опухолевых клеток путем их опсонизации при покрытии антителами, а в случае использования конъюгатов этих антител за непосредственное уничтожение клетки отвечают токсины. Кроме современной химиотерапии дополнительно используют вещества, блокирующие цитокины или цитокиновые рецепторы, необходимые для пролиферации злокачественных клеток. Традиционные средства химиотерапии, которые в основном являются неспецифическими веществами, уничтожают все делящиеся клетки. Технологии, использованные при разработке этих новых специфичных препаратов, также широко применяются при разработке средств для лечения аутоиммунных заболеваний и нелимфоидных онкологических заболеваний, таких как рак молочной железы.
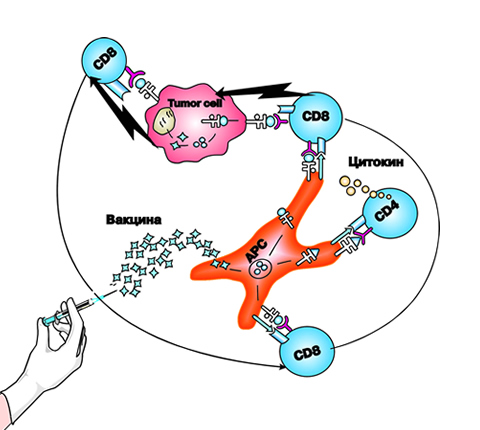
Иммунная система в норме работает как тщательно отрегулированная сеть, отвечающая на патогенные факторы извне, но не причиняющая никакого вреда самой себе. Причем после того как угроза миновала, иммунная система возвращается в более спокойное состояние, но уже обладая памятью о произошедших событиях. Истощение, хроническая стимуляция или возможность неконтролируемого роста одного из компонентов нарушают работу оставшихся элементов. Таким образом, поскольку регулирование в сети нарушено, развитие каждого из трех главных категорий расстройств: иммунодефицита, аутоиммунного заболевания или лимфоидного новообразования, делает возможным развитие еще одного или даже двух типов заболеваний.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания







Комментарии