Мочевая система у детей. Заболевания мочевой системы у детей
Эмбриональное развитие почек начинается на середине третьей недели гестации с развития пронефроса. На 10 неделе беременности существуют функционирующая почка и системы сбора; моча плода экскретируется в мочевой пузырь. На сроке 32-36 недель каждая почка имеет полный набор нефронов.
Функциональное развитие почек
Рост почек не зависит от функциональных требований, поскольку основным экскреторным органом плода является плацента. Почечный рост увеличивается линейно с массой и площадью поверхности тела во время третьего триместра беременности. На 28-35 неделях беременности быстро увеличивается скорость клубочковой фильтрации (СКФ). К 2-недельному возрасту СКФ от 10 мп/мин/м2 увеличивается до 20 мп/мин/м. Несмотря на то, что скорость клубочковой фильтрации у недоношенных ниже, темпы роста аналогичны таковым у доношенных. Тубулярная функция у доношенных новорожденных окончательно не сформирована. Почки новорожденных чувствительны к антидиуретическому гормону (АДГ) и вазопрессину; осмолярность мочи может варьировать от 50 до 780 мОсм/л. Тубулярная функция у недоношенных детей является еще менее зрелой.
У новорожденного почечный порог для бикарбоната около 20 мЭкв/п, и это означает, что стандартная номограмма кислотно-щелочного состояния не может использоваться у младенцев, потому что у них 20 мЭкв/п бикарбоната в сыворотке не являются показателем метаболического ацидоза. Порог почечных канальцев для глюкозы у доношенных новорожденных похож на таковой у взрослых, но у недоношенных он составляет всего 6,9-8,3 ммоль/п. У доношенного младенца на третий день жизни фракционная экскреция натрия составляет менее 1%. Фракционная экскреция натрия может быть значительно выше (5%) у недоношенных новорожденных. Концентрации ренина, ангиотензина и альдостерона высоки у новорожденных и снижаются в течение первых недель жизни.
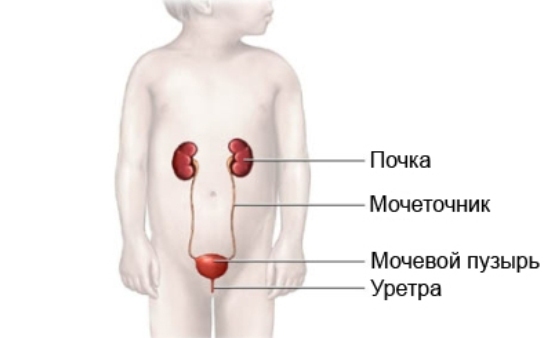
Почечная недостаточность
Острая почечная недостаточность определяется как резкая, часто временная, потеря почечной функции.Чаще всего проявляется олигурией, как исключение – полиурия; анурия встречается редко. При этой патологии изменяются объем и состав мочи; часто отмечаются расстройства жидкостного, электролитного и кислотно-основного состояния. Терапия определяется обеспечением нормального метаболического и жидкостного гомеостаза, нутритивной поддержкой и проявлением терпения. Острая почечная недостаточность обусловлена преренальными, постренальными (обструктивные) причинами или заболеваниями почек. Преренальные причины связаны с сокращением почечного кровотока. Снижение сердечного выброса и почечного кровотока является частой причиной снижения выделения мочи и приводит к азотемии и ишемическому повреждению почек. Адекватность объема циркулирующей крови оценивается измерением ЦВД и сердечного выброса, оценкой почечного кровотока с помощью допплерографии или радиологическими методами визуализации. Эти исследования помогают дифференцировать преренальные причины от ренальных азотемии, но они могут оказаться трудоемкими у новорожденных.
Постренальная обструкция (препятствие оттоку мочи) может возникнуть в любом месте системы коллекторов, но чаще всего она происходит в виде частичной обструкции шейки мочевого пузыря, мочеточниково-пузырного или мочеточникового перехода. Все эти пороки развития вызывают обструктивную нефропатию, повреждение почек или почечную недостаточность. Признаки обструкции могут быть незаметными, для их обнаружения требуется радиологическая, ультразвуковая или эндоскопическая оценка. Частыми клиническими проявлениями обструктивного поражения являются рецидивирующие инфекции мочевых путей.
Ренальными причинами почечной недостаточности являются поражения почечных клубочков, канальцев или кровеносных сосудов. К заболеваниям клубочков относятся:
-
гемолитико-уремический синдром;
-
постстрептококковый гломерулонефрит;
-
пурпура Шенлейн-Геноха;
-
воспалительные и иммунные заболевания.
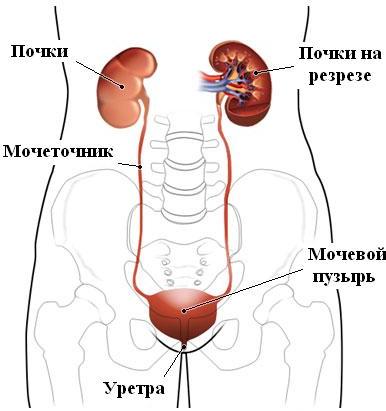
Острое повреждение канальцев чаще всего вызвано гипоксией и ишемией; другими причинами являются: рабдомиолиз, сепсис, гипертермия, гемолиз и воздействие различных нефротоксинов (например, ртуть, четыреххлористый углерод и этиленгликоль). Сосудистые заболевания, в том числе артериальная эмболия, тромбоз вен и врожденные пороки развития, также являются причинами острой почечной недостаточности.
-
Гемолитико-уремический синдром.
ГУС является одной из наиболее распространенных причин острой почечной недостаточности у детей. Этот синдром характеризуется острым повреждением почек с наличием микроангиопатической гемолитической анемии и тромбоцитопении. В Северной Америке ГУС чаще всего связан с инфицированием цитотоксической E.coli 0157, но было замечено, что другие серотипы кишечной палочки и другие шигаподобные токсин-продуцирующие бактерии бывают причастны к возникновению ГУС.
E.coli 0157 находится в желудочно-кишечном тракте крупного рогатого скота и может загрязнить мясо во время обработки. Микроорганизмы погибают при кулинарной обработке. Инфекция может передаваться от человека к человеку в детских садах, различных учреждениях и в военных гарнизонах. Существует также семейная форма заболевания, которая составляет небольшой процент от общего числа случаев.
ГУС встречается преимущественно в возрасте 0,5-4 лет, но может обнаруживаться во всех возрастных группах. Он имеет много сходных лабораторных и клинических черт с болезнью взрослых – тромбоцитопенической пурпурой. На самом деле, некоторые исследователи считают эти два расстройства непрерывным продолжением одной и той же болезни. Нарушения, развивающиеся при ГУС, как полагают, вызваны цитотоксинами и липополисахаридом бактериальных эндотоксинов. Индуцированные токсинами повреждения почечного эндотелия, сосудистой сети и других органов прямо или косвенно связаны с активацией лейкоцитов. В патогенезе этого заболевания, вероятно, играют роль цитокины, такие как интерлейкин-1 и фактор некроза опухоли, простагландин I2, тромбоксан А2 и мультимеры фактора фон Виллебранда.
Инкубационный период длится от 3 до 12 дней. Симптомы присутствуют около недели. Пациенты, как правило, имеют спастические боли в животе, кровавый понос, тенезмы, рвоту. В среднем ГУС развивается приблизительно у 10% детей с E.coli 0157-индуцированной кровавой диареей. У умеренно пораженных больных отмечаются анемия, тромбоцитопения, азотемия и снижение диуреза, и они имеют неосложненное течение. При тяжелой степени обычно имеется анурия, могут возникнуть гипертония и судороги; продолжительность болезни длительная. У некоторых детей отмечается постоянная и прогрессирующая почечная недостаточность, тяжелый и рецидивирующий гемолиз, тромбоцитопения и неврологические нарушения.

К гематологическим нарушениям относятся гемолиз и тромбоцитопения. Гемолиз часто вызывает гипербилирубинемию, и, несмотря на ретикулоцитоз, возникает тяжелая анемия с концентрацией гемоглобина от 40 до 50 г/л. Тромбоцитопения является результатом разрушения и поглощения тромбоцитов в печени и селезенке. У оставшихся тромбоцитов имеются нарушения агрегации. Относительно распространено диссеминированное внутрисосудистое свертывание (ДВС). Наиболее постоянной находкой при ГУС являются повреждения эндотелия капилляров клубочков. Острая почечная недостаточность с олигурией или анурией обычно длится менее недели, но может сохраняться более 10 недель. Преобладание гломерулярного и/или артериального повреждения зависит от наличия и степени почечной недостаточности (повреждение клубочков), гемолиза и гипертензии (артериальное повреждение). Нарушение деятельности ЦНС проявляется:
-
снижением уровня сознания;
-
судорогами;
-
раздражительностью;
-
атаксией;
-
гипотонией;
-
гемипарезом;
-
гиперрефлексией и галлюцинациями (эти проблемы могут быть вызваны тяжелой артериальной гипертензией, нарушением электролитного баланса, микротромбами или отеком мозга и повышением внутричерепного давления).
Обычно имеются брюшные спазмы, которые трудно отличить от кишечной непроходимости, стриктуры или перфорации кишечника, гангрены толстой кишки или другой экстренной хирургической патологии. У пациентов с ГУС часто встречается панкреатит. ЗСН (застойная сердечная недостаточность) может возникнуть при перегрузке жидкостью, гипертонии, анемии или при угнетении миокарда циркулирующими эндотоксинами.
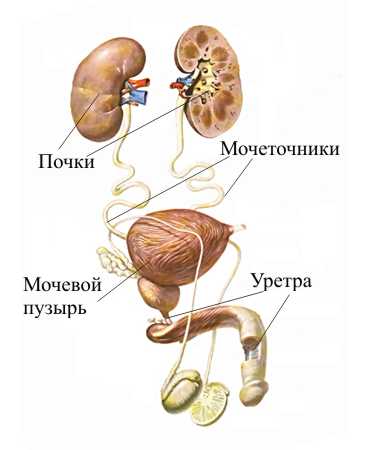
Лечение
Терапия ГУС, в первую очередь, поддерживающая. Должно быть уделено тщательное внимание объему жидкости, электролитному и кислотно-щелочному балансу, питанию, борьбе с сепсисом, лечению артериальной гипертензии и коагулопатии. Изоляция кишечного содержимого является обязательной мерой для предотвращения вторичного распространения заболевания. Для ведения этих пациентов важно измерять точное количество имеющейся и выделенной жидкости, часто оценивать массу и объем. Для измерения ЦВД, забора крови и внутривенного введения лекарственных препаратов и питания используется центральный венозный катетер. По возможности, следует избегать применения нефротоксических препаратов. Если есть необходимость в назначении такого лекарственного средства, то следует скорректировать дозу препарата и внимательно контролировать его концентрацию в сыворотке. Суточный объем жидкости должен быть ограничен количеством, необходимым для восполнения физиологических потерь. Введенные жидкости должны восполнять запас электролитов, вследствие их потерь с выделенной жидкостью. Необходима энергетическая поддержка. Предпочтительней применять энтеральное питание, но при возникновении кишечной непроходимости может потребоваться парентеральное питание. Антидиарейные препараты увеличивают продолжительность колита; антибиотики могут увеличить риск для гемолитико-уремического синдрома. На сегодняшний день не существует эффективного специфического лечения. Гепарин, фибринолитические препараты, аспирин, дипиридамол, кортикостероиды, витамин Е и фуросемид не влияют на исход ГУС. Использование иммуноглобулинов, плазмафереза и инфузий свежезамороженной плазмы показали смешанные результаты, но не продемонстрировали никакого долгосрочного терапевтического эффекта.
В результате диализа, улучшения питания и поддерживающей терапии смертность снизилась от 100% (в первом сообщении) до менее 10% (в течение последних 30 лет). В развивающихся странах и у детей с генетической предрасположенностью к ГУС остается высокий уровень смертности от этой патологии.
Перитонеальный диализ требует постановки мягкого перфорированного катетера в брюшную полость. При подтверждении проходимости катетера вводится раствор диализата, который приходит в равновесие с плазмой и внеклеточной жидкостью. Париетальная и висцеральная брюшина функционирует как полупроницаемая мембрана диализа. Диализат аналогичен плазме и состоит приблизительно из 130 ммоль/л натрия, 100 ммоль/л хлора, 35 мЭкв/л ацетата или лактата (в качестве буфера), 1,75 ммоль/л кальция и 0,75 ммоль/л магния. Концентрация глюкозы в растворе может быть изоосмотической или гиперосмотической. Гиперосмотические растворы уводят за собой жидкость и электролиты. Может произойти респираторный диссонанс с перитонеальным диализом, поскольку повышение внутрибрюшного давления, вызванного наличием диализата в брюшной полости, может препятствовать эффективной произвольной вентиляции. В этом случае нужно будет использовать механическую вентиляцию. Распространенным осложнением перитонеального диализа является бактериальный или грибковый перитонит. Другими его осложнениями являются сильное обезвоживание, сосудистый коллапс и нарушение обмена веществ. Принципы гемодиализа являются, по сути, такими же, как при перитонеальном диализе, но при гемодиализе кровь взаимодействует с полупроницаемой мембраной, а не с брюшиной. Гемодиализ эффективнее перитонеального диализа и является более целесообразным в острых ситуациях. Гемофильтрация и ультрафильтрация являются процессами, при которых кровь очищается с помощью конвективного транспорта растворенного вещества. Во время этой процедуры гидростатическим давлением, воздействующим на высокопроницаемую мембрану, создается ультрафильтрат плазмы. Требуется одновременное восполнение объема крови модифицированным лактатным раствором Рингера.
Исход
При острой почечной недостаточности прогноз зависит от возраста пациента, сопутствующих заболеваний, а также степени вызванной ишемии. Как правило, у детей прогноз благоприятней, чем у взрослых – дети обычно полностью восстанавливаются после инфаркта почек при непродолжительной гипоксии или ишемии, если другие органы и системы остались интактны. Дети с хронической почечной недостаточностью нуждаются в длительном амбулаторном перитонеальном диализе или гемодиализе, пока им не будет проведена трансплантация почки.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания











Комментарии