Легочная артериальная гипертензия при ВПС. Лечение. Последствия.
Термином «легочная гипертензия» определяют состояние, при котором среднее давление в легочной артерии превышает 25-30 мм рт. ст. при нагрузке. Конференция в Эвиане в 1998 г. пересмотрела классификацию ЛГ с учетом болезни, приведшей к ее развитию. Различают первичную ЛГ и вторичную, обусловленную различными заболеваниями. При первичной ЛГ причина ее возникновения не идентифицируется. Объяснимыми причинами вторичной ЛГ являются:
-
коллагеновая болезнь сосудов;
-
врожденные сердечно-легочные шунты;
-
портальная гипертензия;
-
ВИЧ-инфекция;
-
применение лекарственных средств;
-
вызывающих анорексию;
-
персистирующая ЛГ новорожденных.
Легочная гипертензия может быть вызвана диастолической дисфункцией левого желудочка различной этиологии, респираторными заболеваниями, гипоксемией, хроническим тромбозом или эмболией легочных сосудов и заболеваниями, связанными с прямым повреждением легочных сосудов, такими, как саркоидоз и паразитарное заболевание шистосомоз.
Легочная гипертензия является одним из тяжелых проявлений гемодинамических нарушений при ВПС, приводящих к развитию обструктивной болезни легочных сосудов. Без ранней коррекции пороков она встречается в тяжелой форме приблизительно у 30% детей с ВПС. Легочная гипертензия должна быть предметом особого внимания и терапевтического воздействия врачей на всех этапах лечения — дооперационном, во время операции и после нее. К сожалению, в некоторых случаях она может сохраняться и даже прогрессировать, несмотря на адекватное хирургическое лечение. Ниже приведены ВПС, сопровождающиеся ЛГ.
Увеличенный легочный кровоток
Ацианотические пороки:
-
ДМЖП;
-
АВСД;
-
ОАП;
-
ДМПП;
-
Дефект аорто-легочной перегородки.
Цианотические пороки:
-
ТМА с ДМЖП;
-
ОАС;
-
Одножелудочковое сердце.
Повышение давления в легочных венах:
-
Коарктация аорты;
-
Комплекс Shone;
-
Митральный стеноз;
-
Надклапанное митральное кольцо;
-
Трехпредсердное сердце;
-
Сужение легочных вен;
-
ТАДЛВ.
Цианотические пороки сердца:
-
ТМА;
-
Тетрада Фалло.
Аномалии легочных артерий и легочных вен:
-
Отхождение легочной артерии от аорты;
-
Одностороннее отсутствие легочной артерии;
-
Синдром ятагана.
Паллиативные шунтирующие операции:
-
Анастомоз Waterstone;
-
Анастомоз Potts;
-
Анастомоз Blalock-Taussig.
Дефект межжелудочковой перегородки является наиболее частым пороком, при котором встречается легочная гипертензия. При другом пороке с лево-правым шунтированием – АВСД – легочная гипертензия быстро прогрессирует в ОБЛС. Возраст, при котором эти аномалии приводят к необратимым изменениям легочных сосудов, различен. У большинства больных с ДМЖП и ОАП эти изменения не развиваются до 2-летнего возраста. Однако у пациентов, проживающих на высокогорье, ОБЛС развивается раньше. Синдром Дауна существенно ускоряет прогрессирование ЛГ. Хронические легочные заболевания также способствуют озлокачествлению ЛГ. В отличие от ДМЖП, менее чем у 20% больных с ДМПП развивается необратимая ЛГ, если коррекция порока не выполнена до 3-й декады жизни.
Пороки, сопровождающиеся повышением давления в легочных венах, обычно приводят к развитию ЛГ. Она может быть при рождении, и, как правило, исчезает после коррекции порока. Однако у некоторых больных с врожденным митральным стенозом или с ТАДЛВ изменения в легочных сосудах могут быть необратимыми.

При цианотических пороках ЛГ также не является редкостью. У многих больных этой группы уменьшено количество внутриацинарных артерий и снижено альвеолярно-артериальное соотношение. Это наблюдается при тетраде Фалло и других пороках со сниженным легочным кровотоком.
При аномалиях, для которых характерно сочетание увеличенного легочного кровотока с цианозом, ОБЛС развивается особенно быстро. У пациентов с при наличии ТМА с ДМЖП или ОАП, ОАС, одножелудочковым сердцем с увеличенным легочным кровотоком обструктивные изменения легочных сосудов развиваются в младенческом возрасте, если порок не устранен к 4-6 мес. жизни.
При аномалиях легочных артерий имеют место уникальные механизмы развития ЛГ. При отхождении одной легочной артерии от аорты давление в артерии, отходящей от правого желудочка, равно или превышает давление в артерии, берущей начало от аорты. Эта содружественная гипертензия обусловлена вазоспастическим рефлексом из левого предсердия, находящегося под повышенным давлением. Хирургический реанастомоз аномально отходящей легочной артерии с легочным стволом нормализует давление и в контралатеральной артерии. Одностороннее отсутствие легочной артерии сопровождается ЛГ из-за уменьшения объема сосудистого ложа. Она особенно выражена у детей, проживающих на высокогорье.
Аномалии легочного венозного возврата, например синдром ятагана, при котором правые легочные вены дренируются в нижнюю полую вену, сопровождаются ЛГ вследствие шунтирования ДМЖП, сужения легочной вены и уменьшения легочного сосудистого русла.
Паллиативные шунтирующие операции, выполняемые для увеличения легочного кровотока, иногда осложняются ЛГ. Чаще всего это наблюдается при анастомозе Potts и реже – при подключично-легочных анастомозах Blalock-Taussig.
Легочная гипертензия встречается и при заболеваниях, не связанных с ВПС. Основными патогенетическими механизмами ее развития являются острая или хроническая гипоксия и обусловленное разными причинами уменьшение легочно-сосудистого русла.
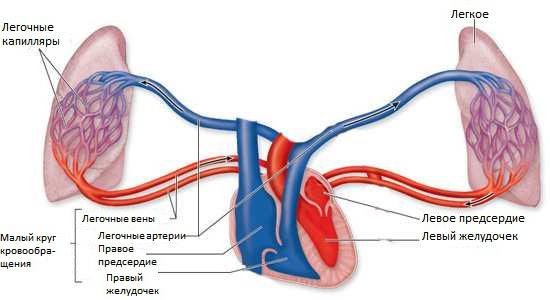
Легочное кровообращение в норме
Распределение легочного кровотока в норме
Поддержание сосудистого тонуса и распределение крови в легких в норме осуществляется многими механизмами. Они обеспечивают базовый уровень ЛСС и давления при увеличении легочного кровотока. При нагрузке давление в легочной артерии несколько повышается и одновременно снижается ЛСС. Это происходит за счет пассивного растяжения и открытия «пустых» артериол.
Распределение кровотока в легких зависит от соотношения нескольких параметров:
-
давления в легочной артерии;
-
давления в легочных венах;
-
гравитации;
-
альвеолярного давления.
В вертикальном положении кровоток в различных регионах легких не одинаков. Нижние отделы легких получают наибольшее количество крови. В верхних отделах легких альвеолярное давление превышает легочное артериальное и венозное давления, что приводит к коллапсу легочных капилляров. В средних отделах давление в легочной артерии превышает давление в альвеолах, которое выше, чем давление в легочных венах, поэтому в состоянии покоя легочный кровоток в этой зоне выше, чем в верхних отделах. В нижних отделах легких давление в легочной артерии и в венах превышает давление в альвеолах и кровоток определяется разницей давления в путях притока и оттока. Кровоток в различных зонах легких зависит от изменения гидростатического давления. В положении лежа легочный кровоток приблизительно одинаков во всех зонах.
Давление в легочной артерии и легочный кровоток находятся в логарифмической зависимости. Можно выделить 3 фазы ЛГ. В 1-й фазе начальное увеличение кровотока вызывает быстрое повышение давления, которое преодолевает давление открытия резистивных сосудов. Во 2-й фазе происходит более медленное повышение давления при увеличении кровотока. В 3-й фазе все сосуды заполнены кровью и максимально расширены.
Дальнейшее увеличение кровотока, в 3-4 раза превышающее норму, приводит к линейному увеличению давления в легочной артерии.
Регуляция тонуса легочных сосудов в норме
Решающую роль в поддержании нормального сосудистого тонуса играет эндотелий сосудов. Эндотелиальные клетки легочных сосудов отвечают на различные воздействия продукцией вазодилататоров и вазоконстрикторов, а также цитокинов и факторов роста. Эндотелий выделяет множество вазоактивных факторов, таких, как оксид азота, эндотелин, простоциклин, активатор тканевого плазминогена, ингибитор активатора плазминогена I типа, тромбомодулин, гепаринсульфатные гликозаминогликаны, фактор Willebrand, факторы роста и цитокины. Стимуляторами эндотелиальной продукции медиаторов, которые влияют на тонус сосудов через специфические рецепторы, являются повышенное напряжение сдвига, увеличенный легочный кровоток, растяжение легочных сосудов, гипоксия, ацидоз, фибрин, воспалительные субстанции, АТФ, брадикинин, ацетилхолин.
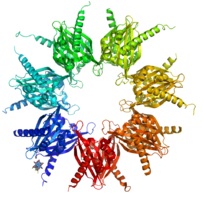
Уровень сосудистого тонуса в норме и при патологии определяется балансом дилататорных и констрикторных факторов эндотелиального происхождения. Снижение синтеза и выделения дилататорных факторов и/или увеличение синтеза констрикторных в каком-то определенном участке сосудистого русла приводит к локальному вазоспазму. Многие факторы неэндотелиального происхождения являются вазоактивными. Так, лейкотриены являются мощными вазоконстрикторами, а АТФ-зависимые каналы К+ могут играть роль в легочной вазодилятации. Когда специфический агент активирует АТФ-зависимые каналы К+ в гладкомышечных клетках, мембрана гиперполяризуется и угнетается вход кальция через кальциевые каналы. В эндотелиальных клетках активация калиевых каналов приводит к активации кальциевых каналов. Увеличение входа кальция в эндотелиальную клетку может стимулировать образование оксида азота. Таким образом, активация АТФ-чувствительных К+ каналов может расширять легочные сосуды двумя различными механизмами.
В регуляцию сосудистого тонуса вовлечен также целый ряд органов и систем – корковый и мозговой слои надпочечников, юкстамедуллярный аппарат почек, вегетативная нервная система и т.д. Многоконтурная система регуляции и стабилизации включает в себя целый ряд подсистем. Эта система состоит из множества гуморальных и нервных контуров регуляции тонуса сосудов и, несмотря на заложенную надежность в виде многократного дублирования, достаточно легко уязвима именно в силу ее большой сложности.
В 1980 г. Furchgott и Zavadski открыли эндотелиальный релаксирующий фактор неизвестной природы, играющий огромную роль в регуляции сосудистого тонуса в различных бассейнах сосудистой системы, который затем был идентифицирован как оксид азота – NO. Молекула NO занимает место общепризнанного регулятора жизненных функций на различных уровнях – от молекулярного и клеточного до системного. В настоящее время активно изучается роль эндотелиальных факторов и прежде всего NO в патогенезе ЛГ и легочных гипертонических кризов. Оксид азота также ингибирует функцию тромбоцитов и обладает антимитогенными свойствами. Образование NO стимулируют многие субстанции эндотелиального происхождения, такие, как кислород, ацетилхолин, брадикинин, гистамин, а также талазолин, напряжение сдвига.
Оксид азота вызывает релаксацию гладкой мускулатуры сосудов путем активации фермента синтеза – растворимой гуанилатциклазы в гладкомышечных клетках, которая катализирует превращение гуанозин трифосфата в клеточный посредник циклический гуанозинмонофосфат .
Эндотелийзависимые субстанции активируют NO-синтазу, что увеличивает продукцию NO эндотелиальными клетками. При повреждении эндотелия этот механизм нарушен и может быть искусственно шунтирован ингаляционным NO. Оксид азота свободно диффундирует в подлежащую гладкомышечную клетку и с помощью фермента – растворимой ГЦ стимулирует продукцию вторичного мессенджера цГМФ, вызывающего вазодилатацию через цГМФ-зависимые протеинкиназы. Циклический гуанозинмонофосфат с помощью фермента 3',5'-фосфодиэстеразы деградирует в неактивный метаболит 5'- ГМФ.
Расслабляющий эффект последнего за счет цГМФ-зависимых протеинкиназ на гладкие мышцы реализуется главным образом посредством снижения концентрации кальция в цитозоле.
Физиологическая деградация цГМФ осуществляется при участии фермента 3',5'-ФД, превращая его в неактивный 5'-гуанозинмонофосфат. Существует также цГМФ-независимый механизм релаксации гладких мышц сосудов под непосредственным влиянием NO. Он связан со способностью NO прямо нитрозилировать клеточные белки и реализуется посредством снижения чувствительности сократительных белков гладких мышц к ионам кальция.
Оксид азота синтезируется ферментативно из аминокислоты L-аргинина при участии NOS, которая катализирует окислительное превращение субстрата в L-цитруллин и NO. Последний быстро инактивируется в результате окисления и некоторое время существует в виде стабильных метаболитов — нитрит- и нитрат-анионов. Одним из путей образования нитрат-аниона является взаимодействие NO с гемоглобином. Выделяют 3 изоформы NO-синтазы: нейрональную, эндотелиальную и макрофагальную, или индуцибельную. Название «NOS» вовсе не отражает место ее строгой локализации. Среди них первые 2 кальцийзависимые и являются конститутивными. Конститутивные NOS1 и NOS3, функционально связанные с плазматической мембраной, экспрессированы постоянно и обеспечивают наличие физиологически адекватных количеств NO. Активация iNOS, которая индуцируется провоспалительными цитокинами и бактериальными полисахаридами, в течение 4-6 ч, вызывает генерацию чрезмерных количеств NO. Это играет важную роль в реализации иммунного ответа, однако может иметь и патофизиологическое значение.
Оксиду азота принадлежит важная роль в регуляции базового легочного и системного сосудистого сопротивления. Поскольку NО действует на гладкую мускулатуру через цГМФ, медикаментозное ингибирование фосфодиэстеразы, участвующей в деградации цГМФ, может усилить NО-зависимую вазодилатацию.
Эндотелин является мощным вазоактивным пептидом эндотелиального происхождения, впервые описанным в 1988 г. Yanagisawa и соавторами. Эндотелины представляют собой семейство изопептидов разного происхождения и действия. Эндотелин-1 представлен в организме наибольшим количеством и является наиболее изученным. Он продуцируется главным образом эндотелиальными клетками путем конверсии проэндотелина-1 в ЭТ-1 с помощью специфических эндопептидаз, эндотелин-конвертирующих ферментов. Факторами, индуцирующими повышенную продукцию ЭТ-1, являются увеличение напряжения сдвига или давления и гипоксия. Воздействия ЭТ-1 на сосудистый тонус опосредованы по крайней мере двумя ЭТ-рецепторами – ЭТАИ ЭТВ. ЭТА-рецепторы расположены на гладкомышечных клетках сосудов и опосредуют вазоконстрикцию, в то время как ЭТВ-рецепторы опосредуют вазодилатацию.
Эйкозаноиды – лейкотриены и простагландины – являются вазоактивными метаболитами арахидоновой кислоты. В клетках эндотелия арахидоновая кислота метаболизируется через липоксигеназный путь с образованием лейкотриенов или через циклооксидазный путь с образованием простагландинов. Простациклин является мощным простагландином, который вызывает вазодилатацию через увеличение продукции цАМФ, он также ингибирует агрегацию тромбоцитов. Лейкотриен тромбоксан, как и простациклин, образуется в эндотелиальных клетках, хотя главным источником его являются тромбоциты. Он оказывает противоположное простациклину действие, являясь вазоконстриктором и проагрегантом. Продукция обоих эйкозаноидов стимулируется напряжением сдвига.
Представления о роли повреждения эндотелиальной функции способствовали разработке новых подходов к терапевтическому лечению ЛГ. Применение NO и простациклина вытекало из установленного факта снижения продукции этих вазодилататоров. Попытки противодействовать сосудосуживающему эффекту повышенного уровня тромбоксанов путем применения антагонистов рецепторов тромбоксана и ингибиторов синтетазы тромбоксана обнаружили снижение ЛСС. Наконец, внедрение антикоагулянтной терапии привело к клиническому улучшению и удлинению продолжительности жизни больных. Ведется разработка новых лекарственных средств, обладающих свойствами антагонистов эндотелина, которые могут оказаться эффективными в лечении ЛГ.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии