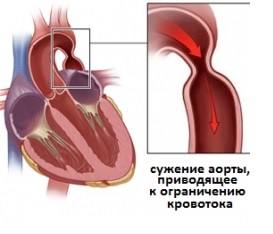
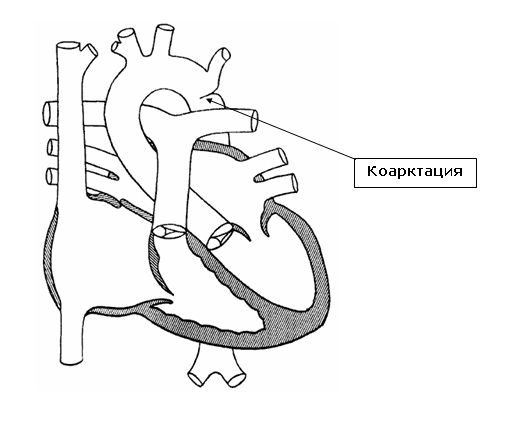
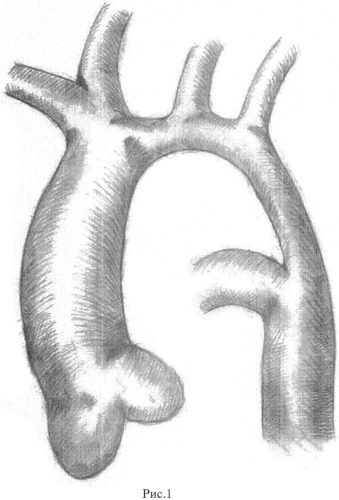
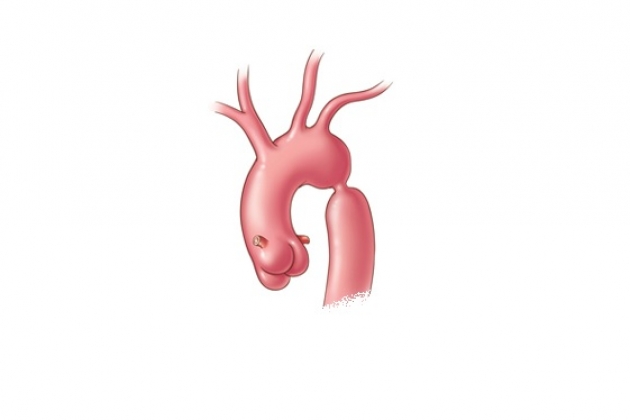
Коарктация аорты: операция, этапы, последствия
В операционной мониторируют ЭКГ, центральное венозное и прямое артериальное давление. Анестезиолог назначает миорелаксанты внутривенно и интубирует больного. В желудок проводят зонд и катетеризируют мочевой пузырь.
Доступы
В большинстве случаев типичной локализации коарктации аорты операцию выполняют широким доступом через IV четвертый межреберный промежуток слева.
В некоторых случаях, в соответствии с локализацией сужения, хирургический доступ выполняют через III или V межреберный промежуток или через срединную продольную стернотомию. Последний доступ избирают преимущественно в случаях одновременной коррекции коарктации аорты и сопутствующих аномалий сердца в условиях искусственного кровообращения. При сочетании коарктации аорты с правосторонней дугой аорты используют доступ, симметричный левостороннему.
Мобилизация аорты
Начинают выделять аорту продольным рассечением медиастинальной плевры выше и ниже сужения. Нужно иметь в виду, что с латеральной стороны над и под аортой проходят разного диаметра и почти незаметные лимфатические сосуды. При их повреждении в последующем может возникнуть послеоперационная лимфорея. Слева вдоль аорты проходит truncus sympaticus, а справа — n. vagus. Диссекцию коарктации аорты начинают с левой подключичной артерии, под которую подводят толстую ниточную держалку или тесьму.
Подтягивая левую подключичную артерию за держалку, разделяют рыхлую клетчатку вокруг этой артерии и верхнего отдела перешейка аорты. Главная цель в это время — подвести держалку под нисходящую аорту проксимальнее артериальной связки. Необходимо учитывать возможность повреждения слишком хрупкой артерии Аbbott, из которой может возникнуть опасное кровотечение, так как аорта еще плохо контролируется и на нее трудно наложить зажим. Вторым обстоятельством, которое затрудняет выделение аорты, является достаточно прочная фиксация сосуда с правой стороны фиброзной аорто-перикардиальной связкой.
Следующий момент диссекции намного легче, он заканчивается подведением держалки под аорту ниже артериального протока.
До тех пор, пока аорта фиксирована артериальной связкой, она почти не мобильна. Поэтому следующим этапом операции является выделение, перевязка и рассечение между лигатурами этой связки, или ОАП. Перевязку и рассечение протока можно сделать при пережатой аорте. После этого аорта в значительной мере выпрямляется, становится мобильной, и иногда уже в этот момент появляется небольшая пульсация дистального отдела нисходящей аорты.
Большая осторожность необходима и в следующих действиях, нацеленных на выделение дистального сегмента коарктации аорты. Это связано с опасностью кровотечения при обработке тонкостенных расширенных межреберных артерий, местами с аневризматическими выбуханиями. В большинстве случаев можно ограничиться перевязкой двух пар этих сосудов. Начинают действия с манипуляции на левых артериях, которые лучше доступны и легче контролируются при повреждении. После пересечения артерий левой стороны переходят к обработке правых межреберных артерий. Когда они становятся заметными, под последний из намеченных для обработки сосудов осторожно подводят держалку. Подтягивая за две дистальные лигатуры, поочередно перевязывают все сосуды между ними.
Необходимо учесть, что с правой стороны аорты проходят одна или несколько более мелких пищеводных и бронхиальных артерий, которые следует разделить раньше правых межреберных.
Общим правилом обработки коллатеральных сосудов и ветвей аорты должна быть первоочередная перевязка этих артерий с дистальной стороны. Кроме того, периферические лигатуры целесообразно провести через окружающие бессосудистые ткани, чтобы в последующем избежать сползания этих лигатур. Когда аорта мобилизована на необходимом протяжении, приступают к устранению коарктации наиболее подходящим способом. Предварительно желательно выполнить пробное пережатие аорты на короткий промежуток времени, чтобы удостовериться, что проксимальное давление не выросло излишне, а дистальное — не упало до неэффективного уровня. Практически после пережатия аорты артериальное давление не должно достигать 200 мм рт. ст., но повышение его у взрослого пациента до 160-180 мм рт. ст. допустимо, поскольку при таком его уровне обеспечивается эффективный дистальный кровоток и нет угрозы церебральных повреждений. Считается, что в дистальном бассейне среднее давление не должно падать ниже 50-60 мм рт. ст., иначе возникает угроза поражения спинного мозга. Дополнительным показателем эффективности дистальной гемодинамики является мониторинг диуреза, но этот показатель несколько инерционный. Одновременно с проверкой гемодинамических последствий пережатия аорты следует оценить податливость сегментов аорты, удостовериться, достаточна ли она для запланированного способа коррекции.
Характеристика и выбор способов коррекции
В процессе развития хирургического лечения коарктации аорты было предложено много разных технических приемов в целях устранения стеноза. Каждый из них имеет свои модификации. Однако чаще всего используют несколько принципиально отличных типов операции, а именно:
-
резекцию сужения с анастомозом «конец в конец»;
-
протезирование;
-
боковую аортопластику заплатой;
-
обходное шунтирование;
-
приемы с привлечением тканей левой подключичной артерии.
С 1982 г. коарктацию аорты иногда расширяют путем эндоваскулярной баллонной дилатации.
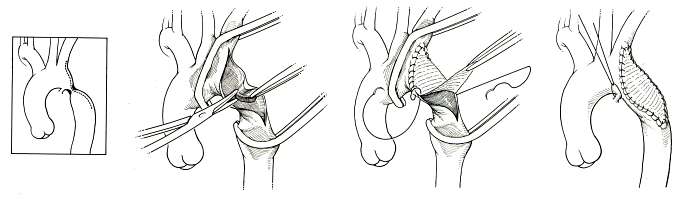
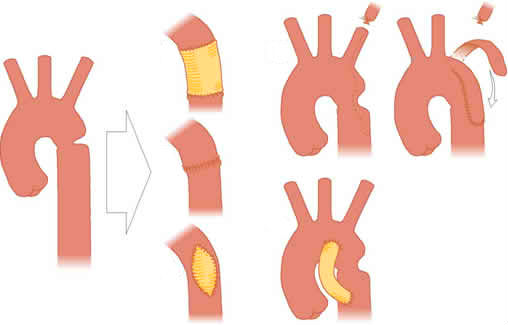
Резекция коарктации аорты с анастомозом «конец в конец»
Впервые эту операцию осуществили Crafoord в 1944 г. и Gross в 1945 г.. Метод в течение длительного времени оставался наилучшим. Особенно широкое применение он находил при лечении пациентов младшего возраста.
Техническое выполнение этого типа операции осуществляют следующим образом. На дугу аорты дистальнее левой общей сонной артерии накладывают сосудистый зажим. Иногда дугу аорты и левую подключичную артерию удается пережать одним общим зажимом. На дистальный отдел аорты зажим накладывают так, чтобы функционирующие коллатерали остались за пределами операционного поля.
Резекцию стеноза выполняют на необходимом протяжении. При этом пытаются достичь максимальных размеров анастомоза за счет широкой резекции узких сегментов и избежать избыточного натяжения аорты в месте анастомоза.
В большинстве случаев эти два хирургических желания плохо совмещаются. Во-первых, если воспринять гипотезу о роли артериального протока в формировании коарктации аорты, то резекция должна удалить все возможные остатки этого сосуда из аортальной стенки. Во-вторых, престенотический сегмент часто бывает также узким на значительном протяжении и его эффективное отверстие плохо сопоставляется с расширенным постстенотическим сегментом. В-третьих, вблизи коарктации аорты, особенно в престенотическом отделе, даже у детей существуют атеросклеротические изменения, которые делают аортальную стенку хрупкой. В-четвертых, уже у старших детей, а особенно у взрослых, даже широкая диссекция дистальной дуги не обеспечивает податливости аорты навстречу анастомозу, в связи с этим необходимо выполнять предшествующее широкое скелетирование постстенотической части аорты, эластичность которой несколько лучше.
Первые анастомозы осуществляли после поперечной резекции наиболее узкого места. Концы аорты сближали зажимами и сшивали между собой. Как правило, заднюю губу анастомоза выполняли непрерывным обвивным швом, а переднюю — отдельными П-образными швами. Иногда переднюю часть анастомоза формировали отдельными узловыми швами. Созданный таким образом анастомоз бывает удовлетворительным лишь у пациентов среднего детского возраста с эластичной аортой, при условии достаточного диаметра в проксимальном отделе. Именно из-за этого обстоятельства и появились альтернативные способы коррекции с вживлением разных вставок.
Современная техника анастомоза «конец в конец» позволяет достичь создания достаточного по ширине анастомоза, обеспечить некоторую перспективу последующего роста анастомоза и одновременно избежать избыточного натяжения на швах. Способ позволяет корригировать достаточно значительную по длине гипоплазию престенотического отдела аорты. Суть его заключается в том, чтобы за счет суженного престенотического отдела создать лишь задний лоскут анастомоза, а переднюю часть сформировать, накрыв этот лоскут более широким, выкроенным из постстенотического сегмента. Эти лоскуты легко создают, выполнив два продольных разреза сосуда после удаления коарктации. Один из них проводят в проксимальном направлении на престенотическом сегменте, в большинстве случаев по левой поверхности аорты, иногда с переходом на ствол подключичной артерии. На постстенотическом сегменте адекватный разрез проводят по правой поверхности аорты в дистальном направлении.
Два образовавшихся лоскута адаптируют незначительным подстриганием и сближают зажимами. Сшивание лоскутов начинают от наиболее отдаленного заднекаудального угла и дальше проводят обвивной непрерывный шов по задней поверхности справа налево к краниальному концу разреза на корне подключичной артерии. Второй иглой подобным образом сшивают правую сторону анастомоза. Когда нити встречаются, их связывают между собой. Завершенный анастомоз имеет форму удлиненного овала с достаточно широким диаметром вновь созданного сегмента в любом месте. Еще одно преимущество расширенному современному анастомозу «конец в конец» обеспечивает шовный материал на основе полидиоксанона, который постепенно абсорбируется в течение 2 мес после операции. Наиболее пригодным шовным материалом для детей первого года являются нити PDS 60, 70, а у старших детей — PDS 50. У взрослых и старших детей можно воспользоваться проленом или полипропиленом. Amato и соавторы пользовались сначала нитями PDS, но из-за сложности управлением памятью шва и проблемы затягивания стали применять нити лучшего качества из полигликоната. Чтобы свести к минимуму риск недостаточности анастомоза, у младенцев часть передней губы можно сшить отдельными швами, однако следует иметь в виду, что это продлит время окклюзии аорты.
Коррекция гипоплазии дистальной и проксимальной дуги требует расширенной реконструкции аорты. Перевязывают необходимое количество межреберных артерий и выделяют аорту из окружающих тканей для обеспечения хорошей податливости сосудов. Изогнутым сосудистым зажимом изолируют область реконструкции, включая часть стенки восходящей аорты и оставляя безымянную артерию. Перевязывают и пересекают артериальный проток, резецируют часть перешейка и нисходящей аорты, содержащих ткань протока, и рассекают вдоль вогнутую нижнюю стенку аорты с переходом на восходящую аорту. Нисходящую аорту анастомозируют с поперечной дугой и перешейком аорты.
Резекция коарктации и протезирование аорты
В начальном периоде развития хирургии коарктации аорты для замещения удаленного сегмента сосуда иногда пользовались гомотрансплантатами аорты. Впервые замену резецированного сегмента аорты аортальным гомотрансплантатом произвели в 1948 г. Gross и соавторы. В литературе были сообщения о благоприятных последствиях операции, но большинство из них закончилось плохо. О хороших долговременных последствиях гомотрансплантации аорты при данной патологии не известно.
После внедрения синтетических трубок, пригодных для протезирования сосудов, этот метод использовали достаточно широко. Первым протез для коррекции коарктации аорты применил Bahnson в 1949 г.. Обычными показаниями к этой операции считают:
-
большую длину суженного сегмента, при удалении которого даже после широкой мобилизации аорты невозможно создать анастомоз «конец в конец»;
-
значительное несоответствие диаметров аорты выше и ниже суженной части;
-
деструктивные изменения сосудистой стенки;
-
наличие аневризмы аорты в зоне коарктации.
Вживление протеза позволяет заменить часть аорты на необходимом протяжении, адаптировать протез с аортой в наиболее выгодных местах, достичь некоторой гиперкоррекции стеноза с перспективой на будущий вырост пациента, уменьшить натяжение на швах до минимального.
Главным недостатком сосудистого протеза является его абиологичность. Он никогда не будет замещен собственными тканями и отличается по своим гидродинамическим свойствам от сегментов аорты, которые соединяет. При вживлении протезной трубки тратится почти вдвое больше времени на выполнение двух анастомозов с аортой. В связи с отсутствием способности к росту в ширину, его соединения с аортой выполняют сплошными обвивными швами. У взрослых пациентов, у которых имеются значительные атеросклеротические изменения аорты, при создании анастомозов могут быть использованы в отдельных местах или на всем протяжении анастомоза П-образные швы с опорными прокладками из кусочков тефлонового фетра. При выборе шовного материала преимущество отдают пролену. Некоторые авторы рекомендуют избегать использования шелковых нитей, которые со временем рассасываются, так как это может ослабить связь аорты с протезом.
Для лучшей адаптации с аортой концы протеза срезают наискось и этим увеличивают эффективное отверстие анастомоза. Длину протезной вставки рассчитывают, исходя из конкретной анатомической ситуации, но каждый раз уточняют уже после завершения первого анастомоза. Этот момент имеет большое значение, так как избыток длины может обезобразить коррекцию за счет частичного или полного перегиба, а дефицит длины влечет неоправданные технические трудности во время выполнения последнего анастомоза и становится причиной избыточного натяжения на швах.
Истмопластика аорты
Истмопластика лоскутом из левой подключичной артерии по Waldhausen
В 1964 г. Waldhausen и Nahrwald сообщили о своем методе, который стал наиболее конкурентоспособным при коррекции коарктации аорты у детей самого младшего возраста. Эту технику назвали методом Waldhausen, хотя известно, что первую операцию пластики аорты лоскутом из левой подключичной артерии осуществил еще в 1951 г. Shumacher. Недостатки этой операции в раннем послеоперационном периоде связаны с ишемией левой руки. Были сообщения о случаях гангрены конечности. В более отдаленные сроки часто наблюдаются некоторое отставание конечности в росте, отсутствие пульса, повышенная чувствительность к охлаждению.
Чтобы уменьшить негативные последствия этой операции, Fournier и соавторы в 1985 г. разработали свою модификацию, при которой аортопластика по Waldhausen дополняется реплантацией дистального конца левой внутренней грудной артерии в нисходящую аорту. Авторы разъединяли артерию на расстоянии 15 см от ее начала, а проксимальную культю анастомозировали в реконструированную зону аорты по типу «конец в бок». Такое дополнение к технике Waldhausen обеспечивает ретроградный приток крови из аорты в дистальную культю подключичной артерии и помогает избежать ранних и поздних последствий ишемизации левой верхней конечности и вертебробазилярного бассейна.
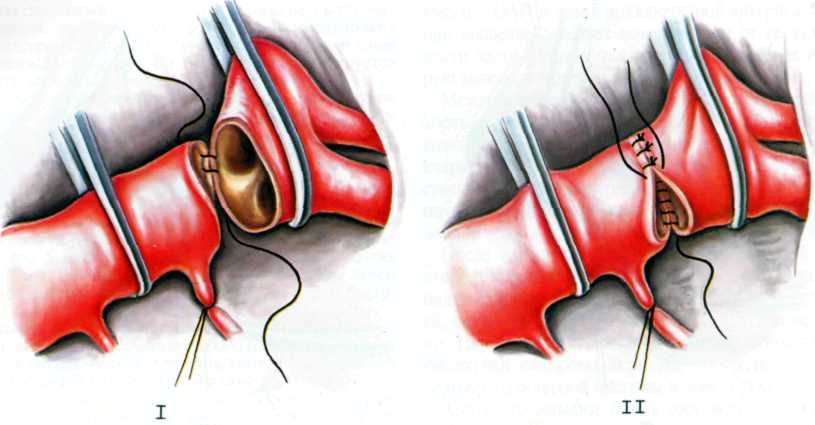
Deuvaert и соавторы модернизировали операцию Waldhausen для случаев коарктации аорты в зоне дистальной дуги.
Шарыкин сообщил, что в Институте сердечно-сосудистой хирургии им. А.Н. Бакулева модифицировали этот метод. В этом центре сначала выполняют ограниченную резекцию суженной аорты и сшивают заднюю губу анастомоза сплошным швом, а затем закрывают дефект, который остался в аорте, лоскутом левой подключичной артерии на ножке, как при операции Waldhausen. Благодаря такой модификации исчезают некоторые недостатки операций с использованием лоскута левой подключичной артерии, обусловленные последующим отрицательным влиянием остатков коарктационного шельфа на ламинарность кровотока.
Авторы отдали преимущество такой модификации, применив ее у 98 пациентов из 136 прооперированных в возрасте от 11 дней до 3 мес. Эта же техника коррекции позже опубликована как оригинальная группой хирургов из Токио, которые с 1991 по 1998 гг. прооперировали 5 больных с рекоарктацией и первичной коарктацией аорты при осложнении ее длинной гипоплазией перешейка.
Аортопластика лоскутом из синтетической ткани
Метод был разработан в 1955 г. Vosschulte. Идея операции заключается в использовании ромбовидного лоскута синтетической ткани для расширения узкого сегмента аорты. Moor и соавторы отзывались о пластике заплатой как об одном из лучших методов оперативного лечения коарктации аорты, тогда как российские хирурги относились к нему достаточно сдержанно. Последние утверждали, что эту разновидность операции следует использовать лишь у некоторых больных с диафрагмальной формой сужения, если соседние отделы аорты нормально развиты и после рассечения артериальной связки аорта выпрямляется.
Соловьев и Хримлян допускали возможность последующего роста перешейка за счет оставленной собственной стенки аорты. Королев и Охотин избегали истмопластики, так как считали, что оставленный мостик аорты имеет аномальную структуру и в последующие годы может стать зоной патологического рубцевания и атероматозного перерождения. Дальнейшие наблюдения предостерегают от широкого использования данного метода в связи с повышенной опасностью формирования аневризм в зоне аортопластики в отдаленном периоде. Однако Underleider допускает целесообразность аортопластики заплатой из гортекса даже у самых молодых детей из-за того, что эластичность этого материала приближает его гемодинамические характеристики к качествам нативной аортальной стенки.
Главное условие адекватности способа непрямой истмопластики заключается в создании перешейка с диаметром, который будет достаточным для необструктивного кровотока и в будущем, т. е. с гиперкоррекцией. Для этого необходимо вживлять заплату достаточно большого размера. Верхний полюс заплаты заводят на ствол левой подключичной артерии, а нижний — на постстенотическое расширение аорты.
Другие модификации аортопластики
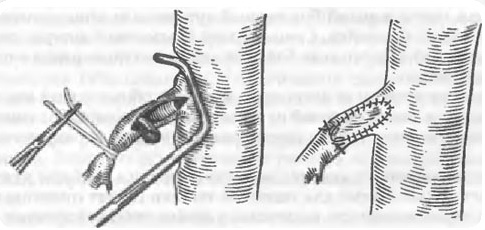
В 1985 г. Campalani и соавторы предложили свою модификацию аортопластики, при которой вместо синтетической заплаты используют лоскут, выкроенный из левой внутренней грудной артерии. Гиперплазия этой артерии, как и других артериальных сосудов с коллатеральной функцией, характерна для тяжелой коарктации аорты, которая сопровождается атрезией или тубулярным недоразвитием аорты на большом протяжении. Недостаток техники Campalani заключается в том, что весь коарктационный шельф навсегда остается в аорте и в дальнейшем искажает местную гемодинамику турбулентностью, как и после операции по Waldhausen.
Еще один оригинальный способ избежать синтетической ткани путем использования лоскута из левой подключичной артерии разработан De Mendonsa в 1985 г.. Прием апробирован некоторыми хирургами, но не получил широкого распространения. Более того, Messmer и соавторы наблюдали после таких операций 43% рестенозов. На повторных операциях они находили массивное утолщение аортальной стенки и смещение левой подключичной артерии. Авторы заподозрили, что причиной этих изменений может быть слишком сильное продольное натяжение артерией. Другой недостаток операции связывают с коарктационным шельфом, который остается в аорте.
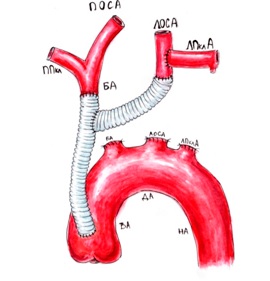
Обходное шунтирование аорты
В 1960 г. Morris и соавторы впервые воспользовались шунтированием коарктации аорты. De Bakey детально разработал и широко внедрил в клинику технику обходного шунтирования.
Метод используют почти исключительно в вынужденных ситуациях в целях уменьшения хирургического риска или в случаях нетипичной коарктации. Преимуществом обходного шунтирования является возможность вживления сосудистого протеза без полного зажатия аорты. Сосуд отжимают частично сбоку, используя специальный зажим. Еще одно преимущество этого способа заключается в том, что практически всегда имеется возможность имплантации сосудистого протеза необходимого диаметра с учетом наиболее отдаленной перспективы. Обычно бывает достаточным протез диаметром 18-20 мм.
Недостатком метода является его неанатомичное размещение, которое по форме напоминает чемоданную ручку. Шунт по меньшей мере дважды отклоняет кровоток и может создавать собственные зоны турбулентности. Этот метод нежелательно использовать у младших детей.
Если есть серьезные сомнения в возможности выполнения анастомоза «конец в конец», то следует подумать об альтернативных методах, таких, как операция Waldhausen или протезирование. Нужно усвоить золотое правило хирургии: в выборе метода коррекции не должно быть шаблона и необходимо руководствоваться конкретной анатомо-гемодинамической ситуацией, учитывая все возможные варианты и предусматривая их последствия. Но в техническом выполнении выбранного способа лучше придерживаться проверенных стандартов, так как в условиях ограниченного времени безопасного пережатия аорты творческие поиски могут стать на пути надежности.
Иногда при умеренном развитии коллатералей предыдущие попытки пережатия аорты оставляют сомнение в возможности безопасной коррекции. В таких случаях можно выполнить тренировку коллатералей кратковременными неполными перекрытиями аорты. Спустя некоторое время ситуация улучшается: проксимальна гипертензия не выходит за пределы 190 мм рт. ст., давление в дистальной аорте растет, диурез замедляется, но не останавливается. Многие объясняют это компенсаторным расширением коллатеральных сосудов и включением в кровообращение резервных сосудов. У младших детей определенную пользу дает введение гепарина из расчета 70-100 ЕД/кг. Это уменьшает вязкость крови, улучшает ее текучесть в коллатералях, предотвращает микротромбозы. Особых геморрагических проблем частичная антикоагуляция не вызывает. Полезным может быть введение раствора маннита и курантила.
При слабом развитии коллатералей, которое наблюдается лишь у больных с умеренной коарктацией аорты, всех вышеуказанных действий бывает недостаточно. В такой ситуации наилучшим средством безопасности может быть простая модификация шунта по Готу: после введения гепарина в половинной дозе канюлируют восходящую и нисходящую части аорты. Эти канюли соединяют тройником, через свободный патрубок которого выпускают воздух, и включают обходной шунт в кровообращение. Функция шунта обеспечивает надежную защиту от проксимальной гипертензии и перегрузки левого желудочка, кровоснабжения спинного мозга, почек и других органов нижнего бассейна. Время безопасного пережатия не лимитируется, что позволяет спокойно и качественно корригировать коарктацию. К недостаткам метода следует отнести необходимость открытия перикарда, определеные технические сложности канюляции аорты, особенно в нисходящем отделе, дополнительную опасность кровопотери, большие затраты времени.
Завершение операции
Сразу по окончании основного этапа операции снимают зажим с периферического конца аорты. Через неплотности в анастомозе или через поры протеза выходит воздух. Одновременно проверяют герметичность шовных линий. При наличии кровоточащих мест дистальную аорту пережимают повторно, из исключенного сегмента удаляют кровь и накладывают дополнительные узловые или П-образные швы. Если при последующем освобождении дистальной аорты герметичность оказывается достаточной, то снимают зажим и с проксимального отдела аорты. Удостоверившись в хорошей герметичности шовных линий и отсутствии градиента артериального давления на реконструированном участке аорты, над ней наглухо зашивают медиастинальную плевру.
При наличии сопутствующего порока сердца с легочной гипертензией операцию дополняют сужением легочного ствола.
Плевральную полость и легкое орошают раствором антибиотика, удаляют сгустки крови, лигатуры-держалки, салфетки. Проверяют качество пульсации аорты в пределах грудной клетки. У взрослых пациентов лучше установить две дренажные трубки, а у детей достаточно одной. После тщательного гемостаза расправляют легкие и смежные с раной ребра сближают двумя-тремя толстыми лигатурами. Валик в это время удаляют. Послойно зашивают рану косметическим швом на кожу.
Временное обходное шунтирование при коррекции коарктации
У небольшой части больных с коарктацией аорты на операции возникает достаточно сложная ситуация, когда пережатие аорты на период коррекции может привести к фатальным осложнениям. Во избежание такой опасности используют у отдельных больных временное обходное шунтирование. Показаниями для этого служат:
-
Недостаточность развития коллатерального кровообращения. Главной причиной слабого развития коллатералей бывает относительно умеренная выраженность самой коарктации или рекоарктации. У одного пациента 16 лет недоразвитие коллатералей объяснялось юкстадуктальной формой коарктации с широким артериальным протоком и легочной гипертензией на системном уровне.
-
Вероятность слишком длительного зажатия аорты.
-
Опасность повреждения аорты зажимом.
-
Состояние после недавно перенесенного острого нарушения мозгового кровообращения, наличие органической патологии ЦНС.
-
Тяжелые поражения почек, отсутствие одной почки в сочетании со сложной анатомией коарктации аорты.
-
Сниженная функция левого желудочка.
-
Аномальное отхождение правой подключичной артерии от коарктационного или постстенотического отдела аорты, что нарушает их коллатеральную функцию.
-
Тяжелые сопутствующие пороки сердца, для которых не предусматривается одновременная коррекция.
В процессе эволюции хирургических технологий коррекции коарктации аорты были применены несколько вариантов ВОШ, при которых варьировали источники временного дистального кровоснабжения, средства для перенаправления части крови обходным путем, способы подключения проксимального и дистального концов временного шунта, степень системной антикоагуляции.

В особенно сложных случаях с плохо контролируемой артериальной гипертензией в последнее время использовали временное шунтирование из левого предсердия в нисходящую аорту через АИК. С этой целью после подготовки к коррекции сужения аорты вводили полную дозу гепарина и канюлировали сначала нисходящую аорту, а затем через небольшое отверстие в перикарде — ушко левого предсердия. Такая последовательность подключения АИК позволяет в случае возникновения кровотечения сразу же вернуть кровь в аорту. Размеры аортальной и венозной канюль подбирали так, чтобы они позволяли при необходимости шунтировать до 50% сердечного выброса. Практически же этот объем не превышал 25-30%.
После включения ВОШ в кровообращение гемодинамика становится более стабильной и не нуждается в значительной фармакологической регуляции во время коррекции порока. Кроме того, разгрузка проксимального артериального бассейна способствует лучшей податливости аорты, что позволяет в большинстве случаев первичной коарктации аорты выполнить прямой анастомоз сосуда. Кроме того, время пережатия аорты почти не лимитируется, благодаря чему улучшается качество анастомоза. Состояние проксимальной гемодинамики контролируется показателями радиального давления и ЭКГ, а дистальной — темпом диуреза.
По окончании коррекции снимают зажимы, контролируют функцию и герметичность анастомозов и удаляют ВОШ. Нейтрализацию гепарина мы проводили только в случаях полной антикоагуляции. Следует иметь в виду, что протезы большой порозности при искусственной антикоагуляции создают опасность неконтролируемого кровотечения через всю поверхность протеза.
Считается, что у наиболее тяжелых пациентов со сложной анатомией порока целесообразнее всего воспользоваться ВОШ из левого предсердия в нисходящую аорту через АИК. При таком варианте шунтирования не нужна оксигенация крови, благодаря чему исчезает опасность специфических для искусственного кровообращения осложнений. Не возникает необходимости мониторирования дистального давления или дренирования спинномозговой жидкости.
Некоторые авторы вместо ВОШ используют параллельную перфузию через бедренные сосуды, но многие не видят в этом преимуществ, за исключением случаев разрыва аневризмы и гематоракса.
Особенности коррекции коарктации аорты с гипоплазией дуги аорты
Гипоплазия дуги аорты встречается как изолированная аномалия и в сочетании с различными внутрисердечными пороками, в том числе является элементом синдрома гипоплазии левых отделов сердца.
Критерии степени гипоплазии дуги аорты, требующие коррекции, сформулировали Karl и соавторы. Реконструкция дуги показана, если диаметр поперечной части дуги, измеренной на ЭхоКГ, в численном выражении меньше массы тела пациента, плюс 1. Например, если у младенца массой 3 кг диаметр дуги аорты менее 4 мм, дугу следует считать гипопластической, и ему показано хирургическое расширение аорты. Хотя остаточная гипоплазия дуги после коррекции изолированной коарктации аорты хорошо переносится больными, она создает угрожающую дополнительную постнагрузку на сердце, подвергшемся сложной внутрисердечной коррекции с продолжительной ишемией миокарда и искусственным кровообращением.
Коарктация аорты с тяжелой гипоплазией аортальной дуги является дуктусзависимой патологией. Спонтанное закрытие артериального протока становится причиной тяжелых изменений клинического состояния младенца:
-
ослабевает функция левого желудочка;
-
исчезает бедренный пульс;
-
развивается ацидоз.
Инфузия ПГЕ1 может значительно улучшить ситуацию и позволяет отложить операцию до тех пор, пока у младенца возобновятся функция желудочков и бедренный пульс. Благодаря внедрению простагландина большинство новорожденных с коарктацией аорты и гипоплазированной дугой доживают до операции.
Этот вариант порока в большинстве случаев осложняется еще и внутрисердечными аномалиями, поэтому часто приходится делать выбор между одновременной коррекцией всех аномалий и поэтапной коарктацией. Siewers и соавторы отметили, что одновременная коррекция обеспечивает низкую летальность лишь при сочетании с ДМЖП. Из-за этого при наличии тяжелых, проблематичных для одновременной коррекции внутрисердечных аномалий важным фактором успеха является реконструкция до нормы гипоплазированной аортальной дуги, особенно в случаях синдрома гипоплазии левых отделов сердца.
По поводу целесообразности коррекции дуги аорты Siewers и соавторы пришли к выводу, что расширение коррекции на дугу может быть зарезервировано лишь для небольшой группы младенцев, у которых соотношение диаметра дуги аорты к восходящей аорте не превышает 0,25. Опыт этих авторов показывает, что после коррекции коарктации аорты наблюдается улучшение роста поперечной дуги аорты у всех пациентов. Однако с таким выводом соглашаются не все, из-за чего количество методов коррекции гипоплазированной аорты постоянно растет. Выше упоминались варианты расширенного анастомоза, пластика дуги заплатой из тонкостенного GoreTex, постоянное обходное шунтирование из восходящей в нисходящую аорту сосудистым протезом.
Amato и соавторы предложили метод коррекции гипоплазии дистальной дуги у младенцев, предусматривающий использование тканей левой сонной артерии и левой подключичной артерии. Обе артерии рассекают вертикально. Образовавшиеся отверстия соединяют разрезом верхнего края гипоплазированной дистальной дуги. Затем сшивают между собой задние края разрезов артерий с дугой. Аналогичный шов выполняют спереди. В результате гипоплазированный участок расширяется. Далее производят расширенную пластику коарктации перешейка аорты.
В 1993 г. группа бразильских хирургов применила каротидно-подключичний анастомоз «бок в бок». Mellgren и Friberg резекцию коарктационного сегмента дополняли пластикой аортальной дуги лоскутом, выкроенным из ствола левой сонной артерии. Авторы воспользовались такой методикой у недоношенных и тяжелобольных новорожденных и не имели церебральных повреждений, которые были бы связаны с перевязкой сонной артерии. О хороших ранних результатах коррекции дуги методом реверсивной аортопластики лоскутом левой подключичной артерии у 46 детей в возрасте до 3 мес сообщили Kanter и соавторы. К этим методам можно приобщить анастомоз «конец в бок» между нисходящей и восходящей аортой, которым с 1992 г. пользуются Rajasinghe и соавторы и Younoszai и соавторы.
Особенности коррекции коарктации аорты через трансстернальний доступ
Продольную стернотомию используют для коррекции коарктации аорты в трех случаях:
-
при одновременной коррекции коарктации и внутрисердечных аномалий;
-
при одновременном выполнении паллиативных процедур;
-
иногда для коррекции рекоарктации.
Сторонники одномоментной коррекции аномалий приводят следующие аргументы в пользу такой тактики:
-
уменьшается количество разрезов и операций;
-
повышается безопасность пациентов с недостаточным развитием коллатералей и нестабильной гемодинамикой;
-
доступ обеспечивает достаточные, а в некоторых случаях исключительные условия для коррекции сужения аорты;
-
позволяет улучшить хирургическую экспозицию у больных с внутрисердечными пороками;
-
операция связана с меньшим стрессом для хирурга.
Реконструкция гипоплазии дуги предусматривает необходимость выключения ее из кровообращения, поэтому операцию обычно проводят в условиях остановки кровообращения при глубокой гипотермии. В настоящее время отмечается тенденция к отказу от остановки кровообращения в пользу постоянной перфузии мозга с низким объемом кровотока без прямой канюляции сосудов дуги. Выполняя коррекцию коарктации аорты и внутрисердечных аномалий в условиях умеренной гипотермии, Serraf и соавторы на период коррекции дуги аорты применили селективную церебральную перфузию у 22 новорожденных. Для реконструкции гипоплазированной дуги эти авторы использовали заплату из легочной артерии больного.
В условиях глубокой гипотермии проводят перфузию мозга через безымянную артерию с объемной скоростью 0,3-0,8 л/мин/м2. При достаточных размерах аорты ее канюлируют проксимальнее устья безымянной артерии и после охлаждения до заданной температуры канюлю проводят в артерию. Эту методику применяют при бивентрикулярной коррекции и в некоторых случаях выполнения операции Norwood. Выделяя дугу аорты и ее ветви, а затем нисходящую аорту, стараются избежать повреждения диафрагмального, блуждающего и левого гортанного нервов. Открытый артериальный проток или связку на его месте также выделяют и разделяют. Этот маневр облегчает последующую мобилизацию нисходящей аорты. При достаточной осторожности в большинстве случаев удается выделить всю коарктацию аорты без повреждения плевры.
Саму коарктацию устраняют одним из известных способов. При гипоплазии аортальной дуги может осуществляться расширенная аортопластика ее вогнутой поверхности на всем протяжении вместе с коарктацией. В качестве материала для пластики используют тонкостенный политетрафлюороэтилен или лоскут из легочного гомографта. Иногда применения заплаты удается избежать, подтягивая конец пересеченной дистальной аорты к дуге или к восходящей аорте и анастомозируя по типу «конец в бок «. Конец культи дуги заглушают швом.
Особенности коррекции коарктации аорты при аневризмах в этой зоне
Аневризмы аорты и межреберных артерий, локализованных вблизи сужения аорты, до операции диагностируются не всегда. В большинстве случаев они обнаруживаются непосредственно на операции. Особенно это касается аневризм межреберных артерий, которые плохо видны даже при аортографии, так как кровоток в межреберных артериях при коарктации имеет обратное направление.
В подобных случаях действуют следующим образом. Выделяют дугу и престенотический отдел, затем — аорту ниже коарктации, под ними подводят тесемки. Аорта становится более мобильной, и последующее выделение аневризмы несколько облегчается. Пораженную межреберную артерию перевязывают дистально от аневризмы. Если удавалось в этом месте разделить артерию между лигатурами, последующая обработка аневризмы при зажатой аорте становится несложной. Если аневризма разрывается, источник кровотечения прижимают пальцем и отсекают перевязанную межреберную артерию от аорты. Стенка аорты вместе с остатками аневризмы становится доступной для бокового зажима и ушивания или резекции вместе с удаленным коарктационным сегментом аорты.
Аневризмы аорты в области коарктации почти всегда расположены в постстенотическом отделе, чаще имеют цилиндрическую форму, реже они асимметричные или мешковидные, размером от 1,5 до 12 см, иногда со сплошным или частичным кальцинозом. Обызвествленные аневризмы аорты можно обнаружить на обычных рентгенограммах перед операцией. Более мелкие аневризмы без кальциноза становятся находкой хирурга на операции. Иногда на наличие инфицированной аневризмы указывают повышенная температура или периферические васкулиты нижних конечностей.
На операции бывает трудно оценить истинные размеры аневризмы, особенно если она происходит из правой заднебоковой стенки. Такая аневризма частично закрыта от хирурга и может проникать в пространство между позвоночником и пищеводом или между последним и трахеей. Особенностью аневризм при коарктации аорты являются их относительно толстые стенки, но к ним подходят тонкостенные, большие по размеру межреберные артерии, в которых давление отвечает системному и не снижается, а растет после пережатия дуги. Поэтому анестезиолог должен медикаментозными средствами снижать давление. Аневризма сращена с окружающими тканями, а места входа и размеры коллатеральных сосудов иногда сложно определить, поэтому нисходящую аорту сначала выделяют на некотором расстоянии от аневризмы. Достигнув контроля над проксимальным и дистальным отделами аорты, постепенно выделяют аневризму и обрабатывают связанные с ней артерии. Таким образом, удается обнажить основание аневризматического мешка и отсечь его при зажатой аорте.
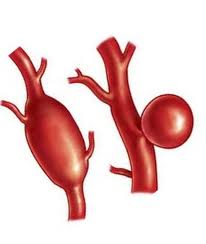
Иногда аневризма распространяется далеко вправо между органами заднего средостения и наполняется кровью из недоступных для обработки артерий. В этих случаях целесообразно не иссекать аневризматический мешок, а исключить его из кровообращения путем перевязки и прошивания со стороны аорты. Аорту пересекают проксимально и дистально между зажимами и соединяют протезом. В последующем благодаря отсутствию проточного кровотока аневризма тромбируется и превращается в опухолевидное образование, которое не нарушает функции соседних органов. При инфицированных аневризмах необходимо иссекать весь аневризматический мешок.
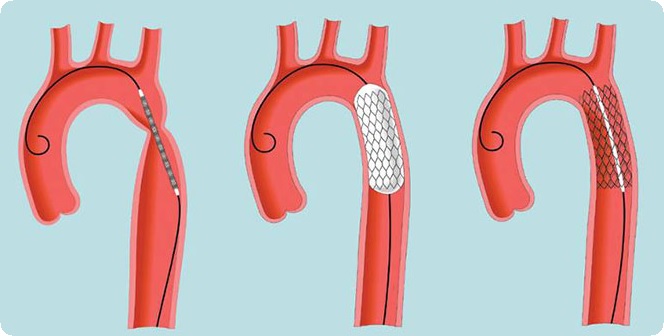
Баллонная дилатация
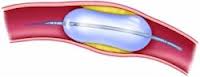
Rao и соавторы сопоставили результаты чрескожной баллонной дилатации и хирургической операции у детей с коарктацией аорты в возрасте до 3 мес и пришли к выводу, что баллонная дилатация дает меньше осложнений и может быть альтернативой хирургическому вмешательству у младенцев такого возраста. Недостатком этого метода является возможность острого расслоения аорты, скорого рестеноза и формирование аневризмы в отдаленные сроки.
В последнее время стало популярным дополнять дилатацию эндоваскулярным стентированием. Преимущества такого сочетания заключаются в сохранении достигнутого расширения аорты и предупреждении экстравазатов через трещины. Однако у 17 % подростков и взрослых пациентов уже через год после стентирования при повторной ангиографии обнаружили аневризмы аорты, несмотря на удовлетворительные непосредственные результаты. Auriacombe обнаружил поздние аневризмы у 20% больных и считает, что у взрослых пациентов лучше применять хирургическое лечение. О случае разрыва аорты после стентирования первичной коарктации у взрослого пациента сообщают Korkola и соавторы. Многие врачи рекомендуют выполнение баллонной дилатации у младенцев при сочетании коарктации аорты со стенозом аортального клапана, у беременных женщин и в случаях резкого снижения сократительной функции левого желудочка.
Операционные осложнения
Кровотечение в зоне коарктации отличается внезапностью, скоростью кровопотери, тяжестью контроля. Источниками кровотечения бывают аорта и ее большие ветви, особенно расширенные, тонкостенные, хрупкие межреберные артерии, артерия Аbbott, а также артериальный проток. Кровотечение возникает при повреждении сосудов в процессе их препаровки и перевязки или в результате соскальзывания лигатур, а также из неплотностей по линии анастомоза, из его надрывов и мест, где прорезались швы в результате большого натяжения и неравномерного распределения нагрузок вдоль линии шва, склеротических включений. При вживлении сосудистого протеза или заплаты из дакрона или лавсана наблюдается просачивание крови через их поры. Особенно опасным этот феномен может стать в результате гепаринизации.
-
Другие осложнения операции.
Первичная сердечно-сосудистая недостаточность, острый инфаркт миокарда, опасные аритмии — это осложнения, которые бывают у младенцев с тяжелыми сопутствующими пороками или у взрослых пациентов со вторичной кардиомиопатией и поздними стадиями клапанных аномалий. При слабом развитии коллатерального кровообращения попытки пережатия аорты могут сопровождаться брадикардией, которая в данном случае является предостережением хирургу и анестезиологу и требует дополнительных решений, например ВОШ или изменения плана коррекции.
Необратимые поражения мозга во время операции нечасты, хотя и возможны на фоне значительного повышения проксимального артериального давления после пережатия аорты, особенно у пациентов с аневризматическими изменениями мозговых артерий.
Течение послеоперационного периода
После полноценной коррекции коарктации аорты послеоперационный период проходит благоприятно. Не меньше двух раз в сутки измеряют артериальное давление на ногах. Каждые 3 ч контролируют ЦВД и водный баланс, особое внимание обращают на объем и темп диуреза. При склонности к гипертоническим кризам назначают ганглиоблокаторы или натрия нитропруссид. После устранения коарктации аорты почки подвергаются действию пульсирующего кровотока и реагируют на него увеличением диуреза. Это одна из причин потребности в повышенных дозах инфузии кровезамещающих жидкостей. Рекомендуют поддерживать ЦВД в пределах 40-100 мм вод. ст. Как можно раньше и почти без ограничения разрешается пить негазированную воду, а затем и соки. Таких простых действий часто бывает достаточно, чтобы предотвратить спазмирование сосудов и уменьшить склонность к парадоксальной артериальной гипертензии.
-
Парадоксальная гипертензия и абдоминальный синдром.
Радикальная коррекция коарктационного шлюза приводит к значительным изменениям гемодинамики в артериальной системе больного. Верхняя часть тела после привычной гипертензии внезапно оказывается в нормотензивных условиях. В это же время нижняя часть тела после длительного пребывания в состоянии субкомпенсированного дефицита кровообращения и демпфирования так же внезапно испытывает влияние пульсирующего тока артериальной крови, которая протекает с необычно высокой для нижнего артериального бассейна линейной и объемной скоростью. Очевидно, что во всех случаях после оперативного вмешательства сосудорегулирующие системы организма проходят через больший или меньший период адаптации к новой гемодинамической ситуации. В большинстве случаев это не создает сколько-нибудь заметных болезненных проявлений. Но у некоторых пациентов период приспособления осложняется развитием парадоксальной гипертензии и абдоминального синдрома. Это специфическая реакция на устранение коарктации аорты, и она не имеет аналогии в хирургической практике. Оба осложнения наблюдаются не только после хирургического вмешательства, но и после баллонной дилатации коарктации.
Парадоксальная гипертензия и абдоминальные боли осложняют от 10 до 15 % операций при коарктации аорты, а необходимость гипотензивной поддержки в раннем послеоперационном периоде возникает почти у каждого пациента.

Клиническая картина характеризуется повышением как систолического, так и диастолического компонентов артериального давления. Это наблюдается уже в первые 12-24 ч после операции или на 3-и-4-е послеоперационные сутки. Иногда уровень артериального давления превышает дооперационные значения. В некоторых случаях гипертензия сопровождается абдоминальными болями, метеоризмом, тонкокишечным кровотечением, склонностью к парезу кишечника, лихорадкой и лейкоцитозом.
Известны случаи возникновения некроза тонкой кишки, перфоративных язв желудка и двенадцатиперстной кишки и даже смерти больных. Moss сообщил об описанных в литературе 110 случаях смерти от парадоксальной гипертензии и абдоминального синдрома. Однако в последующем такие случаи почти не встречались, поскольку своевременное эффективное лечение синдрома предотвращает тяжелые осложнения.
-
Кровотечение.
Самой частой причиной смертельного кровотечения в раннем послеоперационном периоде является разрыв анастомоза. Такую же опасность могут создать кровотечение из культи артериального протока, разделенных коллатеральных артерий, гнойная эрозия аорты.
Меньшие по объему и темпу кровопотери возникают из поврежденных во время операции мелких сосудов. Это приводит к увеличенной экссудации через дренажную систему или аккумуляции крови в плевральной полости.
-
Острая почечная недостаточность.
К этому осложнению могут привести технические погрешности во время коррекции или тяжелые дистрофические изменения в паренхиме почек.
-
Спинальные повреждения.
Чрезвычайно опасным осложнением могут стать ишемические поражения спинного мозга, которые проявляются в раннем послеоперационном периоде в виде нижнего парапареза или параплегии. Они развиваются как следствие гипоксии в системе кровоснабжения спинного мозга.
Кровообращение спинного мозга обеспечивается главным образом благодаря передней спинномозговой артерии, которая проходит от затылочного отверстия к крестцовому отделу, принимая на своем пути вспомогательные источники снабжения от межреберных сосудов. Однако в большинстве случаев эта артерия бывает представлена отдельными сегментами, слабо связанными между собой.
Верхний отдел передней спинальной артерии кровоснабжает шейный и верхний грудной регионы спинного мозга. Он образуется путем слияния двух боковых ветвей позвоночных артерий и еще нескольких ветвей глубоких шейных и верхних межреберных артерий.
Средний отдел передней спинальной артерии охватывает уровень Th 8-9. Он создается ветвями соответствующих межреберных артерий.
Нижний отдел передней спинальной артерии носит название артерии Адамкевича. Считают, что ниже IX грудного позвонка кровоснабжение спинного мозга происходит за счет этой и некоторых вспомогательных ветвей. У половины больных большая по размеру корешковая артерия Адамкевича бывает единственным источником кровоснабжения крестцового отдела спинного мозга.
Наибольшая угроза спинального паралича возникает в случае необходимости контроля кровотечения при пережатии аорты на длительное время и в результате шока геморрагического или другого происхождения, при котором происходит стойкое падение артериального давления.
-
Ишемические повреждения левой руки.
Это осложнение возникает в результате использования левой подключичной артерии для устранения артериальной обструкции. Наблюдается почти всегда в легкой форме, которая ограничивается клиническими проявлениями умеренной артериальной гипотензии левой руки. Все эти симптомы достаточно быстро исчезают, но в последующем все же происходят умеренные гипотрофические процессы, которые в более отдаленные сроки приводят к уменьшению длины и силы этой конечности.
Чрезвычайно редко наблюдались случаи прогрессирующей ишемизации и гангрены конечности, описаны летальные исходы от этого осложнения. Уменьшить опасность ишемического повреждения можно назначением гепарина непосредственно перед зажатием аорты, продолжая при необходимости гепаринизацию под контролем времени свертывания крови.
Для профилактики этого осложнения Fournier и соавторы использовали внутреннюю грудную артерию для шунтирования и таким способом сохраняли кровообращение левой руки после аортопластики лоскутом подключичной артерии. В некоторых случаях дополняют операцию Waldhausen протезированием использованного сегмента подключичной артерии. Другие авторы сообщали о вживлении оставшейся культи подключичной артерии в ствол левой общей сонной артерии.
-
Хилоторакс.
Грудной проток проходит сзади и слева от аорты и поэтому может повреждаться в процессе диссекции аорты. Однако в большинстве случаев травме подвергаются относительно небольшие притоки грудного протока. Если после операции начинает выделяться через дренаж экссудат молочного цвета, следует заподозрить возможность хилоторакса. Тактика лечения этого осложнения зависит от динамики экссудации. Сначала можно использовать консервативное лечение диетой, обогащенной среднецепочечными триглицеридами. Но если экссудация остается большой, показана реторакотомия. За 40 мин до вмешательства через назогастральный зонд пациенту дают сливки. Это заметно облегчает идентификацию места вытекания лимфы.
Результаты хирургического лечения
При изолированных вариантах коарктации аорты хирургическое лечение бывает наиболее успешным у пациентов от 5 до 20 лет. Однако при сочетании коарктации аорты с другими сердечнососудистыми пороками рано развивается сердечная недостаточность, и это приводит к гибели значительной части больных уже на первом году жизни.
Многие хирурги пришли к выводу о целесообразности хирургического лечения осложненной коарктации аорты в грудном возрасте, даже принимая во внимание большую операционную летальность и повышенную частоту рекоарктации у этого контингента больных.
В описанных в литературе группах пациентов разного возраста и с разными типами порока показатели операционной летальности колеблются от 1,3 до 12,7%.
В неосложненных случаях уже на момент выписки пациента нормализуется или снижается артериальное давление, исчезает избыточная пульсация артерий верхней части тела, на нижних конечностях появляется артериальный пульс, а давление на подколенной артерии легко определяется аускультативным методом, возобновляется правильное соотношение между уровнями артериального давления на верхних и нижних конечностях, исчезает патологический градиент Hartmann. Нормализация артериального давления способствует исчезновению таких симптомов, как головная боль, головокружение, парестезии, зрительные и слуховые отклонения, носовые кровотечения. Однако у взрослых пациентов после качественной коррекции сужения аорты нередко наблюдается неустойчивость артериального давления или плохое самочувствие при нормальных его показателях.
Всем пациентам старше 10 лет целесообразно ограничение физических нагрузок в течение 6 мес, а больным с тяжелыми некорригированными сопутствующими пороками сердца — на период до их полного устранения. Детям до 10 лет с хорошо корригированными пороками физическую активность следует ограничить в течение 2-3 мес после операции. В каждом случае необходимо остерегаться травм грудной клетки.
О хороших результатах хирургического лечения коарктации аорты в отдаленные сроки сообщали многие авторы. В основном это касается простой коарктации. Если же коарктация аорты была осложнена другими пороками и сердечной недостаточностью и корригировалась на первом году жизни, то поздняя летальность возрастает до 12% и даже до 24,7%.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии