Гипогликемия у детей: причины, симптомы, лечение
Глюкоза играет центральную роль в энергетическом обмене. Она не только участвует в формировании энергетических запасов в форме гликогена, жира и белка, но и служит непосредственным источником энергии: при окислении 1 моля глюкозы образуется 38 молей АТФ. Головной мозг использует преимущественно глюкозу, и практически весь потребляемый им кислород расходуется на ее окисление. Мозг поглощает глюкозу с помощью инсулиннезависимых переносчиков. Таким образом, транспорт глюкозы в мозговые клетки представляет собой опосредованный переносчиками процесс облегченной диффузии, который зависит лишь от концентрации глюкозы в крови. Дефицит переносчиков глюкозы в головном мозге приводит к судорогам даже при нормальном уровне глюкозы в крови. В организме существует сложная система регуляции гликемии, препятствующая опасному для мозга снижению концентрации глюкозы в крови.

Защита от гипогликемии организуется автономной нервной системой и гормонами, совместное действие которых повышает продукцию глюкозы (путем изменения активности ферментов гликогенолиза и глюконеогенеза) и одновременно снижает ее поглощение периферическими тканями. Поэтому гипогликемия отражает нарушение сложных взаимодействий, обеспечивающих сохранение нормогликемии в условиях сытости и голодания. Поддержание нормогликемии особенно важно при резком переходе от внутриутробной жизни (когда глюкоза проникает в плод через плаценту) к самостоятельному существованию.
Отсутствие симптомов еще не является гарантией нормальной концентрации глюкозы и сохранения ее на безопасном для головного мозга уровне. Гипоксемия и ишемия мозга усиливают действие гипогликемии, способствуя развитию хронических нарушений ЦНС. Нижняя граница приемлемого уровни глюкозы в крови для новорожденных с какими-либо заболеваниями, нарушающими обмен веществ в головном мозге, остается неизвестной. Даже безотносительно к возможным неврологическим, интеллектуальным и психическим последствиям многие авторы в настоящее время считают опасным уровень глюкозы в крови у новорожденных ниже 50 мг%, настаивая на необходимости его коррекции. Это особенно важно в первые 2-3 ч жизни, когда содержание глюкозы в норме оказывается минимальным. Затем оно начинал расти и через 12-24 ч достигает 50 мг% и более. После этого срока концентрация глюкозы ниже 50 мг% в цельной крови (в сыворотке или плазме — на 10-15% меньше) рассматривается как гипогликемия.
Значение и последствия
Кругооборот глюкозы определяется в основном ее участием в метаболизме головного мозга. У новорожденных и маленьких детей головной мозг потребляет почти всю продуцируемую печенью глюкозу. Кроме того, в любом возрасте существует корреляция между продукцией элементы мозга распадаются до лактата, пирувата, рино- и кетокислот, которые поддерживают метаболизм мозга ценой его роста. Способность головного мозга новорожденных поглощать и окислять кетоновые тела почти в 5 раз выше соответствующей способности зрелого мозга. Однако продукция кетоновых тел печенью в этот период не всегда удовлетворяет потребностям мозга, особенно в условиях гиперинсулинемии, когда подавляется не только поступление глюкозы из печени в кровь, но и липолиз и кетогенез, поэтому мозг лишается и альтернативных источников энергии. В результате при гиперинсулинемии падает потребление мозгом кислорода, усиливается распад мозговых структур и нарушается целость клеточных мембран, что может привести к необратимым нарушениям роста и функций головного мозга. Гипоксия усиливает повреждающее действие гипогликемии, а в условиях даже незначительного снижения уровня глюкозы в крови сама является причиной повреждения мозга.
Главные последствия тяжелой и длительной гипогликемии — умственная отсталость и/или повторные судороги. Возможны также и некоторые изменения характера. Частые приступы гипогликемии у детей до 6-месячного возраста (период наиболее быстрого роста мозга) более чем в 50% случаев приводят к необратимым изменениям в ЦНС — сглаживанию извилин и атрофии коры больших полушарий, нарушению миелинизации белого вещества мозга. Если единственным повреждающим фактором является гипогликемия (без гипоксии/ ишемии), то инфаркты мозга отсутствуют, а функции мозжечка сохраняются. Тяжелые последствия гипогликемии наиболее вероятны при лишении мозга альтернативных источников питания (как это имеет место при гиперинсулинемии), при повторных или длительных приступах гипогликемии и при одновременной гипоксии мозга. Точно определить степень или продолжительность гипогликемии у детей, которая приводит к постоянным мозговым нарушениям, невозможно. Хотя и реже, но и у старших детей гипогликемия может вызывать необратимые повреждения нервной системы, индуцируя выделение нейротоксических медиаторов и гибель нейронов.
Регуляция гомеостаза глюкозы
-
Новорожденные.
В норме плод получает глюкозу от матери (через плаценту). Поэтому концентрация глюкозы у плода обычно соответствует (хотя и несколько ниже) ее уровню в крови матери. В условиях стресса (например, при гипоксии) выделяются катехоламины, которые, взаимодействуя с β-адренорецепторами печени и жировой ткани плода, мобилизуют глюкозу и свободные жирные кислоты. Одновременно катехоламины тормозят секрецию инсулина и стимулируют секрецию глюкагона.
Острое прекращение поступления материнской глюкозы при рождении требует немедленной мобилизации эндогенной глюкозы. Этому способствует изменение:
-
секреции гормонов;
-
гормональных рецепторов;
-
активности ключевых ферментов.
Уже в первые минуты и часы после рождения концентрация глюкагона возрастает в 3-5 раз. Уровень инсулина обычно снижается и остается низким в течение нескольких дней, причем в этот период отсутствует его обычный ответ на глюкозу. Характерно также резкое возрастание секреции катехоламинов. Адреналин через а-рецепторы стимулирует секрецию гормона роста. Эти гормональные сдвиги усиливают гликогенолиз и глю сонеогенез, активируют липолиз и способствуют кетогенезу. В результате концентрация глюкозы в плазме после кратковременного снижения стабилизируется, запасы гликогена в печени быстро истощаются, и в первые несколько часов после рождения примерно 10% продуцируемой глюкозы образуется из аланина (главного аминокислотного предшественника глюконеогенеза). Выброс глюкагона и адреналина приводит также к повышению концентрации свободных жирных кислот в крови, что усиливает образование кетоновых тел. Таким образом, глюкоза сохраняется для мозга, а источником энергии для мышц служат свободные жирные кислоты и кетоны. Окисление жирных кислот в печени, кроме того, приводит к образованию необходимых для глюконеогенеза ацетил-КоА и НАДФ.
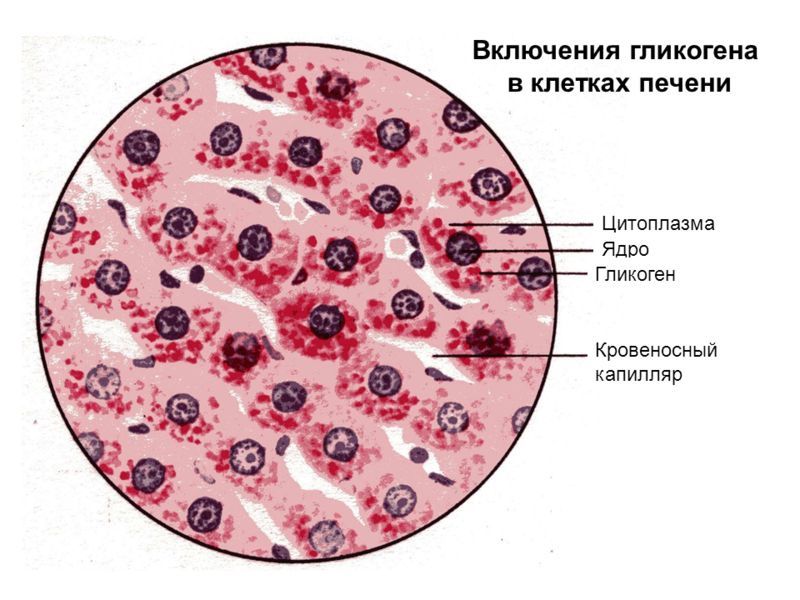
Усиленная секреция глюкагона поджелудочной железой в раннем постнатальном периоде поддерживает нормальную концентрацию глюкозы в крови. Одновременно происходят резкие адаптивные изменения гормональных рецепторов и ключевых ферментов, участвующих в образовании глюкозы. После рождения активность гликогенсинтазы быстро падает, а фосфорилазы резко возрастает. Значительно увеличивается и активность фосфоенолпируваткарбоксикиназы (лимитирующей скорость глюкогеогенеза), чему отчасти способствуют выброс глюкагона и снижение секреции инсулина.
Поэтому гипогликемия у новорожденных может быть связана с нарушением гормональной секреции, дефицитом субстратов (печеночного гликогена, мышечных аминокислот и жирных кислот) или недостаточностью ключевых ферментов метаболизма глюкозы.
-
Дети старше 1-3 мес.
В этом возрасте, как и у взрослых, уровень глюкозы в крови сразу после еды поддерживается за счет гликогенолиза, а в интервале между приемами пищи — за счет глюконеогенеза. У ребенка с массой тела 10 кг печень содержит 20 - 25 г гликогена и этого хватает для компенсации нормального расходования глюкозы (4-6 мг/кг/мин) только на 6-12 ч. Затем необходима активация глюконеогенеза. Гликогенолиз и глюкинеогенез требуют сохранности метаболитических путей. Нарушения глюконеогенеза у ребенка могут оставаться скрытыми, пока его кормят каждые 3-4 ч, и проявляются только тогда, когда его перестают кормить по ночам (обычно в 3-6-месячном возрасте). Источником субстратов глюконеогенеза служат главным образом белки мышц. У маленьких детей относительная масса мышц существенно ниже, чем у взрослых, а потребности глюкозы на единицу массы тела гораздо выше. Поэтому они не способны выдерживать длительное голодание. Кроме того, в их мышцах образуется меньше аланина. В результате уровень глюкозы в крови у здорового ребенка этого возраста через 24 ч голодания падает, концентрация инсулина соответственно составляет менее 5-10 мкЕД/мл, липолиз и кетогенез активируются, в моче появляются кетоновые тела.
Переход от синтеза гликогена во время и сразу после еды к его распаду, а позднее к глюконеогенезу регулируется гормонами, среди которых центральная роль принадлежит инсулину. После еды концентрация инсулина в плазме достигает максимума (50-100 мкЕД/мл), что стимулирует синтез гликогена, усиливает поглощение глюкозы периферическими тканями и тормозит образование глюкозы, препятствуя резкому возрастанию ее уровня в крови. Одновременно усиливается генез и тормозится липолиз и кетогенез. При этом уровень инсулина падает до 5-10 мкЕД/м71 и ниже, что, наряду с другими гормональными изменениями, приводит к активации глюконеогенеза. Следует подчеркнуть, что уровень инсулина в таких условиях выше 5 мкЕД/мЛ на фоне гликемии ниже 40 мг% (2,2 мМЕ) указывает на гиперинсулинизм и нарушение нормальных механизмов подавления его секреции при голодании. Эффектам инсулина противодействует ряд гормонов, концентрация которых в плазме при падении уровня глюкозы возрастает. Эти так называемые контррегуляторные гормоны — глюкагон, гормон роста, кортизол и адреналин — повышают уровень глюкозы в крови путем активации ферментов гликогенолиза (глюкагон, адреналин), индукции ферментов глюконеогенеза (глюкогон, кортизол ) и угнетения поглощения глюкозы мышцами (адреналин, гормон роста, кортизол). Кроме того, кортизол усиливает мобилизацию мышечных аминокислот, используемых для глюконеогенеза, а адреналин, кортизол, гормон роста и глюкагон активируют липолиз, обеспечивая глюконеогенез глицерином, а кетогенез свободными жирными кислотами. Адреналин также тормозит секрецию инсулина и стимулирует секрецию глюкагона.
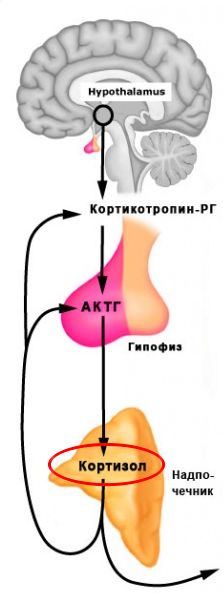
Врожденный или приобретенный дефицит этих гормонов может стать причиной гипогликемии, приводя к недостаточной продукции глюкозы в интервале между приемами пищи или при голодании. При одновременном дефиците нескольких гормонов (гипопитуитаризм) гипогликемия бывает более тяжелой или при голодании возникает чаще, чем при дефиците какого-либо одного из них. Гипогликемия у детей чаще всего отражает нарушение механизмов адаптации к голоданию.
Клинические проявления
Клинические проявления гипогликемии можно разделить на две группы.
-
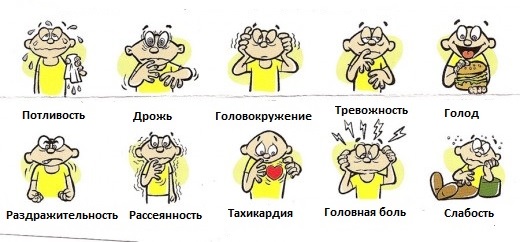
К одной из них относятся симптомы, связанные с активацией автономной нервной системы и секреции адреналина. Они обычно возникают при быстром падении уровня глюкозы в крови.
-
Вторую группу составляют симптомы, обусловленные дефицитом глюкозы для мозга, которые проявляются, как правило, при медленном снижении уровня глюкозы или при длительной гипогликемии.
У грудных детей симптомы гипогликемии могут быть иными и проявляться цианозом, апноэ, гипотермией, снижением тонуса мышц, вялым сосанием, сонливостью и судорогами. Иногда эти симптомы настолько незначительны, что не привлекают внимания. В ближайшем постнатальном периоде гипогликемия может быть и бессимптомной. При гиперинсулинемии часто отмечается макросомия новорожденных, в более старшем возрасте из-за хронической гипогликемии дети очень много едят, у них развивается ожирение. Гипогликемия у детей может сопровождаться поведенческими сдвигами, нарушением внимания, прожорливостью или судорогами, что иногда ошибочно принимают за проявления эпилепсии, опьянения, психоза, истерии или олигофрении. Содержание глюкозы в крови новорожденных необходимо определять при любых отклонениях от нормы, и, если оно оказывается ниже 50 мг%, следует сразу же провести его коррекцию. Гипогликемия может быть причиной первых судорожных припадков или внезапных нарушений психического состояния в любом возрасте.

Классификация гипогликемий в неонатальном и детском возрасте
Гипогликемии классифицируют в соответствии с известными сведениями о регуляции метаболизма глюкозы у детей.
Неонатальная транзиторная гипогликемия, дети с малой массой тела для гестационного возраста и недоношенные. Общая частота гипогликемии, сопровождающейся клиническими симптомами, составляет 1-3:1000 новорожденных. Среди новорожденных определенных групп риска она возрастает во много раз. К гипогликемии предрасположены недоношенные дети и новорожденные с малой массой тела для гестационного возраста. Высокая частота гипогликемии среди них, как и среди других групп, объясняется недостаточными запасами печеночного гликогена, мышечного белка и жира. У таких детей трансплацентарный перенос питательных веществ либо рано прекратился, либо был нарушен. У них может быть недостаточно развита ферментативная система глюконеогенеза.
В отличие от недостаточности субстратов или ферментов, гормональная система у большинства новорожденных из группы низкого риска к моменту рождения функционирует нормально. Концентрация аланина, лактата и пирувата в плазме, несмотря на гипогликемию, повышена, что указывает на снижение скорости глюконеогенеза из этих субстратов. Введение аланина усиливает секрецию глюкагона, но практически не сказывается на уровне глюкозы в крови. В первые сутки концентрация ацетоацетата и Р-гидроксибутирата в плазме у детей с малой для гестационного возраста массой тела ниже нормы. Это говорит о низких запасах липидов, недостаточной мобилизации жирных кислот или нарушении кетогенеза, а возможно, и о сочетании всех этих факторов. Наиболее вероятна все же роль недостаточных запасов липидов, поскольку кормление новорожденных триглицеридами повышает содержание глюкозы, свободных жирных кислот и кетоновых тел в плазме. Кроме того, у перенесших гипоксию новорожденных и некоторых детей с малой для гестационного возраста массой тела может иметь место транзиторная гиперинсулинемия, снижающая уровень глюкозы и свободных жирных кислот в плазме.
Свободные жирные кислоты играют важнейшую роль в стимуляции глюконеогенеза у новорожденных. Кормление жирными смесями или материнским молоком предотвращает гипогликемию, обычно развивающуюся в первые часы после рождения. Поэтому детей следует начинать кормить не позднее чем через 4-6 ч после рождения. При респираторном дистресс-синдроме или в тех случаях, когда уровень глюкозы в крови при кормлении не превышает 50 мг%, необходимо вводить глюкозу внутривенно со скоростью 4-8 мг/кг/мин. Неонатальная транзиторная гипогликемия сохраняется обычно не более 2-3 суток.
-
Дети, матери которых страдают сахарным диабетом.
У таких детей транзитная гиперинсулинемия наблюдается особенно часто. Преходящий сахарный диабет во время беременности (гестационный диабет) развивается у 2 % женщин, а частота инсулинзависимого сахарного диабета среди беременных составляет примерно 1:1000. Дети при этом рождаются крупными с полнокровным лицом и большими запасами гликогена, белка и жира.
Гипогликемия в таких случаях обусловлена главным образом гиперинсулинемией и отчасти сниженной секрецией глюкагона. Островки поджелудочной железы гипертрофированы и гиперплазированы. Ответ инсулина на глюкозу (в отличие от новорожденных от здоровых матерей) быстрый двухфазный, как у взрослых. Выброс глюкагона сразу после рождения ниже нормы, секреция глюкагона слабее отвечает на стимуляцию. Повышенная активность адренергической системы может привести к истощению мозгового вещества надпочечников, что проявляется снижением экскреции адреналина с мочой. Вместо наблюдаемого в норме низкого уровня инсулина и высокого содержания глюкагона и катехоламинов в плазме у таких новорожденных отмечаются высокий уровень инсулина и низкая концентрация глюкагона и адреналина. Это тормозит эндогенную продукцию глюкозы и способствует развитию гипогликемии.
Гиперинсулинемия с соответствующими внешними проявлениями (макросомия) наблюдается и при гемолитической болезни плода. Причина гиперинсулинемии в таких случаях остается неясной.
Женщины, у которых сахарный диабет во время беременности и родов хорошо компенсирован, обычно рожают детей практически нормальных роста и массы тела, неонатальная гипогликемия и другие осложнения (ранее считавшиеся неизбежными) в таких случаях менее вероятны. При введении глюкозы детям с гипогликемией в этих случаях важно не переусердствовать, поскольку гипергликемия, вызывая резкий выброс инсулина, может спровоцировать новый приступ гипогликемии. При необходимости глюкозу вводят длительно со скоростью 4-8 мг/кг/мин, тщательно подбирая дозу для каждого ребенка. Крайне важно устранять гипергликемию у матери во время родов, так как это, приводя к гипергликемии у плода, способствует развитию у него гипогликемии при внезапном прекращении поступления глюкозы от матери. При гипогликемии, сохраняющейся или возникающей после 1-недельного возраста, необходимо выяснять ее причины.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания









Комментарии