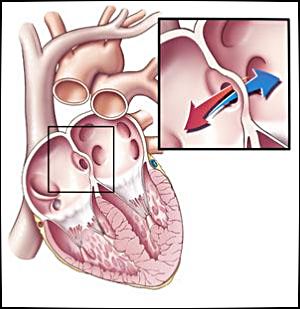
Дефект аортолегочной перегородки (аортолегочное окно)
Аортолегочное окно (дефект аортолегочной перегородки) впервые описано Elliotson в 1830 г. Первый прижизненный диагноз был поставлен Dadds и Hoyle. Этот редкий порок характеризуется наличием отверстия между прилежащими частями восходящей аорты и легочного ствола или правой легочной артерией. Эта аномалия принципиально отличается от V аортальной дуги, которая также отходит от восходящей аорты проксимальнее брахиоцефальных артерий, однако является сосудом, имеющим определенную длину. Некоторые специалисты отмечают схожесть с общим артериальным стволом, распложенным в том же месте. Однако эти две аномалии патогенетически не связаны.
Форма и размер аортолегочного окна различны, отверстие всегда расположено в стенке аорты выше синусов. Эта аномалия однозначно отличается от ОАП, хотя по клиническим признакам и гемодинамике они очень похожи, что иногда приводит к диагностическим ошибкам.
Аортолегочное окно может быть изолированным и сочетаться с различными пороками сердца. Широкое распространение получило другое название порока – «дефект аортолегочной перегородки», которое не соответствует сути этой аномалии, так как перегородка между артериальными стволами отсутствует или она очень мала.
Частота
Согласно данным Kutsche и Van Mierop, среди 6522 детей с ВПС аортолегочное окно было диагностировано в 13 случаях. По совокупным данным New England Regional Infant Cardiac Program, среди 2251 младенцев только у 7 обнаружено аортолегочное окно. У 2 из них этот порок был изолированным, у 3 – сочетался с перерывом дуги аорты, у 1 – с коарктацией аорты и у 1 – с тетрадой Фалло.
Эмбриология
Аортолегочная перегородка формируется двумя противолежащими подушечками трункуса, которые появляются уже на стадии зародыша размером 9 мм и затем быстро увеличиваются и срастаются, разделяя артериальный трункус на отдельные аортальный и легочный каналы. В разделении принимают участие клетки, которые мигрируют из неврального гребня. Удаление ткани неврального гребня приводит к различным аномалиям артерий, включая ОАС, ТМА и перерыв аорты. Однако при удалении неврального гребня аортолегочное окно не образуется. Кроме того, в отличие от ОАС, синдром Di George никогда не сочетается с аортолегочным окном. Если общий артериальный ствол сочетается с перерывом дуги типа В, то при аортолегочном окне наблюдается перерыв дуги аорты типа А. Хотя эти аномалии находятся в одной области сердца, эмбриологически они не связаны и не являются вариантами одной и той же патологии.
Согласно наиболее ранним представлениям о морфогенезе этого порока, аортолегочное окно образуется вследствие прекращения роста аортолегочной перегородки. В дальнейшем стало ясно, что происхождение различных анатомических типов порока неодинаково. Kutsche и Van Mierop выделили три типа аортолегочного окна:
-
дефект с относительно круглыми краями, расположенный между полулунными клапанами и бифуркацией легочного ствола;
-
такой же локализации фенестрация, при которой края имеют спиралеобразную ориентацию;
-
большой дефект без заднего или дистального края.
Первый тип образуется в результате несращения эмбриональной аортолегочной перегородки и перегородки трункуса. Второй тип возникает вследствие отсутствия соосности этих перегородок. Третий тип является следствием полного отсутствия эмбриональной аортолегочной перегородки.
Анатомия и классификация
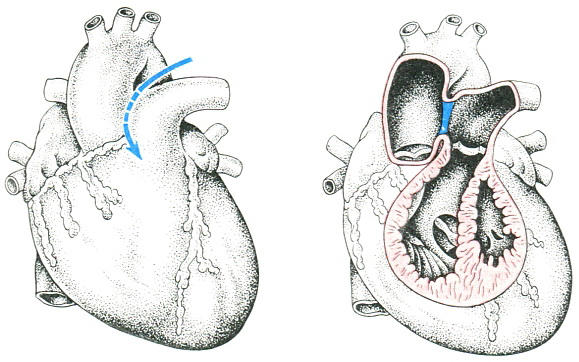
Признаком, отличающим аортолегочное окно от общего артериального ствола, является наличие двух колец аортального и легочного клапанов и сформированных выводных отделов соответствующих желудочков.
Различают два варианта дефекта:
-
Первый, так называемый дуктообразный дефект, напоминает ОАП, так как имеет некоторую протяженность с хорошо выраженными верхним и нижним полюсами.
-
Другой вариант представлен отверстием округлой или овальной формы в виде окна, не имеющего протяженности. Верхний и нижний полюса дефекта в этом случае не выражены.
Аортолегочное окно может располагаться проксимально, близко к синусам Вальсальвы, может занимать промежуточное и дистальное положение. Возможно слияние всех вариантов локализации в одно большое аортолегочное сообщение. Расстояние от нижнего края дефекта до устьев коронарных артерий и уровня полулунных клапанов колеблется от 1 до 20 мм. Дистальный тип встречается у 65% больных и почти в половине случаев сочетается с отхождением правой легочной артерии от аорты.
Размеры дефектов колеблются в достаточно широких пределах – от 2 до 60 мм. Дефекты диаметром до 5 мм, как правило, имеют дуктообразный вид. Чаще встречаются дефекты в виде окна, размеры которых составляют 12-25 мм. При полном отсутствии аортолегочной перегородки размер дефекта соответствует расстоянию от полулунных клапанов до дуги аорты. Описан единичный случай наличия двух дефектов аортолегочной перегородки.
Вследствие большой объемной перегрузки левое предсердие и левый желудочек обычно расширены. Восходящая аорта узкая, особенно при проксимальном дефекте и при аномалиях дуги аорты.
Относительно малое количество наблюдений у отдельных авторов, использование публикаций, а также разнообразие анатомических вариантов порока создают определенные трудности в систематизации патологии и объясняют наличие множества классификаций, описывающих анатомические детали. Попытки создания исчерпывающей классификации имеют больше теоретическое, а не практическое значение. Достаточно сказать, что первая классификация Collet и Edwards, основанная на анализе 116 случаев, содержит 5 типов и 19 подтипов порока. Классификация Бураковского и соавторов также содержит 5 типов. Наиболее популярной является классификация Mori и соавторов, выделивших 3 типа аортолегочного окна:
-
наиболее частый тип I представлен небольшим дефектом посередине между полулунными клапанами и бифуркацией легочной артерии;
-
тип II – более дистальный дефект, верхним краем которого является бифуркация легочной артерии, этот тип часто сопровождается отхождением правой легочной артерии от аорты;
-
тип III представляет собой большой дефект, занимающий всю аортолегочную перегородку, встречается крайне редко.
Более чем в половине случаев, аортолегочное окно сочетается с другими пороками сердца. Разнообразие сопутствующей патологии сердца не поддается выявлению какой-либо закономерности. Наиболее типичным является тип А перерыва дуги аорты или тяжелая предуктальная коарктация аорты, что позволяет включить этот тип в упрощенную классификацию порока.
С разной частотой пороку сопутствуют аномальное отхождение одной или обеих коронарных артерий от легочного ствола, правой легочной артерии от восходящей аорты, тетрада Фалло, двустворчатый аортальный клапан, ДМЖП, атрезия легочной артерии с ДМЖП, трехпредсердное сердце. Нередки сочетания с ОАП. У пациентов с аортолегочным окном и перерывом дуги аорты изредка встречается атрезия аорты. Очевидно, что ОАП сопутствует перерыву дуги аорты. Описан казуистический случай обнаружения аномального отхождения огибающей артерии от легочного ствола через много лет после коррекции аортолегочного окна. Известно сочетание полной ТМА с большим аортолегочным сообщением. При этом пороке обнаруживали двойную дугу аорты. В перечне сопутствующих пороков – клапанный и инфундибулярный стеноз легочной артерии, отхождение обоих магистральных сосудов от правого желудочка. В клинической практике встречались также сложные комбинации нескольких врожденных аномалий – отхождение левой коронарной артерии от легочного ствола у больного с тетрадой Фалло и аортолегочным окном, сочетание аортолегочного окна с V дугой аорты, дискордантным желудочко-артериальным соединением, атрезией легочной артерии, правосторонней дугой и коарктацией аорты.
У каждого третьего ребенка отмечается разнообразная экстракардиальная патология.
Гемодинамика
Аортолегочное окно относится к ВПС с увеличенным легочным кровотоком. Внутрисердечная гемодинамика соответствует таковой при ОАП и ДМЖП. Выраженность гемодинамических нарушений определяется размерами отверстия и соотношением общелегочного и периферического сопротивлений. При малых размерах окна объем сброса крови из аорты в легочную артерию невелик и давление в легочной артерии может быть нормальным. У пациентов с большими размерами окна уже в раннем возрасте отмечается высокая легочная гипертензия.
Изменения гемодинамики при большом окне носят стадийный характер. В первые часы и дни после рождения сохраняется высокое сопротивление легочных сосудов, поэтому большого перетока крови из аорты в легочную артерию нет. По мере снижения сопротивления увеличивается лево-правый сброс, легочный кровоток значительно возрастает, развивается застойная сердечная недостаточность по левожелудочковому типу. Проявлениями сердечной недостаточности являются отек легких с хрипами разного калибра и частыми продолжительными пневмониями. В отличие от левого желудочка правый желудочек не подвергается нагрузке увеличенным объемом крови, поскольку сброс крови происходит дистальнее, на уровне магистральных сосудов. В связи с легочной гипертензией правый желудочек преодолевает систолическую нагрузку.
В ответ на гиперволемию происходит рефлекторный спазм легочных резистивных сосудов, который является мощным компенсаторным механизмом, защищающим полупроницаемое капиллярное русло от переполнения и снижающим предрасположенность к отеку легких. Однако длительное повышение тонуса гладкой мускулатуры прекапиллярных сосудов включает следующий этап компенсаторных реакций, направленных на структурную фиксацию просвета легочных сосудов, которая получила название «обструктивная болезнь легочных сосудов», или их склероз.
Повышение ЛСС приводит к уменьшению сброса крови и снижению объемной перегрузки левых отделов сердца. Когда ЛСС становится равным системному или превышает его, возникает перекрестный, а затем и обратный сброс крови через окно.
Появление склеротических изменений в сосудах малого круга кровообращения при аортолегочном окне может быть зафиксировано в очень раннем возрасте – уже в 7 мес. Однако у новорожденных и младенцев необратимых изменений в легочных сосудах, как правило, не происходит, что подтверждает снижение давления в легочной артерии после хирургического закрытия дефекта. Необратимые изменения легочных сосудов с реверсией шунта постепенно развиваются к юношескому возрасту. Таким образом, при больших дефектах аортолегочной перегородки можно наблюдать 3 типа реакций легочных артерий на массивный сброс крови из восходящей аорты в легочный ствол:
-
I тип – нормальная или несколько замедленная физиологическая инволюция легочных сосудов после рождения ребенка с постепенным снижением ЛСС и нарастанием объема сброса с развитием гиперволемической формы легочной гипертензии;
-
II тип – рефлекторный спазм легочных сосудов с развитием смешанной формы легочной гипертензии и несколько меньшим, чем при I типе, объемом артериального сброса крови;
-
III тип – отсутствие при рождении ребенка физиологической инволюции легочных сосудов с развитием врожденной формы обструктивной болезни легочных сосудов.
Каждый тип реакции легочных сосудов, очевидно, зависит от индивидуальной чувствительности легочно-сосудистого русла больного к массивному притоку крови. При I типе реакции легочных сосудов микроструктурные изменения в артериальном русле легких можно ожидать сравнительно поздно, в юношеском и более старшем возрасте. При II типе изменения в стенках легочных артерий развиваются раньше и поэтому даже у детей в возрасте до 2 лет можно наблюдать остаточную легочную гипертензию после коррекции, связанную с обструктивными изменениями легочных сосудов. При III типе после рождения сохраняется внутриутробный тип строения легочных сосудов, который отражается на характере гемодинамики и естественном течении порока.
Клиника аортолегочного окна
Клинические признаки аортолегочного окна неспецифичны и соответствуют таковым при большом лево-правом шунте, напоминая ДМЖП или ОАП. В первые недели жизни проявляются признаки застойной сердечной недостаточности, такие, как одышка, потливость, тахикардия, рецидивирущие респираторные заболевания. Цианоза обычно нет, хотя большие дефекты могут быть причиной системной десатурации, связанной с перекрестным шунтированием и смешиванием крови на артериальном уровне. При сопутствующем перерыве дуги аорты могут возникнуть циркуляторный шок и метаболический ацидоз вследствие сужения или закрытия боталлова протока. Это тяжелое состояние может маскировать наличие аортолегочного окна.
Наиболее ранним и характерным симптомом является одышка с участием абдоминального и грудного дыхания с втяжением межреберных промежутков. Отмечается приподнимающий верхушечный толчок. Пульсовое давление увеличено вследствие утечки артериальной крови в легкие. При аускультации II тон акцентуирован с узким расщеплением, что отражает наличие легочной гипертензии. У некоторых больных слышен щелчок выброса над легочной артерией. Определяется громкий систолический шум выброса 3/6-4/6 степени интенсивности по шкале Lewine над всей областью сердца с эпицентром во II-IV межреберьях по левому краю грудины или непрерывный машинный шум, как при ОАП. Максимальное звучание систолодиастолического шума при небольшом аортолегочном окне выслушивается несколько ниже, чем при боталловом протоке. Типичный машинный шум, который считается специфическим для ОАП, при аортолегочном окне встречается в 9-15% случаев. При значительно увеличенном легочном кровотоке на верхушке может определяться III тон и короткий мезодиастолический шум относительного митрального стеноза как проявление увеличенного кровотока через митральный клапан.
Повышение сопротивления легочных сосудов, которое влияет на величину и направление сброса крови, отражается на аускультативной картине. В этих случаях отсутствует систолодиастолический шум, шумов в области сердца может не быть совсем или определяется диастолический шум недостаточности клапана легочной артерии Грэма Стилла.
Характерных электрокардиографических находок при этом пороке нет. Обычно имеются признаки гипертрофии правого желудочка. При большом окне отмечается гипертрофия обоих желудочков, которая может проявиться не сразу после рождения.
Рентгенологическая картина более информативна для оценки степени гемодинамических нарушений, чем для диагностики самого порока. Сердце умеренно расширено, легочная артерия выбухает, выступают края левого предсердия и левого желудочка. Дуга восходящей аорта не выдается. Легкие отечны, легочный рисунок усилен.
Двухмерная ЭхоКГ позволяет точно диагностировать аортолегочное окно и сопутствующие аномалии. Левое предсердие и левый желудочек дилатированы, правый желудочек может быть гипертрофированным, но не всегда. Расположение и функция полулунных клапанов обычно нормальные. Легочные артерии значительно расширены. Аортолегочное окно обычно хорошо видно, однако в этой области у здоровых пациентов может наблюдаться «выпадение». Описан «Т»-артефакт на краях дефекта, помогающий отличить его от нормального «выпадения». Кроме того, допплер-ЭхоКГ может обнаружить поток через дефект. Аномальный постоянный однонаправленный ток в легочные артерии указывает на наличие аортолегочного окна и позволяет отличить его от ОАП. В брюшной аорте можно обнаружить ретроградный диастолический ток крови в нисходящую аорту. При наличии недостаточности легочного или трехстворчатого клапана с помощью допплер-ЭхоКГ можно диагностировать легочную гипертензию.
Катетеризация сердца в условиях современной эхокардиографической техники не является абсолютно необходимой. Наличие аортолегочного окна можно заподозрить во время катетеризации при прохождении катетера из легочного ствола в восходящую аорту через сообщение между ними. При этом пороке его ход отличается от маршрута катетера, проведенного через ОАП. Разница состоит в том, что в последнем случае катетер, проведенный через артериальный проток, поступает в нисходящую аорту, минуя восходящий отдел и дугу и описывает при этом характерную фигуру. Значительно реже катетер проходит в дугу и левую сонную артерию. При аортолегочном окне катетер направляется из легочного ствола в проксимальный отдел восходящей аорты к ее клапанам или в дистальную часть восходящей аорты по направлению к дуге. Еще одним дифференциально-диагностическим признаком является более медиальное положение в прямой проекции и переднее – в боковой проекции катетера, проведенного через аортолегочное окно, по сравнению катетером, проведенным в аорту через ОАП.
У пациентов с клиникой сердечной недостаточности давление в правом желудочке и в легочной артерии обычно равно системному. Давление в левом предсердии повышено из-за лево-правого сброса и увеличенного легочного венозного возврата. Систолическое давление в левом желудочке нормальное. Давление в аорте обычно соответствует норме, но при наличии большого дефекта диастолическое давление снижено, а пульсовое – увеличено из-за утечки крови в легочное сосудистое русло.
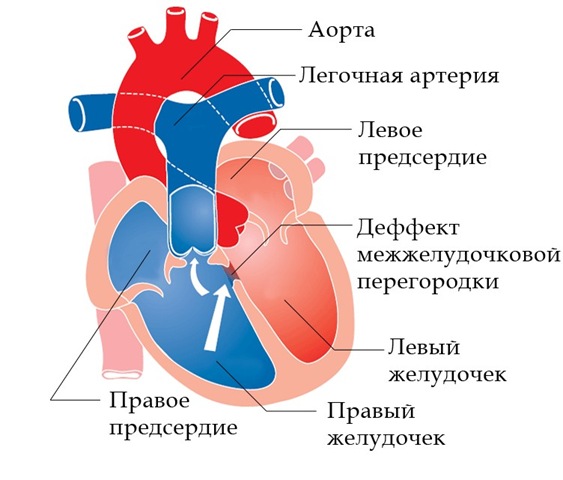
Насыщение крови кислородом в полостях сердца и магистральных сосудах может быть использовано для дифференциальной диагностики с ДМЖП. При ДМЖП скачок оксигенации регистрируется на уровне желудочков, а при аортолегочном окне – на уровне магистральных сосудов. Этот метод не позволяет дифференцировать аортолегочное окно от боталлова протока. Однако у больных с обратным, венозно-артериальным, сбросом крови разницу между этими пороками можно определить. При аортолегочном окне степень гипоксемии в плечевой и бедренной артериях одинакова, поскольку сброс крови происходит проксимальнее отхождения подключичных артерий. При ОАП артериальная гипоксемия более выражена в бедренной артерии, чем в артериях верхних конечностях, поскольку сброс крови справа налево происходит дистальнее дуги аорты.
Впервые аортография в диагностике порока была использована Gasul и соавторами в 1951 г. Наиболее информативной является передне-задняя проекция. При введении контрастного вещества в восходящую аорту заполняются легочные артерии, включая синусы клапана, ствол и ветви. Аортография позволяет также диагностировать сопутствующие аномалии дуги аорты. При выполнении ангиографии легочного ствола заполняется восходящая аорта и можно диагностировать аномальное отхождение коронарной артерии от легочной артерии. Большие диагностические трудности возникают при проведении дифференциального диагноза большого аортолегочного окна с общим артериальным стволом, так как при аортографии наблюдается аналогичная картина в виде единого широкого сосуда, который дает начало брахиоцефальным и легочным артериям. Ключом к правильному диагнозу является наличие сформированных колец аортального и легочного клапанов. Правая вентрикулография позволяет установить наличие выводного отдела правого желудочка, а также отдельно сформированного «кольца» легочного клапана.
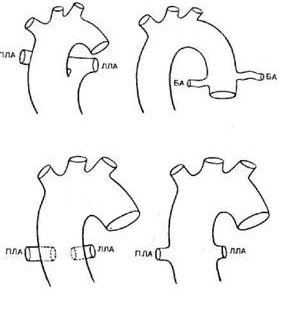
Дифференциальный диагноз
Поскольку аортолегочное окно является редким пороком, клинические проявления часто предписываются большому ДМЖП, ОАП и общему артериальному стволу. Высокий пульс, увеличенное пульсовое давление и непрерывный шум указывают на наличие межартериального сообщения. Отличить аортолегочное окно от каждого порока из этой группы чрезвычайно трудно методами физикального исследования. Однако важнейшие клинические симптомы в первые недели жизни различны. У пациентов с общим артериальным стволом более выражено снижение артериального насыщения, чем у больных с аортолегочным окном, поскольку при общем стволе происходит более полное смешивание крови. Эпицентр шума ДМЖП обычно слышен вдоль нижнего левого края грудины, и характеристики пульса обычны.
Естественное течение и показания к операциям
В литературе практически отсутствуют данные о дородовой диагностике аортолегочного окна. Время обращения за кардиохирургической помощью зависит от размера окна и наличия сочетанных аномалий. Дети с сопутствующим перерывом дуги аорты или с тяжелой предуктальной коарктацией нуждаются в безотлагательной помощи в неонатальном периоде из-за угрозы закрытия артериального протока. Только в 10% случаев окно небольших размеров и течение порока соответствует таковому при обычном артериальном протоке. Поскольку у большинства пациентов дефект имеет средние или большие размеры, состояние больных резко ухудшается в течение первого месяца жизни, как только снижается сопротивление легочных сосудов. На протяжении первого года жизни 25-30% больных с этим пороком умирают от левожелудочковой недостаточности и застойной пневмонии. Около 15% больных умирают в школьном возрасте, а половина живут несколько дольше. Среди пациентов, переживших детский и юношеский возраст, немногие доживают до 30-40 лет. В качестве казуистики описан 8-летний больной с обструкцией легочных сосудов, как и у всех подростков и взрослых.
Большинство пациентов должны быть прооперированы в возрасте не старше 6-12 мес., а при дуктусзависимых сопутствующих пороках – в неонатальном периоде.
Хирургическое лечение
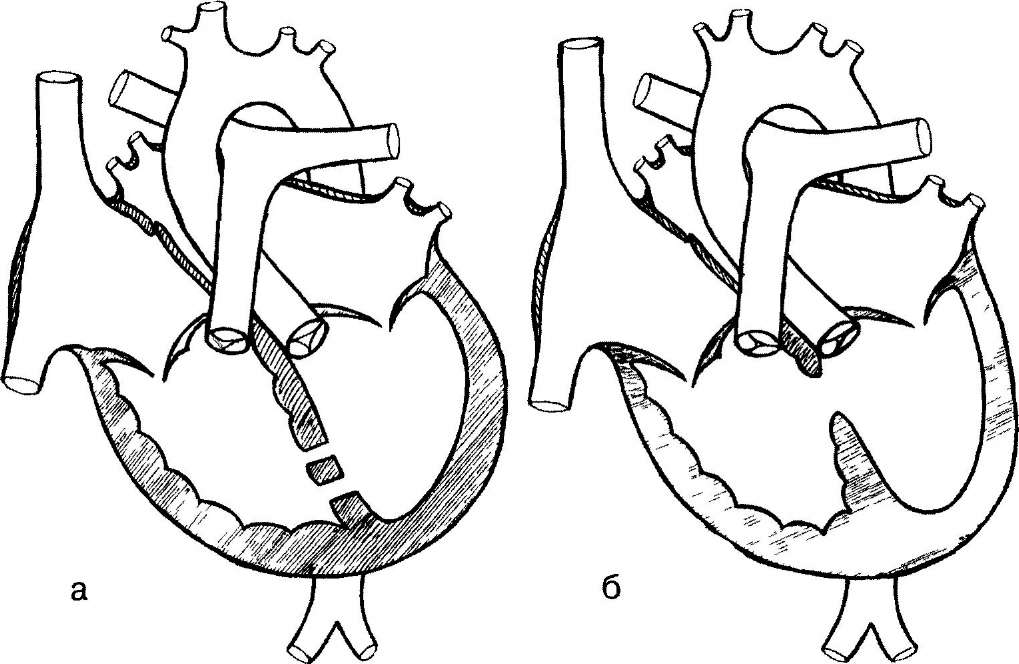
Прошло более половины столетия с 1952 г., когда Gross из детского госпиталя в Бостоне впервые перевязал аортолегочное окно. История хирургического лечения этого порока и ранний опыт нашего института продемонстрировали ошибочность попыток консервативной техники, а именно перевязи и прошивания дефекта П-образными швами. Практически все авторы указывают, что обычное лигирование можно выполнять в редких случаях, когда сообщение невелико. Условиями для такой операции являются расположение сообщения в средней части аортолегочной перегородки и достаточное расстояние от клапанов магистральных артерий и левой коронарной артерии, выраженность и хорошая доступность его верхнего и нижнего полюсов. В противном случае неизбежны такие осложнения, как сужение восходящей аорты и легочного ствола, повреждение полулунных клапанов, захват в лигатуру или сужение левой коронарной артерии, которая часто проходит вблизи нижнего края дефекта. Опасность представляет также отхождение коронарной артерии высоко от области дефекта. В литературе сообщают о тяжелых кровотечениях при повреждении во время выделения нежной задней стенки окна. Одним из осложнений является неполное закрытие просвета. В последние годы нам неоднократно приходилось выполнять реоперации в условиях искусственного кровообращения для устранения остаточного шунта. Более рискованная закрытая техника предусматривает рассечение между зажимами и отдельное ушивание аортального и легочного отверстий.
Следующим историческим этапом развития хирургической техники является закрытие дефекта на временно выключенном из кровообращения сердце в условиях поверхностной гипотермии при 30-32 0С. Впервые ушивание дефекта аортолегочного окна таким способом выполнили Shumway и Lewis в 1956 г. доступом через разрез легочного ствола. Этот метод не нашел последователей, так как уже начиналась эра искусственного кровообращения, дающая возможность неспешной аккуратной коррекции. Начало закрытию дефектов в условиях искусственного кровообращения положил в 1957 г. Cooley, который успешно оперировал троих больных, выполнив рассечение сообщения между аортой и легочным стволом с последующим ушиванием обоих концов.
В нынешнюю хирургическую эру операции выполняют в условиях искусственного кровообращения и гипотермии с использованием срединного доступа. Хотя закрытие дефекта заплатой возможно со стороны легочной артерии, этот доступ не обеспечивает хорошей экспозиции устьев коронарных артерий, поэтому большинство хирургов рекомендуют чрезаортальный доступ. Эта техника обеспечивает максимальную экспозицию дефекта и позволяет провести коррекцию сопутствующих пороков, в частности, аномалии дуги и аномалию отхождения правой легочной артерии или правой коронарной артерии. У больных с отхождением правой легочной артерии от аорты заплатой, закрывающей окно, создают туннель по задней стенке аорты для соединения правой ветви с легочным стволом.
Некоторые хирурги пользуются двумя заплатами, которыми закрывают отдельно аорту и легочный ствол. Это удобно у очень маленьких детей. Johansson и соавторы в 1978 г. предложили методику закрытия больших дефектов, согласно которой рассекают переднюю стенку аортолегочной перегородки и через этот доступ заплату пришивают к задней стенке окна. Когда линия швов достигает углов разреза, двумя концами нити начинают прошивать заплату, одновременно захватывая края рассеченной стенки аортолегочного окна. Этот метод позволяет сократить время пережатия аорты и предупредить некоторые осложнения длительного искусственного кровообращения.
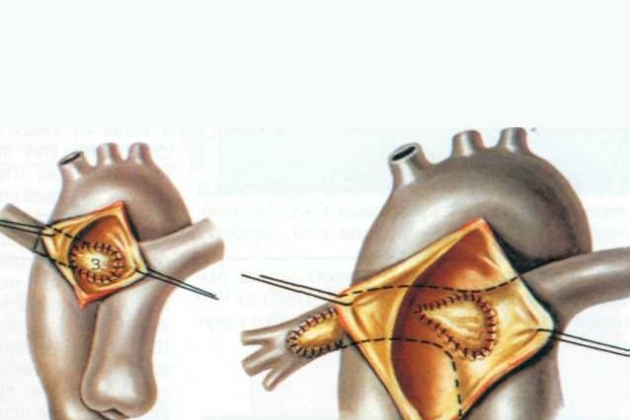
Техника закрытия простого аортолегочного окна
Доступ через срединную стернотомию с субтотальной резекцией вилочковой железы. Иссекают лоскут перикарда и обрабатывают его 6% раствором глютаральдегида в течение 20-30 мин. При наружном исследовании подтверждают диагноз. Убеждаются в наличии двух полулунных клапанов, обращают внимание на расположение устьев коронарных артерий. Наружная препаровка магистральных артерий малоинформативна и поэтому нецелесообразна.
После гепаринизации канюлируют аорту около устья безымянной артерии и правое предсердие одним венозным катетером. С началом искусственного кровообращения пережимают ветви легочной артерии турникетами. Операцию можно выполнить в условиях постоянной перфузии и умеренной гипотермии. У особенно маленьких детей при необходимости может быть полезной остановка кровообращения при глубокой гипотермии, что позволяет хирургу снять зажим с аорты для улучшения экспозиции и уменьшения искривления магистральных сосудов.
Пережимают аорту и вводят в корень кардиоплегический раствор. На этом этапе турникеты на ветвях легочной артерии можно удалить.
Доступ через переднюю стенку восходящей аорты обеспечивает хорошую экспозицию аортолегочного окна, устья левой коронарной артерии и правой легочной артерии, если она отходит от аорты. Пластика дефекта из этого доступа позволяет при фиксации заплаты надежно отойти от устья коронарной артерии. Из этого доступа можно также с помощью перикардиальной заплаты сконструировать внутриаортальный туннель для соединения отходящей от аорты правой легочной артерии с легочным стволом, одновременно закрывая аортолегочное окно. Однако эту технику нельзя применять у новорожденных и в раннем грудничковом возрасте.
У младенцев и новорожденных аорту отсекают от легочного ствола. Аортолегочное сообщение сначала надсекают по передней полуокружности.
Через отверстие в аорте убеждаются в нормальной локализации устьев коронарных артерий и полностью отсекают аорту от легочного ствола. Образовавшееся в аорте отверстие закрывают заплатой из аутоперикарда, используя непрерывный проленовый шов 6/0 у новорожденных и маленьких грудных детей. Аорта может быть открыта на этом этапе, однако удобнее оставить зажим до полного закрытия дефекта в легочном стволе, так как сердце начнет нагнетать кровь в легочную артерию, ухудшая условия для аккуратного выполнения шва. Линия шва проходит очень близко к легочному клапану. Следует быть очень осмотрительным, чтобы не захватить в шов тонкие створки клапана. Эвакуируют воздух обычным способом, снимают зажим с аорты и оставляют отверстие в ней для удаления остаточных пузырьков воздуха.
Техника операции, предложенная Johansson и соавторами, удобна у более старших детей или при большом аортолегочном окне. Рассекают передний край аортолегочного окна. Длина разреза равна 1/3-1/2 окружности окна. Внутри просвета идентифицируют устья коронарных артерий. Если устье находится близко или внутри просвета легочной артерии, заплата должна быть пришита таким образом, чтобы отвести коронарную артерию в аорту. Иногда возникает необходимость иссечь «пуговицу» с устьем коронарной артерии и переместить ее в надлежащее место. Для закрытия окна используют синтетическую заплату, которую вначале пришивают к задней стенке окна. Передний край заплаты фиксируют между стенками аорты и легочной артерии.
Техника коррекции аортолегочного окна с перерывом дуги аорты
Большое аортолегочное окно внешне выглядит как полное отсутствие перегородки между аортой и легочным стволом. Правая легочная артерия может отходить от правого бокового или заднебокового края аорты. Коррекция этого морфологического комплекса аналогична операции при общем артериальном стволе с перерывом дуги аорты. Аорту канюлируют у основания безымянной артерии. Одной канюлей дренируют венозную кровь правого предсердия. Сразу после начала перфузии затягивают турникеты вокруг ветвей легочной артерии. Кровь из артериальной канюли поступает в плечеголовные сосуды и через аортолегочное окно в легочный ствол и далее через артериальный проток в нисходящую аорту. Ребенка охлаждают до 18 0С.
При типе А перерыва дуги аорты анастомоз нисходящей аорты с дугой можно выполнить, не останавливая кровообращение. Пережимают нисходящую аорту и проток на его легочном конце. Проток пересекают и ушивают. Нисходящую аорту освобождают от остатков ткани боталлова протока и анастомозируют с продольным разрезом по нижней кривизне дуги. Перед выполнением этого анастомоза пережимают проксимальную часть дуги аорты между безымянной и левой общей сонной артериями. Перфузия мозга осуществляется через безымянную артерию со сниженной объемной скоростью 20 мл/ кг/мин. После завершения реконструкции дуги аорты снимают оба зажима. Затем зажим накладывают на аорту ниже артериальной канюли, что позволяет перфузировать все тело, за исключением сердца. Вводят кардиоплегический раствор в корень аорты. Турникеты вокруг обеих ветвей легочной артерии могут быть удалены.
Поперечным разрезом открывают восходящую аорту на уровне правой легочной артерии. Внутри аорты с помощью заплаты из аутоперикарда формируют туннель таким образом, чтобы направить кровь из легочного ствола в правую ветвь по задней стенке восходящей аорты.
Разрез передней стенки восходящей аорты целесообразно закрыть заплатой. У детей с малой массой тела следует избегать внутриаортального туннелирования, так как с ростом ребенка может развиться надклапанный стеноз аорты. Для этих случаев можно использовать альтернативный метод. Широко выделяют правую легочную артерию, как это делают при операции артериального переключения. Восходящую аорту пересекают выше и ниже уровня правой легочной артерии. Стенки образовавшегося лоскута сшивают продольно с двух сторон в трубку, таким способом удлиняя правую легочную артерию. Трубку анастомозируют с правой стороной легочного ствола на уровне аортолегочного окна. После хорошей мобилизации проксимальный и дистальный концы пересеченной аорты реанастомозируют. Операцию завершают пластикой перикардом окна в легочной артерии.
Коррекция аортолегочного окна при типе В перерыва дуги аорты или гипоплазии дуги предусматривает гипотермическую остановку кровообращения. После охлаждения до 18 0С при пережатых легочных артериях артериальный насос останавливают, пережимают аорту, вводят кардиоплегический раствор в корень аорты. Сосуды дуги перекрывают турникетами. Затем открывают зажим на аорте и удаляют аортальную канюлю. Альтернативой полной остановке кровообращения может быть перфузия мозга с низкой объемной скоростью через канюлю, введенную непосредственно в безымянную артерию. Скальпелем и ножницами разделяют аорту и легочный ствол, обращая внимание на локализацию устья коронарной артерии. Артериальный проток перевязывают у легочного конца и ушивают. Отверстие в легочной артерии закрывают заплатой из аутоперикарда. Отверстие в аорте увеличивают, рассекая дугу до левой сонной артерии или до левой подключичной артерии.
Нисходящую аорту анастомозируют с дугой, при необходимости расширяя ее заплатой из гомографта. Дугу наполняют солевым раствором и реканюлируют аорту. Восстанавливают искусственное кровообращение и согревают ребенка.
Результаты
Если коррекция изолированного аортолегочного окна выполнена до развития значительных изменений легочных сосудов, результаты операции отличные. Вмешательства более рискованны при тяжелых сопутствующих аномалиях, таких, как отхождение правой легочной артерии от восходящей аорты, перерыв дуги аорты, аномальное отхождение правой коронарной артерии. В течение последнего десятилетия опубликован ряд достаточно больших серий хирургических результатов у этой сложной категории больных. Pediatric Cardiac Care Consortium представил опыт лечения 26 пациентов, оперированных между 1985 и 1993 годами. Из них 25 детей были младенческого возраста и 1 ребенок – в возрасте 3,2 года. В этой серии только у 3 детей не было сопутствующих аномалий. У всех выполнена операция закрытия окна, с одним летальным исходом.
В другой публикации представлена группа из 24 детей младше 6 мес., со средним возрастом 34 дня. У 12 из них были сопутствующие аномалии, включая перерыв или гипоплазию аорты – у 9 детей, тетраду Фалло – у 2, транспозицию – у 1 ребенка. Среди 12 детей с неосложненным пороком летальных исходов не было в раннем и отдаленном периоде. В группе больных с сопутствующими пороками из 12 детей в раннем периоде умерли 4 и в отдаленном – 1 ребенок. Большинство выживших подвергнуты или нуждаются в повторных вмешательствах по поводу обструкции дуги аорты.
Бостонский детский госпиталь представил опыт операций 38 детей, оперированных между 1975 и 1999 годами. Средний возраст детей на момент операции – 5 нед, средняя масса тела – 3,9 кг. Сопутствующие аномалии имели место у 25 детей, из них у 7 – перерыв дуги аорты, у 7 – тетрада Фалло, у 5 – ДМЖП, у 3 – единственный желудочек, у 3 детей – коарктация аорты и у 1 ребенка – аномальное отхождение коронарной артерии. Трое детей умерли в госпитальном периоде. Актуарная выживаемость в течение 10 лет составила 88%. Трое пациентов нуждались в повторных операциях по поводу сужения магистральных артерий. В этой серии были использованы 3 доступа:
-
через аортотомию – у 45% больных;
-
через разрез дефекта – у 31%;
-
через легочную артерию – у 24%.
У 30 больных использована одна заплата, у 4 произведено прямое ушивание и у 3 – две заплаты. Авторы отмечают, что закрытие дефекта через легочную артерию сопровождается большим риском реопераций. Аналогичные результаты получены другими авторами.
Имеются сообщения о закрытии транскатетерной техникой небольших аортолегочных окон и остаточных межартериальных дефектов. Пока неясно, существует ли риск перекрытия устья коронарной артерии, однако его нельзя исключить.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания










Комментарии