Анастомоз легочной артерии. Кавопульмональный анастомоз. Техника выполнения операции
Для обеспечения адекватного легочного кровотока применяют системно-легочный анастомоз. Основной задачей этого вмешательства является создание адекватного, но не избыточного легочного кровотока при условии исключения деформаций легочных артерий. Наиболее подходящим является модифицированный подключично-легочный анастомоз по Blalock-Taussig с применением сосудистого протеза из политетрафлюороэтилена диаметром 3,5-4 мм. Он может быть выполнен как через боковую торакотомию, так и через срединный доступ.
Техника наложения модифицированного анастомоза по Blalock-Taussig через боковую торакотомию относительно проста. При выборе стороны торакотомии используют общее правило. Предпочтение отдают стороне, на которой расположена ВПВ. Однако если легочный кровоток у ребенка зависит от функции ОАП, то при выборе стороны торакотомии следует учитывать расположение ОАП. Проток не может быть закрыт до тех пор, пока не будет наложен анастомоз. Проток мешает наложить анастомоз более проксимально для удобства его устранения во время последующих хирургических вмешательств, поэтому подключично-легочное соустье лучше накладывать на стороне, противоположной расположению ОАП.
Некоторые хирурги предпочитают накладывать подключично-легочный анастомоз со срединного доступа. Формирование шунта через этот доступ позволяет легко подключить искусственное кровообращение, если возникает такая необходимость, а также исключает образование коллатерального кровообращения, которое развивается в результате спаечного процесса в плевральной полости. Образование коллатеральных сосудов ухудшает кровообращение Fontan. В случаях недоразвития легочных артерий более эффективен центральный аорто-легочный анастомоз. Он обеспечивает равномерный двусторонний поток крови в легочные артерии, что способствует увеличению их размеров.
Хирургическое лечение пациентов с избыточным легочным кровотоком без обструкции выхода в системный круг кровообращения
Избыточный легочный кровоток приводит к повышению давления в легочной артерии и объемной перегрузке системного желудочка. В результате возникает застойная сердечная недостаточность и развивается обструктивная болезнь легочных артерий.
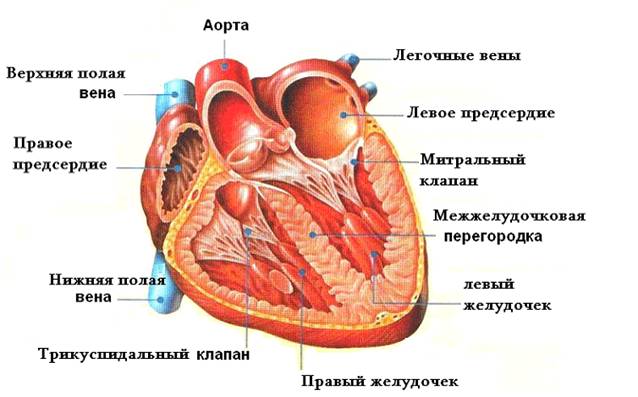
В целях уменьшения кровотока по легочным артериям производят суживание легочного ствола. Это вмешательство можно выполнять из левосторонней торакотомии и со срединного доступа. Из этого доступа удобнее суживать легочный ствол при ТМА.
Самым ответственным моментом операции является выбор целевого диаметра легочного ствола. Для пациентов с одножелудочковым сердцем длина суживающей тесьмы представляет собой сумму чисел: 24 и числа, соответствующего массе тела ребенка. Например, если масса больного 4 кг, то длина тесьмы должна составлять 28 мм. Эта длина обычно является начальной. Дополнительное суживание производят под контролем давления в легочной артерии дистальнее тесьмы. После суживания давление в легочной артерии должно составлять 1/3 системного, а артериальное насыщение кислородом — не ниже 75%. Необходимо учитывать, что эти измерения производят во время наркоза, искусственной вентиляции легких с открытой грудной клеткой.
Хирургическое лечение пациентов с избыточным легочным кровотоком и обструкцией выхода в системный круг кровообращения
Среди больных с избыточным легочным кровотоком часто встречаются случаи препятствия на пути выхода крови в системный круг кровообращения, поэтому помимо уменьшения поступления крови в легочные артерии необходимо обеспечить свободный путь крови в системный круг. Причиной обструкции выводного тракта желудочка могут быть подклапанное или клапанное сужение устья аорты, а также гипоплазия восходящей аорты и дуги.
Наиболее частой причиной подклапанного сужения является малый диаметр бульбовентрикулярного отверстия, через которое кровь из желудочка поступает в выпускную камеру и аорту.
Существуют два способа оперативного лечения этого варианта порока:
-
Первый из них заключается в том, что из желудочка формируют дополнительный выход в системный круг кровообращения через легочный ствол. Для этого последний рассекают поперек и его проксимальный конец подшивают к восходящей аорте. Отверстие дистального конца легочного ствола ушивают, а легочный кровоток обеспечивают за счет системно-легочного анастомоза.
-
Второй подход заключается в иссечении субаортального сужения с одновременным суживанием легочного ствола.
В ряде случаев наблюдаются явные признаки сужения выхода крови в системный круг кровообращения, в других случаях четкие физиологические данные, подтверждающие наличие сужения, отсутствуют. При эхокардиографическом исследовании можно обнаружить сужение субаортального пространства относительно диаметра клапанного кольца.
Matitiau изучил динамику изменения размеров бульбовентрикулярного отверстия в процессе развития ребенка. Он установил, что при увеличении поверхности тела ребенка индекс поперечного сечения бульбовентрикулярного отверстия прогрессивно уменьшается. В тех случаях, когда индекс поперечного сечения бульбовентрикулярного отверстия в неонатальном периоде был меньше чем 2 см2/м2, в последующем всегда развивалось субаортальное сужение, которое требовало его устранения. Эти данные были получены у больных с ЕЖС по левожелудочковому типу с выпускной камерой для аорты и, таким образом, неприменимы при других вариантах функционально единственного желудочка. Тем не менее, этот принцип может быть использован у больных, у которых основная аномалия сочетается с коарктацией аорты или гипоплазий восходящей аорты. В таких случаях наблюдается также некоторое сужение выводного отдела с последующим образованием субаортального стеноза в постнеонатальном периоде, поэтому считается целесообразным произвести устранение этих сужений.
Выбор методики устранения сужений на пути выхода крови в системный круг кровообращения зависит не только от его локализации, но и от расположения магистральных артерий, а также направленности дуги аорты.
У большинства новорожденных субаортальное сужение устраняют путем выполнения процедуры Damus-Kaye-Stansel или ее модификаций. У детей с нормальным расположением магистральных артерий такую операцию выполняют по методике, которая применяется при синдроме гипоплазии левых отделов сердца.
Операцию осуществляют в условиях глубокой гипотермии и полной остановки кровообращения. Канюлируют восходящую аорту и правое предсердие. Если имеется резкое сужение дуги аорты, используют две артериальные канюли. Отдельно канюлируют восходящую аорту и легочный ствол. Из легочного ствола через ОАП перфузируется бассейн нисходящей аорты, а из восходящей аорты — брахиоцефальные сосуды. При канюляции только восходящей аорты выделяют и перевязывают ОАП сразу после начала искусственного кровообращения, чтобы кровь из аорты не поступала в легкие. При использовании двух артериальных канюль под легочные артерии подводят лигатурные петли, которые затягивают в начале перфузии.
Для предотвращения попадания воздуха в сосуды головного мозга во время полной остановки кровообращения лигатурными петлями также пережимают плечеголовные артерии.
После введения кардиоплегического раствора и остановки кровообращения рассекают легочный ствол у самой бифуркации. Отверстие в дистальном конце ствола ушивают непрерывным швом или закрывают аутоперикардиальной заплатой. Использование заплаты позволяет избежать образования деформаций легочных артерий. В случаях, когда канюлируют только восходящую аорту, рассекают легочный ствол и закрывают отверстие в дистальном конце до остановки сердечной деятельности и кровообращения.
Продольным разрезом справа рассекают восходящую аорту в задней ее части. Начинают разрез ниже уровня рассечения легочного ствола. Его направляют вверх и заканчивают в месте отхождения безымянной артерии. Так же продольно рассекают проксимальный конец легочного ствола. Оба разреза анастомозируют между собой непрерывным швом. Оставшиеся свободными часть окружности легочного ствола и разреза аорты соединяют между собой с помощью гомографта. Заплата должна иметь форму полуконуса, длина основания которого должна соответствовать длине оставшейся свободной окружности проксимального конца легочного ствола, а стороны — длине разреза аорты.

При наличии сужения на уровне дуги аорты его расширяют путем вшивания отдельной заплаты. Для этого на боковой стенке восходящей аорты делают второй продольный разрез. Из восходящей аорты его направляют на дугу и дальше на нисходящую часть, ниже расположения ОАП. Очень важно, чтобы обе вшитые заплаты перекрывали друг друга. Это делают в целях предотвращения образования сужения сегмента аорты, расположенного между заплатами. В случаях, когда имеется стеноз или атрезия одного из AV-клапанов, проверяют величину межпредсердного дефекта. Если он небольшой, его расширяют. Операцию завершают наложением модифицированного анастомоза по Blelock-Taussig. Его накладывают после возобновления искусственного кровообращения и удаления воздуха из полостей сердца.
У больных с обструкцией выхода в большой круг кровообращения только на субаортальном уровне можно применить модификации, предусматривающие прямой анастомоз между легочным стволом и восходящей аортой.
Второй способ устранения субаортального сужения заключается в расширении межжелудочкового сообщения с одновременным суживанием легочного ствола. Данный метод более физиологичен. Различия между двумя способами заключаются в том, что после суживания легочного ствола кровь в легкие поступает только во время систолы желудочков, поэтому диастолическое давление остается высоким и коронарный кровоток не уменьшается. У больных с наличием системно-легочного шунтирования после процедуры Damus-Kay-Stansel кровь в легочные артерии поступает как в систолу, так и в диастолу. В результате из-за сниженного диастолического давления страдает коронарный кровоток.
Техника расширения бульбовентрикулярного отверстия
Техника расширения бульбовентрикулярного отверстия описана Cheung и соавторами. Операцию выполняют в условиях искусственного кровообращения с применением глубокой гипотермии и кардиоплегии. Иногда бульбовентрикулярное отверстие можно расширить доступом через разрез аорты, но в грудном возрасте чаще всего приходится применять разрез инфундибулярной выпускной камеры. Очень важно во время расширения бульбовентрикулярного отверстия не повредить проводящие пути. Отверстие расширяют за счет иссечения перегородки в нижне-левом направлении. Разрез инфундибулярной части закрывают заплатой, которая также способствует расширению подаортального выводного тракта. Суживание легочного ствола выполняют во время согревания больного. Окончательное суживание и измерение давления в легочной артерии осуществляют после окончания искусственного кровообращения и стабилизации сердечной деятельности.
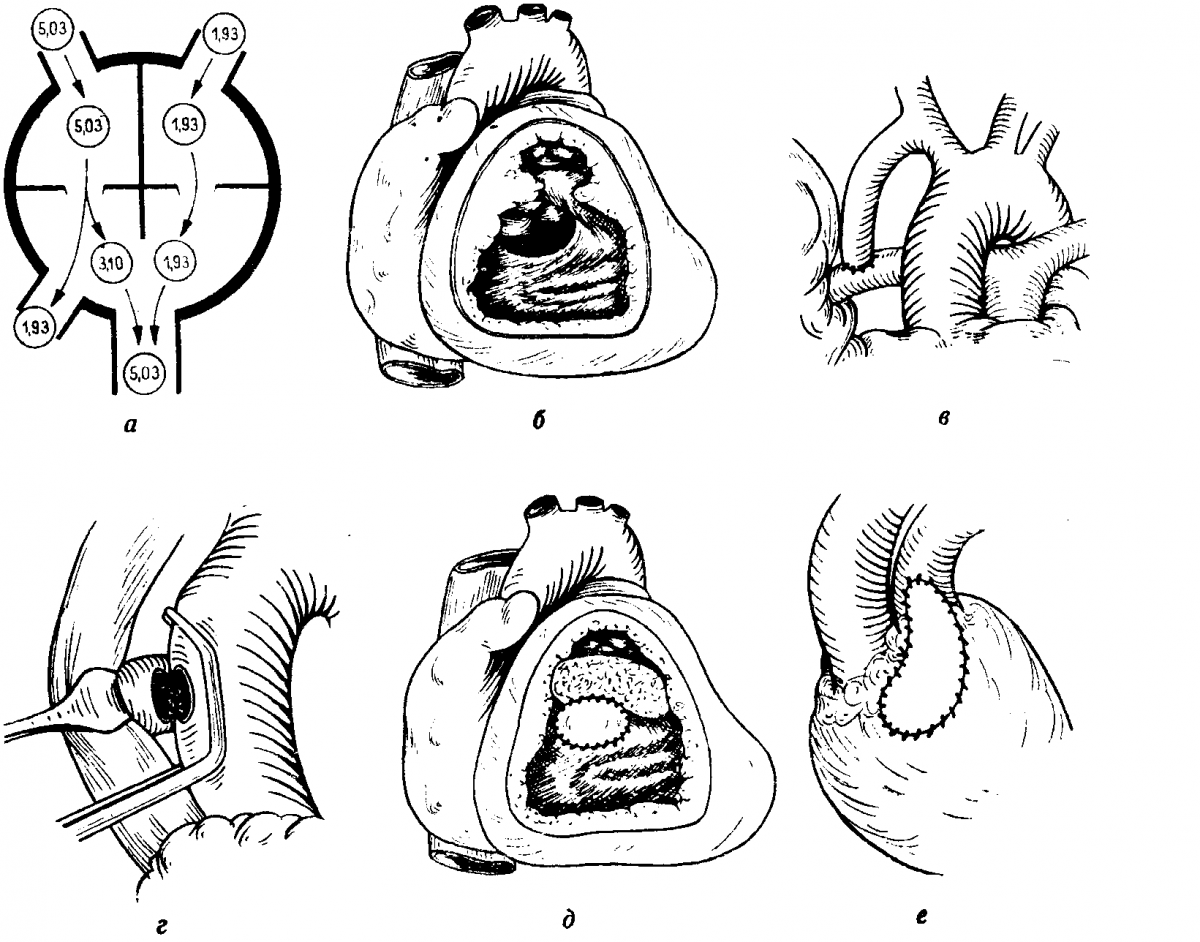
Особенности послеоперационного ведения
Ведение больных с функционально единственным желудочком сердца, перенесших паллиативное вмешательство, заключается в создании баланса между системным и легочным кровообращением. Если послеоперационное течение осложняется чрезмерным цианозом или неадекватным сердечным выбросом, требуется срочное проведение эхокардиографического или ангиографического исследования для выявления остаточных анатомических дефектов.
Хирургическая тактика в постнеонатальном периоде
Ведение больных с одножелудочковым сердцем в постнеонатальном периоде направлено на лечение застойной сердечной недостаточности и создание благоприятных условий для последующей коррекции гемодинамики по Fontan. При застойной сердечной недостаточности в дооперационном и послеоперационном периодах назначают дигоксин, диуретики и АПФ. Наиболее частыми проблемами в постнеонатальном периоде являются рестеноз дуги аорты, прогрессирование или развитие субаортальных сужений, ухудшение функции желудочка или АV-клапанов, а также повышение ЛСС. Устойчивость к медикаментозному лечению застойной сердечной недостаточности является одним из первых клинических сигналов развития сужения на уровне дуги аорты или субаортального стеноза. Несмотря на то, что с помощью ЭхоКГ большинство из этих сопутствующих пороков могут быть диагностированы, необходимо произвести катетеризацию полостей сердца на протяжении первых 6 мес. жизни ребенка. Это необходимо выполнить в целях измерения давления в легочной артерии и объемной перегрузки легких, вычисления ЛСС, выявления крупных коллатеральных артерий, которые являются причиной перегрузки легочного сосудистого русла. Во время зондирования полостей сердца необходимо попытаться перекрыть системно-легочные коллатеральные артерии с помощью катетерных технологий.
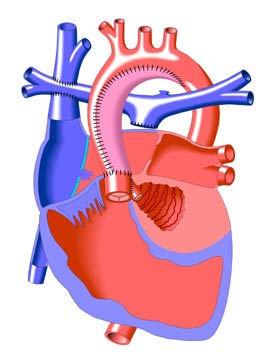
Хирургическая тактика постнеонатального периода предусматривает хирургические вмешательства, направленные на ограничение систолической и объемной нагрузки на единственный желудочек. Для устранения перегрузки желудочка давлением используют ранее описанные вмешательства. Объемную перегрузку желудочка устраняют путем закрытия системно-легочных шунтов и создания прямого сообщения между системными венами и легочными артериями. Это достигается путем создания двунаправленного кавопульмонального анастомоза или операции Fontan. Важно осознавать, что в результате гемодинамической коррекции по Fontan образуется физиологическое состояние, при котором вся энергия, потребляемая сердечно-сосудистой системой, обеспечивается единственным желудочком. Поэтому последовательное соединение системного и легочного кровообращения предпочтительнее параллельного.
Таким образом, главной задачей хирургической стратегии при аномалиях сердца с функционально единственным желудочком является создание анатомо-физиологических условий для выполнения полной коррекции по Fontan в оптимальном возрасте. Ведение больных должно быть направлено на решение двух задач:
-
смягчение клинического синдрома;
-
устранение анатомических и функциональных факторов, препятствующих выполнению операции Fontan.
Роль кавопульмонального анастомоза в хирургическом лечении одножелудочкового сердца
Анастомоз между ВПВ и правой легочной артерией является частичной коррекцией гемодинамики в обход правого желудочка. На данном этапе развития кардиохирургии очень редко используется классический вариант этого вмешательства. Преимущество отдается более совершенной модификации в виде ДКПА. Кавопульмональный анастомоз может применяться в целях этапного лечения перед операцией Fontan и как окончательный вариант лечения у больных с одножелудочковым сердцем, сочетающимся с аномальным впадением НПВ в виде непарного или полунепарного ее продолжения в ВПВ. Этот метод играет важную роль в хирургическом лечении пациентов с наличием факторов риска для выполнения полной гемодинамической коррекции. К таким факторам относятся:
-
наличие деформаций легочных артерий;
-
повышенное давление в легочной артерии;
-
повышенное ЛСС ;
-
наличие атрезии левого AV-клапана или общего AV-клапана;
-
наличие субаортального стеноза;
-
наличие недостаточности АV-клапанов;
-
сочетание ЕЖС с ТАДЛВ.
Особую роль играет ДКПА в лечении синдрома гипоплазии правого желудочка. При этой патологии его применяют как окончательный вариант хирургического лечения в сочетании с корригирующими операциями, выполняемыми на внутрисердечном уровне. В данной ситуации гипоплазированный правый желудочек вовлекается в легочное кровообращение, создавая пульсирующий кровоток. Для предотвращения перегрузки недоразвитого желудочка венозный возврат из верхней половины туловища отводят через ДКПА непосредственно в легочную артерию.
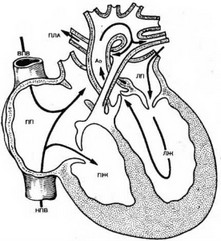
Двунаправленный кавопульмональный анастомоз имеет несколько преимуществ перед системно-легочными анастомозами. Он не увеличивает объемную нагрузку на желудочек, который, по определению, несет избыточную нагрузку по обеспечению системного и легочного кровотока, не способствует повышению ЛСС, несет в легочную артерию венозную кровь, а не артериально-венозную смесь, уменьшает объем крови, попадающей в правое предсердие. В отличие от классической операции, при ДКПА правая легочная артерия и легочный ствол не разобщены и кровь из ВПВ поступает в оба легких, сохраняется возможность попадания крови из бассейна НПВ в оба легких.
Степень повышения оксигенации артериальной крови после выполнения ДКПА зависит от возраста больного, дополнительных источников кровоснабжения легких и наличия непарного или полунепарного продолжения НПВ в ВПВ. В процессе роста ребенка количество крови, притекающей из системы ВПВ, меняется.
Так, у новорожденных оно составляет 49% объема циркулирующей крови, у детей в возрасте 2,5 года достигает 55%, а затем с развитием ребенка постепенно уменьшается и после 6 лет составляет 35%. Поэтому клинический эффект ДКПА значительно лучше у детей младшего возраста. У больных с наличием дополнительных источников кровоснабжения легких в виде системно-легочных коллатеральных артерий или сохраненного кровотока через стенозированное устье легочного ствола отмечается более высокий уровень насыщения артериальной крови кислородом. В случаях с непарным или полунепарным продолжением НПВ в ВПВ после выполнения ДКПА наблюдается значительное повышение артериальной сатурации кислородом. Это обусловлено тем, что в процессе оксигенации не участвует только кровь из коронарного синуса и печеночной вены.
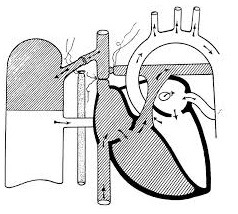
В некоторых клиниках ДКПА формируют всем больным с функционально единственным желудочком, рассматривая его как подготовительную стадию лечения. ДКПА выполняют детям в возрасте 6-12 мес, а операцию Fontan — в возрасте 2 года. Применение такой схемы позволяет значительно раньше исключить источники объемной перегрузки желудочка и, таким образом, добиться лучшего окончательного результата. Этапное формирование кровообращения по Fontan способствует меньшему изменению геометрии желудочка по сравнению с одностадийным выполнением полной гемодинамической коррекции. Выраженные изменения геометрии желудочка после операции Fontan способствуют снижению сердечного выброса в раннем послеоперационном периоде.
Forbes и соавторы установили разницу влияния ДКПА на изменение массы желудочка у пациентов, которым кавопульмональный анастомоз был сформирован в раннем детстве и в старшем возрасте. Если у маленьких детей после выполнения ДКПА наблюдалась явная регрессия массы желудочка, то у подростков эти изменения были малоубедительными.
Одним из самых дискуссионных вопросов является выбор альтернативных решений: оставлять ли выход из правого желудочка через стенозированный клапан легочной артерии или полностью закрыть его? Некоторые авторы отмечают, что у больных с оставленным выходом в легочный ствол течение послеоперационного периода было более тяжелое, чем у тех, которым выход закрывали. При сохранении антеградного кровотока чаще отмечали транссудацию в плевральные полости и развитие хилоторакса в позднем послеоперационном периоде. Другие констатировали, что больных с дополнительным источником кровенаполнения легких через легочный ствол удавалось быстрее отлучить от механической вентиляции легких и укоротить сроки лечения в отделении интенсивной терапии. Эти авторы считают, что сохранение пульсирующего кровотока в легочных артериях предотвращает развитие артериовенозных фистул в легких и системно-легочных коллатералей. Также одной из положительных сторон этого подхода они считают сохранение возможности роста легочных артерий.
У пациентов с сохраненным кровотоком через легочный ствол наблюдается более высокое насыщение артериальной крови кислородом, однако это достигается ценой объемной перегрузки желудочка. Поэтому объем легочного кровотока в каждом случае следует подбирать таким образом, чтобы предотвратить объемную перегрузку желудочка и повышение давления в ВПВ.
На основании исследований можно отметить, что результаты выполнения ДКПА лучше в группе больных без дополнительного источника кровоснабжения легких через легочный ствол. У таких больных легче протекал ранний послеоперационный период, и в большинстве случаев отмечалось хорошее клиническое состояние на протяжении 1 года — 6 лет.
Aeba и соавторы считают необходимым оставлять частичный кровоток через легочный ствол у пациентов с низким давлением в ВПВ и недостаточным насыщением артериальной крови кислородом. Miyaji и соавторы установили, что после формирования ДКПА значительно уменьшается количество факторов риска для выполнения операции Fontan. У пациентов с пульсирующим кровотоком необходимость полной гемодинамической коррекции возникает значительно реже.
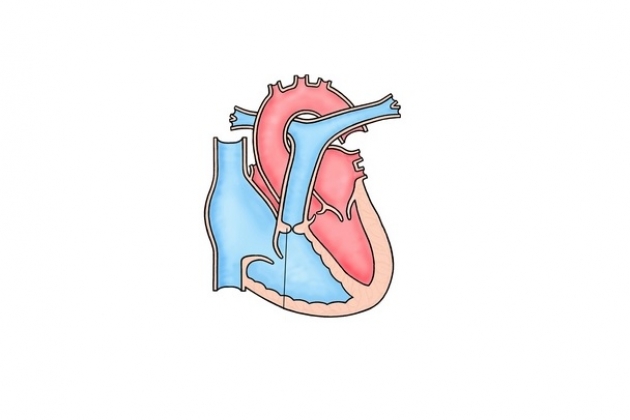
Эта операция заключается в анастомозировании ВПВ с дистальным концом правой легочной артерии по типу «конец в бок». Ее выполняют через боковую торакотомию справа. Контроль давления в ВПВ осуществляют через катетер, поставленный в одну из центральных вен. Боковую торакотомию выполняют по IV межреберному промежутку справа. Правую легочную артерию и ее ветви, а также ВПВ тщательно освобождают от окружающих тканей, стараясь не повредить диафрагмальный нерв, проходящий рядом с этими сосудами. Под ветви правой легочной артерии подводят лигатурные петли, которые затягивают во время формирования анастомоза. Сосудистым зажимом пережимают проксимальный конец правой легочной артерии в месте, где она отходит от ствола, и пересекают ее поперечным разрезом. Проксимальный конец правой легочной артерии ушивают непрерывным швом. На некотором расстоянии от места впадения в полую вену перевязывают непарную вену. Заднебоковую поверхность ВПВ отжимают сосудистым зажимом. Непарную вену вскрывают поперек, вблизи от впадения ее в полую вену. Конец непарной вены, который остается со стороны полой вены, вскрывают продольным разрезом с переходом на полую вену. Затем разрез удлиняют на ВПВ в нижнем направлении. Проленовой нитью 6/0 дистальный конец правой легочной артерии анастомозируют с боковой стенкой ВПВ. Для предотвращения сужения соустья переднюю губу лучше сшивать отдельными швами. После окончательного формирования анастомоза ВПВ перевязывают толстой лавсановой нитью в месте соединения ее с правым предсердием.
При выполнении классического кавопульмонального анастомоза важно знать, есть ли дополнительная левая верхняя полая вена. Если она имеется и отсутствует связь ЛВПВ с правой верхней полой веной посредством плечеголовной вены, выполнение классической модификации кавопульмонального анастомоза чревато возникновением осложнений со стороны головного мозга. Если же обе ВПВ соединены между собой крупной плечеголовной веной, можно выполнить анастомоз и перевязать ЛВПВ. Иногда перевязка ЛВПВ может привести к возникновению инфаркта миокарда. Это бывает в тех случаях, когда атрезировано устье коронарного синуса и кровь из вен сердца дренируется в ЛВПВ.
Техника выполнения ДКПА
Эта операция может быть выполнена с использованием искусственного кровообращения или без него. Большинство хирургов предпочитает выполнять ее через срединный доступ в условиях искусственного кровообращения. Мобилизуют легочную артерию и ее долевые ветви с той стороны, где предполагают наложить соустье. Верхнюю полую вену освобождают от перикарда до места впадения в нее левой плечеголовной вены. Канюлируют аорту, ВПВ или плечеголовную вену, НПВ. Анастомоз формируют сразу же после начала искусственного кровообращения, на сокращающемся сердце. При наличии ранее выполненного системно-легочного анастомоза его пережимают и отсекают от легочной артерии. Перевязывают также непарную вену. ВПВ рассекают на 4-5 мм выше кавоатриального соединения. Головной конец вены анастомозируют с продольным разрезом верхнего края правой легочной артерии, а сердечный — ушивают непрерывным швом или закрывают заплатой из аутоперикарда. При наличии системно-легочного анастомоза ВПВ соединяют с легочной артерией в месте отсеченного системно-легочного анастомоза. Обычно не канюлируют ВПВ через ее стенку, так как это ограничивает ее подвижность. Перфузию начинают с одним венозным катетером в правом предсердии. По латеральным сторонам ВПВ накладывается два шва-держалки, которые позволяют избежать перекручивания вены при анастомозировании с легочной артерией. После пересечения ВПВ в ее зияющий просвет вводится венозный катетер и обжимается вокруг него полая вена турникетом. Швы-держалки позволяют приблизить вену к разрезу правой легочной артерии. Катетер не мешает выполнению анастомоза. После наложения основной части линии шва удаляется катетер и оставшаяся часть разрезов закрывается отдельными узловыми швами для исключения эффекта кисета и обеспечения возможности роста соустья.
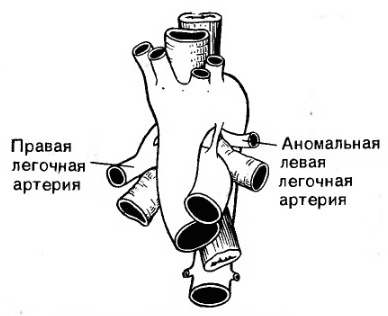
У больных с функционально единственным желудочком сердца, особенно сочетающимся с гетеротаксией и предсердным изомеризмом, часто имеют место аномалии системного и легочного венозного возврата. В этих случаях нередко бывают билатеральные ВПВ и обязательным условием является анастомозирование обеих вен с правой и левой ветвями легочной артерии во избежание перетока венозной крови из правой вены в левую. При наличии АЛА в неонатальном периоде необходимо наложить системно-легочный анастомоз. Если имеются СЛА и адекватный легочный кровоток, двусторонний кавопульмональный анастомоз может быть первым вмешательством, которое выполняют в условиях искусственного кровообращения.
В ситуациях, когда ДКПА необходимо сочетать с расширением ДМПП или другими внутрисердечными вмешательствами, операцию выполняют в условиях умеренной гипотермии и кардиоплегии. Первый этап выполняют при сокращающемся сердце, а внутрисердечный — в условиях кардиоплегии.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания








Комментарии