Неотложная реанимация. Виды реанимации. Показания. Последствия.
Реанимация – восстановление физиологического гомеостаза после повреждения. Реанимация при геморрагическом шоке состоит из восстановления нормального объема циркулирующей крови, нормального тонуса сосудов и нормальной тканевой перфузии. Реанимация начинается немедленно после повреждения запуском собственных компенсаторных механизмов пациента и продолжается через догоспитальную фазу лечения, фазу приемного отделения, операционную и отделение реанимации, который предотвращает реверсию ишемии даже при наличии адекватной макроперфузии. Ишемические клетки продуцируют лактат и свободные радикалы, которые аккумулируются в циркуляции при гипоперфузии. Эти компоненты являются причиной прямого повреждения клеток и формируют массу токсичной нагрузки, которая вымывается обратно центральную циркуляцию при реперфузии. Ишемические клетки также продуцируют и выбрасывают воспалительные факторы:
-
простациклин;
-
тромбоксан;
-
простагландины;
-
лейкотриены;
-
эндотелин;
-
комплемент;
-
интерлейкины;
-
фактор некроза опухолей и другие.

Этот инициированный воспалительный ответ становится патологическим процессом вне зависимости от своего происхождения. Пациент может умереть от полиорганной недостаточности после травматического кровотечения даже при остановке кровотечения и коррекции гиповолемии.
Специфические органные системы отвечают на травматический шок разными путями. Центральная нервная система является первичным триггером нейроэндокринного ответа на шок, восстанавливающего перфузию сердца, почек и головного мозга за счет ухудшения перфузии других тканей. Региональное потребление глюкозы в мозге во время шока меняется. Рефлексы и кортикальная электрическая активность подавлены во время гипотензии; данные изменения обратимы при умеренной гипоперфузии, но становятся необратимыми при пролонгированной ишемии. Невосстановление до исходного уровня неврологических функций является маркером отрицательного прогноза даже при восстановлении жизненно важных органов.
Почки и надпочечники первично реагируют на нейроэндокринные изменения, ассоциированные с шоком, продуцируя ренин, ангиотензин, альдостерон, кортизол, эритропоэтин и катехоламин. Почки поддерживают гломерулярную фильтрацию в условиях гипотензии путем избирательной вазоконстрикции и сосредоточения в медуллярном и глубоком кортикальном слоях. Продолжительная гипотензия приводит к снижению клеточной энергии и неспособности концентрировать мочу, сопровождаемой неоднородной клеточной гибелью, некрозом канальцевого эпителия и почечной недостаточностью.
Сердце сберегается от ишемии во время шока в силу достижения или сохранения нутритивного кровотока, функция сердца не изменяется до поздних стадий шока. Лактат, свободные радикалы и другие гуморальные факторы, выделяемые ишемизированными клетками, действуют как негативные инотропные агенты, что у пациентов с кровотечением может создавать сердечную дисфункцию в финале шока. Пациент с сердечным заболеванием или прямой травмой сердца имеет риск декомпенсации, так как фиксированный ударный объем создает неспособность организма увеличить кровоток в ответ на гиповолемию и анемию. Тахикардия является потенциально гибельной для соотношения доставки и потребления кислорода в сердце сама по себе. Шок у пожилых может быстро прогрессировать с непредсказуемым ответом на введение жидкости.

Легкие – это фильтр для продуктов ишемизированных тканей. Иммунные комплексы и клеточные факторы аккумулируются в легочных капиллярах и приводят к агрегации нейтрофилов и тромбоцитов, повышая капиллярную проницаемость, формируя деструкцию легочной архитектуры и приводя к респираторному дистресс-синдрому. Легкие являются органом, стоящим на страже перед развитием мультиорганной дисфункции у пациентов с травматическим шоком. Чистая кровопотеря при отсутствии гипоперфузии не вызывает легочной дисфункции. Это является доказательством того, что травматический шок – более чем просто гемодинамическое расстройство.
Кишка является одним из ранних органов, страдающим от гипоперфузии, и может быть первичным триггером МОД. Интенсивная вазоконстрикция происходит рано и быстро приводит к феномену не восстановления кровотока, даже при восстановлении макроциркуляции гибель интестинальных клеток приводит к повреждению функции барьера кишки, что вызывает транслокацию бактерий в печень и легкие, тем самым потенцируя РДС.
Печень имеет комплексную микроциркуляцию и может «переживать» реперфузионное повреждение во время восстановления при шоке. Клетки печени метаболически активны и способствуют воспалительному ответу и нарушению утилизации глюкозы крови. Недостаточность синтетической функции печени после шока, почти всегда ассоциируется с отрицательным исходом.
Скелетные мышцы не являются метаболически активными во время шока и толерантны к ишемии лучше, чем все остальные органы. Однако большая масса скелетных мышц делает их важным, в синтезе молочной кислоты и свободных радикалов из ишемизированных клеток. Устойчивая ишемия мышечных клеток приводит к увеличению внутриклеточного натрия и свободной воды, с усугублением задержки жидкости в сосудистом и интерстициальном секторах.
Ранняя реанимация
Назначение жидкости – краеугольный камень реанимационных мероприятий. Внутрисосудистый объем теряется за счет кровотечения, перемещения в клетки, экстравазации в интерстициальное пространство. Назначение жидкости внутривенно предсказуемо увеличивает сердечный выброс и артериальное давление у гиповолемичных пациентов. Курс обучения ATLS предлагает быструю инфузию до 2 л теплого изотонического раствора кристаллоидов у любого пациента с гипотензией с целью достижения нормального артериального давления.

Этот подход попал под сомнение несколько лет назад из-за растущего понимания того, что назначение жидкости во время продолжающегося кровотечения может быть неэффективно. Разведение массы эритроцитов снижает доставку кислорода, способствует гипотермии и коагулопатии. Повышение артериального давления приводит к усилению кровотечения в результате разрушения сгустков и реверсии компенсаторной вазоконстрикции. Результатом агрессивного назначения жидкости является транзиторное повышение артериального давления, сопровождаемое усилением кровотечения, повторным эпизодом гипотензии и потребностью в назначении еще большего объема жидкости. Этот порочный круг был описан во время первой мировой войны и остается характерным осложнением современной интенсивной терапии. Руководство ATLS характеризует подобных пациентов как «переходно реагирующих» с продолжающимся кровотечением. Реанимацию таких пациентов следует рассматривать в два этапа:
-
Ранний.
-
Поздний.
Ведение позднего этапа реанимации обусловлено конечной целью и состоит из введения достаточного количества жидкости для создания максимальной доставки кислорода. Поздняя реанимация является значительно более комплексной, так как риски осложнений ассоциируются с агрессивным возмещением жидкости, включая потенциальное усугубление кровотечения. Это требует взвешенного отношения к оценке вероятности риска гипоперфузии и ишемии.
Гипотензивная анестезия является стандартом у плановых больных при таких операциях, как:
-
тотальное протезирование суставов;
-
спондилодез;
-
радикальная шейная диссекция;
-
реконструктивная лицевая хирургия;
-
операции на тазе и животе.
Проецирование данной техники на первичную терапию кровотечений дискутабельно и находилось в центре внимания многочисленных лабораторных и клинических исследований. В 1965 г. Shaftan и соавт. опубликовали результаты изучения свертывания у собак, где было демонстрировано, что формирование мягкого сгустка лимитирует кровотечение после повреждения артерии. В данном исследовании сравнивалось количество потерянной крови при стандартизованном артериальном повреждении в различных условиях. Наименьшая потеря крови произошла у гипотензивных животных, на втором месте был объем кровопотери у контрольной группы и далее у животных в условиях вазоконстрикции. Наибольшее количество крови было потеряно у животных, которые подвергались энергичной реинфузии в период кровотечения.
Лабораторные данные показали преимущества ограничения внутрисосудистого объема жидкости и артериального давления у животных при продолжающемся кровотечении. В наиболее сложных моделях прямое измерение сердечного выброса и региональной перфузии показало отсутствие разницы между умеренной по объему или большой по объему реанимации в пересчете на сердечный выброс, артериальное давление или региональную перфузию сердца, почек и кишечника. Умеренная реанимация улучшает перфузию печени Burris и соавт. изучали стандартные растворы для реанимации и различные комбинации гипертонических растворов солей и декстранов и обнаружили, что рецидив кровотечения коррелировал с более высоким средним артериальным давлением и что выживание было лучшим в группах, реанимированных с давлением ниже нормального. Оптимальный уровень артериального давления для реанимации варьирует в зависимости от состава используемых жидкостей. Согласительная комиссия по реанимации при геморрагическом шоке 1994 г. отметила, что млекопитающие способны поддерживать среднее АД на уровне 40 мм рт. ст. на протяжении 2 ч без отрицательных последствий. Комиссия заключила, что спонтанный гемостаз и долгосрочное выживание улучшались путем снижения введения жидкостей для реанимации во время периода продолжающегося кровотечения при попытке сохранения перфузии выше порога ишемии.

На сегодняшний день опубликованы два проспективных исследования преднамеренной гипотензивной реанимации у пациентов с травмой. Первым было опубликовано исследованием Bickell и соавт.. Авторы рандомизировали пострадавших при проникающей травме груди на одну из двух групп: стандарт терапии или отсроченная реанимация. Это хорошо спланированное 37-месячное исследование в конечном итоге включило 598 пациентов. Среднее время транспортировки и помощи от момента повреждения до доставки в приемное отделение составило 30 мин и далее 50 мин до поступления в операционную. Группа с ограничением жидкости получила в течение этого времени в среднем около 800 мл жидкости. Группа с немедленной реанимацией получила в среднем 2500 мл кристаллоидов и 130 мл крови. Существенно отличаясь в период исследования, артериальное давление было сходным в обеих группах, и авторы посчитали это доказательством, что группа без реанимации достигала спонтанного гемостаза. Выживание на госпитальном этапе в группе с отсроченной реанимацией было достоверно выше, чем в группе с немедленной реанимацией. Данные на момент поступления в операционную и начала анестезии не были представлены, однако были доступны параметры на момент остановки кровотечения и на момент рецидива кровотечения.
Ретроспективный обзор поступлений в Медицинский центр Лос-Анджелеса, опубликованный в 1996 г., подтвердил вышеприведенные выводы. Пациентам, доставляемым в госпиталь частным транспортом, повезло значительно больше, чем тем, которые доставлялись парамедиками, даже при большей степени повреждения. Дальнейшим подтверждением была предоставленная ретроспективная оценка исходов в популяции пациентов с геморрагическим шоком, которым проводилась инфузия жидкостей через коммерческую «систему быстрой инфузии» во время первичной реанимации. Частота выживания в данной группе была сравнима с тем, что было предсказано институтским регистром травмы. Пациенты с методикой RIS при сравнении случай-контроль имели выживаемость только 56,8% против 71,2% для пациентов аналогичного возраста с аналогичными повреждениями.
Этот, ретроспективный обзор был продолжен в 2002 г. вторым проспективным исследованием отсроченной реанимации у пациентов с травмой. Пациенты с систолическим артериальным давлением менее 90 мм рт. ст. и клиническим доказательством потери крови были рандомизированы по уровню систолического давления 100 мм рт. ст. и 70 мм рт. ст. до окончания хирургического вмешательства по остановке кровотечения. В исследовании Bickell, гипотензия делала возможным спонтанное разрешение кровотечения и аутореанимацию; артериальное давление увеличивалось без введения жидкости по достижении окончательного гемостаза. Типичный пациент начинал с низкого исходного давления, с последующим восстановлением до целевого, повышая или снижая АД, как только кровотечение и назначение жидкости продолжалось; АД повышалось выше целевого уровня в момент окончательного гемостаза даже без дальнейшей инфузии. Общая выживаемость 93% в данном исследовании была большей, чем прогнозируемая по историческим данным, и существенно выше в сравнении с показанной в исследовании Bickell. Исключались пациенты, умершие на догоспитальном этапе или доставленные в приемное отделение в агональном состоянии. Это может характеризовать эффективность общего лечения, обсервационный эффект или влияние не включенных в исследование больных. За первые 24 ч клиренс лактата и дефицит оснований восстанавливались до нормального, в обеих группах требовались одинаковые количества жидкости и препаратов крови, следовательно, обе группы достигали эквивалентные точки эффективности реанимации. Авторы заключили, что назначение жидкостей пациентам с продолжающимся кровотечением должно титроваться анестезиологом по специфическим физиологическим конечным точкам, прокладывающим курс между Сциллой усиления кровотечения и Харибдой гипоперфузии.
Влияние эффекта препаратов для анестезии на ответ организма на кровотечение является важным отличием между допустимой гипотензией, происходящей при плановой хирургии, и при геморрагическом шоке. Гипотензивный пациент с травмой получает минимум анестетиков, в основном, для индукции в силу очевидного эффекта этих препаратов на артериальное давление. Гипотензивный пациент с травмой находится в состоянии глубокой вазоконстрикции, что отличает его от пациента с плановой интраоперационной гипотензией, который вазодилатирован под действием анестетиков. Следует отметить, что кровопотеря без шока не приводит к системным осложнениям типа РДС на экспериментальных моделях. Акцент должен быть поставлен на быстрой диагностике и остановке продолжающегося кровотечения. Анестезиолог должен попытаться восполнить внутрисосудистый объем и провести анестезию в равной мере путем перевода пациента из состояния вазоконстрикции в вазодилатацию при облегчении гемостаза в условиях допустимой гипотензии.

Уязвимые популяции больных
Клинические исследования допустимой гипотензии при проведении интенсивной терапии исключали применение данного метода в популяции, имеющей риск ишемических осложнений, включая пациентов с известной ишемической болезнью сердца, пожилых и пациентов с повреждениями головного или спинного мозга. Препятствия перед созданием условий гипотензии у пациентов с ЧМТ наиболее обоснованы из-за несоответствия исходов пациентов, переживших гипотензию, с группой без таковой. Пожилые пациенты с травмой демонстрируют худшие исходы от схожих повреждений в сравнении с молодыми пациентами, вероятно, из-за сниженного физиологического резерва. Клиническое ведение подобных пациентов фокусируется на профилактике ишемического стресса и быстрой коррекции гиповолемии. Однако при дальнейшем проведении исследования может оказаться, что допустимая гипотензия с целью быстрого контроля кровотечения одинаково эффективна у всех больных. В отношении данной проблемы клинических исследований не проводилось, но лабораторные эксперименты не обнаружили преимуществ допустимой гипотензии у животных с сочетанием ЧМТ и геморрагического шока. В силу отсутствия убедительных доказательств у человека следует избегать допустимой гипотензии у пациентов с ЧМТ или пожилых пациентов.
Инфузионные среды для реанимации
Изотонические кристаллоиды, плазма- лит 148 – жидкости, назначаемые для первичной реанимации у любых пациентов с травмой. У данных сред есть ряд преимуществ:
-
жидкости недорогие;
-
готовы к употреблению;
-
неаллергенны;
-
стерильны;
-
эффективны для восстановления жидкости во всех секторах организма.
Жидкости легко хранить и назначать, они хорошо смешиваются с внутривенными лекарственными препаратами, растворы могут быстро нагреваться до температуры тела. Недостатки кристаллоидов включают в себя отсутствие кислород-транспортной емкости, недостаток коагуляционного потенциала и лимитированный период нахождения в сосудистом русле. Недавние лабораторные исследования определяют кристаллоиды в качестве иммуносупрессантов и триггеров клеточного апоптоза. В отличие от некроза, апоптоз регулируется и вовлекает модуляцию генов и комплексные пути сигнальной трансдукции. Становится ясным, что апоптоз является важнейшим элементом реперфузионного повреждения. На модели контролируемого кровотечения у крыс, животные, получавшие РЛ, демонстрировали немедленное повышение апоптоза в печени и тонком кишечнике после реанимации. Ни цельная кровь, ни гипертонический раствор соли не увеличивали количество апоптотических клеток.
Гипертонические растворы солей с добавлением или без добавления полимеризованных декстранов широко изучались в реанимации при геморрагическом шоке. Теоретически ГР будет вытягивать жидкость в сосудистое пространство из интерстиция и, таким образом, корригировать относительную гиповолемию, вызванную шоком и ишемией. Назначение небольшого ГР будет обеспечивать большую вероятность восстановления внутрисосудистого объема в сравнении с эквивалентным объемом изотонического раствора. Это сделало ГР популярным для жидкостной реанимации в боевых условиях. ГРД лицензирован для догоспитального использования в ряде европейских стран и используется для реанимации в подразделениях военной медицины США. Многочисленные исследования лечения смертельного кровотечения у животных демонстрировали улучшение выживаемости после реанимации с ГРД в сравнении по отдельности или с физиологическим раствором, или с компонентами ГРД. Исследования эффективности ГРД у пострадавших были неубедительными, наиболее очевидные преимущества наблюдались в подгруппе пациентов с политравмой в сочетании с кровотечением и ЧМТ, где демонстрировалось улучшение неврологического статуса у тех пациентов, которым вводился ГРД в качестве реанимационной жидкости. Действительно, ГР часто используется как осмотический агент в терапии ЧМТ с повышенным внутричерепным давлением.
Коллоиды, включая растворы крахмала и альбумина, пропагандировались для быстрого возмещения плазматического объема. Наподобие кристаллоидов, коллоиды готовы к использованию, легко сохраняемы и назначаемы и относительно недороги. Так же как и гипертонические растворы, коллоиды будут повышать внутрисосудистый объем путем перемещения свободной воды в сосудистое пространство. Когда сосудистый доступ ограничен, коллоидная реанимация будет восстанавливать внутрисосудистый объем быстрее в сравнении с инфузией кристаллоидами с меньшим объемом вводимых растворов. Коллоиды не транспортируют кислород и не способствуют формированию сгустка, их эффекты дилюции будут сравнимы с аналогичными у кристаллоидов. Последние исследования продемонстрировали отсутствие достоверного отличия коллоидов от кристаллоидов в различных моделях реанимации.
Многие опасности агрессивного назначения внутрисосудистых жидкостей, приведенных выше, связаны с дилюцией объема циркулирующей крови. Выявление данного факта и улучшение безопасности донорской крови привело к увеличению частоты использования препаратов крови в ранней терапии геморрагического шока. Риск системной ишемии снижается путем достижения адекватного гематокрита, вероятность дилюционной коагулопатии можно избежать путем раннего назначения плазмы. Состав жидкостей для реанимации важен так же, как и частота и время назначения инфузии. Четырехлетний ретроспективный обзор когорты пациентов с травмой в критическом состоянии, которые подвергались неотложному хирургическому вмешательству, в отношении краткосрочных исходов базировался на количестве единиц перелитой крови, когда пациент перенес массивную трансфузию крови до и во время операции. Количество единиц крови не различалось между выжившими и умершими. Одиннадцать показателей достоверно отличались: пережатие аорты для контроля артериального давления, использование инотропных препаратов, время артериального давления выше 90 мм рт. ст., длительность нахождения в операционной, температура менее 34°С, темп диуреза, рН менее 7, соотношение рО2/БЮ2 менее 150, РаСО2 более 50 мм рт. ст., калий более 6 ммоль/л, кальций менее 2 ммоль/л. Наличие трех первых параметров при использовании трансфузии более 30 единиц эритроцитов было необратимо фатальным. Общая кровопотеря и количество перелитой крови были менее критичными, чем тяжесть и длительность шока. Это важно в отношении концепции хирургии «damage control», которая уделяет особое внимание быстрой остановке продолжающегося кровотечения.
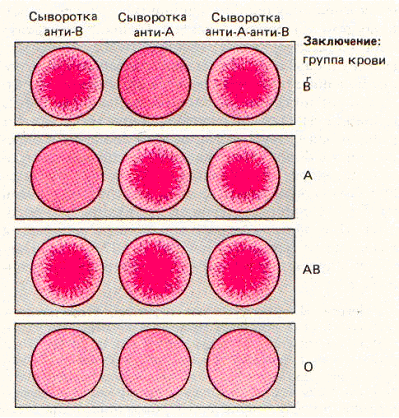
Эритроциты являются основой для лечения геморрагического шока. При среднем уровне гематокрита от 50 до 60% доза эритроцитов будет восстанавливать кислородную емкость крови и увеличивать внутрисосудистый объем так же, как и любой коллоидный раствор. Эритроциты групп крови А, В или АВ несут основные антигены несовместимости, которые могут инициировать летальную трансфузионную реакцию, если переливание будет проведено пациенту с несовместимой группой крови. Из-за того, что эритроциты также несут массу минорных антигенов, которые могут стать причиной реакций у чувствительных пациентов, желателен индивидуальный подбор при наличии лимита времени. Совместимая по типу кровь требует меньше времени для доставки из банка крови и может быть подходящей альтернативой в ряде ситуаций. Группа 0 крови - «универсальный донор» - может быть назначена пациентам с любой группой с незначительным риском тяжелых реакций. Это предпочтительный подход у пациентов, которые поступают в приемное отделение с геморрагическим шоком. Если кровь группы 0 назначается резус-отрицательной женщине, которая выжила, показано профилактическое введение антирезус нулевых антител.
Риски введения эритроцитов включают трансфузионные реакции, передачу инфекции и гипотермию. Например, эритроциты хранятся при температуре 4°С и быстро снизят температуру пациента, если не использовать согревающие устройства или не смешивать с теплыми изотоническими кристаллоидами во время введения.
Плазма требует определения групп крови без индивидуальной совместимости, задержка в доставке плазмы связана с потребностью в разморозке перед ее назначением. Госпитали, активно принимающие пациентов, обычно готовят запас размороженной плазмы, который, в отличие от свежезамороженной плазмы, в случае необходимости может быстро использоваться; в маленьких госпиталях важным является запросить плазму как можно раньше, если будет вероятность потребности в ней. Активно работающие центры экспериментируют с хранением от 2 до 4 единиц предварительно размороженной плазмы типа АВ, доступной постоянно в центре лечения травмы. Дозы сохраняют готовыми в таком состоянии в течение двух дней; при неиспользовании их в экстренных обстоятельствах плазма возвращается в банк крови. Влияние подобного подхода на улучшение исходов до сих пор не было изучено.
Трансфузия тромбоцитов обычно показана пациентам с клинической коагулопатией и документированно подтвержденным низким уровнем тромбоцитов в крови. Когда пациент находится в шоке и потеря крови становится значительной, тромбоциты должны быть введены эмпирически в определенной пропорции с эритроцитами и плазмой. Перелитые тромбоциты имеют очень короткий период полужизни и назначаются пациентам с активным коагулопатическим кровотечением. Тромбоциты не должны вводиться через фильтры, устройства для согревания или системы для быстрой инфузии, из-за того, что они будут связываться с внутренними поверхностями этих устройств, что снижает количество тромбоцитов, достигающих циркуляции.
Быстрая трансфузия донорских сред несет риск «цитратной интоксикации» реципиента. Цитрат трансфузионных сред связывает свободный кальций и, таким образом, ингибирует каскад свертывания. Последовательное назначение множества единиц донорской крови приводит к соответствующей большой дозе цитрата, который может подавлять возможность организма мобилизовать свободный кальций и обладает выраженным отрицательным инотропным эффектом на сердце. Нераспознанная гипокальциемия является причиной гипотензии у пациентов после массивной трансфузии, сохраняющейся вне зависимости от адекватного объема реанимации. Уровень ионизированного кальция должен измеряться регулярно, и по потребности должен назначаться кальций для достижения нормального значения сывороточного уровня кальция.
Оснащение для реанимации
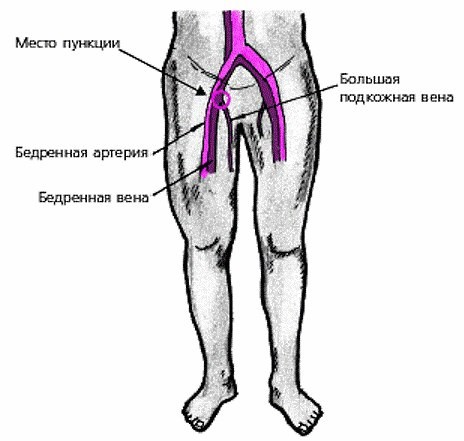
Любой вид сосудистой жидкостной реанимации невозможен в отсутствии венозного доступа. Рекомендуется немедленная установка как минимум двух катетеров большого калибра во время первичной оценки любого пациента с травмой. Практикующие врачи не должны сомневаться в отношении установки центрального катетера большого калибра любому пациенту, если попытки катетеризации периферических вен были безуспешны. Потенциальные места для установки катетера включают внутреннюю яремную, подключичную и бедренную вены, каждый из доступов к которым имеет свои преимущества и потенциальные недостатки. Катетеризация внутренней яремной вены, знакомая большинству анестезиологов, будет требовать поворота шейного воротника и манипуляций с шеей пациента и не рекомендуется в острых ситуациях, пока не исчерпаны возможности катетеризации центральных вен из других точек. Бедренная вена легко и быстро доступна и является подходящим выбором у пациентов без видимой травмы таза или бедра, требующих немедленного назначения лекарств или жидкости. Требуется осторожность у пациентов с проникающей травмой живота, так как вводимые через бедренную вену жидкости могут способствовать кровотечению из поврежденной нижней полой или подвздошной вены; по возможности у подобных пациентов венозный доступ должен быть выше диафрагмы. Катетеризация бедренной вены несет высокий риск формирования тромбозов глубоких вен, что лимитирует использование этого доступа только острыми состояниями. Катетеры из бедренных вен должны быть удалены как можно раньше после стабилизации состояния больного. Подключичная вена – наиболее частый доступ для первичного и дальнейшего использования у пострадавших, так как подключичная область легко визуализируется и непосредственно повреждается редко. Данный подход несет высочайший риск развития пневмоторакса, несмотря на то, что многие пациенты имеют показания для дренирования плевральных полостей; если возможно, для установки подключичного катетера следует предпочесть сторону предполагаемого повреждения плевральной полости. Установка артериальной линии облегчает воспроизведения частых лабораторных анализов и предоставляет возможность точного мониторинга артериального давления; артериальная линия должна быть установлена как можно раньше, но не должна затруднять иные диагностические и терапевтические процедуры.
Анестезиолог должен обеспечить температурный баланс у любого пациента с травмой. Несмотря на то, что допустимая гипотермия была предложена в качестве методики ведения геморрагического шока и ЧМТ, имеется недостаточно доказательств для поддержки подобного подхода. Гипотермия будет потенциировать дилюционную коагулопатию и системный ацидоз. Дрожь и вазоконстрикция в ответ на холод будут требовать дополнительных метаболических усилий с развитием ишемии миокарда. Также гипотермия серьезно увеличивает последующий риск сепсиса. Так как многие пациенты с травмой поступают в приемное отделение охлажденными, требуется ранее активное согревание. Все инфузируемые жидкости должны быть предварительно согреты или введены через согревающие устройства. Пациент должен быть обернут согревающими одеялами, и окружающая среда должна быть теплой, достаточной для комфорта пациента. Если гипотермия уже развивается, показано использование форсированного согревания пациента теплым воздухом для восстановления нормотермии. Хотя все эти мероприятия являются рутинными и очевидными в операционной, анестезиолог может сослужить полезную службу, убедившись, что все это доступно и выполнимо также в приемном отделении, сканерной компьютерной томографии и ангиографическом кабинете.
Коммерческие устройства для быстрой инфузии являются серьезным достижением в лечении травмы, особенно при наличии геморрагического шока. Эти аппараты обладают рядом преимуществ, когда предполагается необходимость введения больших объемов жидкости для реанимации. Ранние публикации об этих устройствах указывали на более высокую температуру пациентов и регресс ацидоза при первичном хирургическом вмешательстве. Альтернативным мнением было то, что быстрые инфузии способны приводить к перегрузке жидкостью, неадекватному подъему артериального давления и повторному кровотечению. Применение ранее описанных принципов может профилактировать подобные осложнения; исходный темп инфузии должен быть невысоким; с небольшими болюсами жидкости, подаваемыми в ответ на снижение артериального давления от 80 до 90 мм рт. ст. На практике болюсы жидкости вводятся, перемежаясь с анестетиками, с целью достижения нормальной глубины анестезии без повышения систолического артериального давления.

Поздняя реанимация
Назначение жидкости – интегральный и обязательный компонент. Адекватность реанимации должна быть оценена не по наличию нормальных жизненных показателей, а по нормализации органной и тканевой перфузии. Роль анестезиолога-интенсивиста состоит в распознавании продолжающегося шока после кровотечения, интенсивной терапии пациента соответствующей инфузионной средой, соответствующим количеством и в соответствующее время.
Поздняя реанимация начинается после окончательного хирургического или ангиографического гемостаза. Цель практикующего врача в это время – восстановление нормальной органной перфузии всех органов во время поддержания витальных функций. Гипоперфузия, вызываемая геморрагическим шоком, приводит к предсказуемому каскаду биохимических явлений, которые будут причиной физиологических расстройств, персистирующих длительно после восстановления адекватного кровообращения. Степень гипоперфузии – тяжесть и длительность шока – сильно коррелируют с развитием мультиорганной дисфункции. К сожалению, традиционные показатели являются нечувствительными по отношению к адекватности реанимации. Скрытый синдром гипоперфузии характерен для пациентов с травмой после операции, особенно для молодых. Этот синдром характеризуется нормальным артериальным давлением, достигаемым системной вазоконстрикцией; сниженным внутрисосудистым объемом и ишемией органов. Риск МОД будет высоким у больных с некорригированной гипоперфузией.
Поиск оптимальной конечной точки реанимации привел к различным гемодинамическим, кислотно-основным и региональным перфузионным мишеням. Несмотря на то, что кровоток в тканях является детерминантой тканевой перфузии, важным является и уровень давления. Индекс ударной работы левого желудочка варьирует в зависимости от потока и давления. К тому же мощность выброса левого желудочка использовалась для количественного определения производительности левого желудочка. Эти индексы сравнивались с показателями потока и показателями транспорта кислорода в качестве маркеров перфузии и исхода у критических пациентов с травмой. Пациенты мониторировались с использованием волюметрического катетера в легочной артерии во время
первых 48 ч реанимации. Были исследованы клиренс лактат за 24 ч и выживание. Более высокая ударная работа и работа выброса левого желудочка у выживших была связана с лучшим соотношение функции желудочков и артерий и, следовательно, с более эффективной сердечной функцией.
Инвазивный контроль в настоящее время заменяется на неинвазивные технологии, что позволяет определять восстановление адекватного метаболизма, дыхания и транспорта кислорода в периферическом тканевом русле. Одной из таких технологий является мониторинг тканевой оксигенации. Кровоток в скелетных мышцах снижается раньше в состоянии шока и восстанавливается позднее во время реанимации, что делает парциальное давление кислорода в мышцах чувствительным индикатором гипоперфузии. Ранняя «целенаправленная» терапия септического шока с акцентом на измерение смешанной венозной сатурации оказывает влияние на лечение пострадавших. Многие отделения реанимации сейчас используют продленное измерение венозной оксигенации для контроля эффективности терапии. Вариабельность ударного объема, изменение артериального давления, вызываемое респираторным циклом, предлагается в качестве иной менее инвазивной методики измерения волемического статуса. Увеличенная вариабельность артериального давления во время вентиляции с положительным давлением является надежным предиктором сниженного объема циркулирующей крови.
Тканевая гиперкапния предлагается в качестве универсального индикатора критически сниженной перфузии. Измерение желудочного рСО2 методом желудочной тонометрии использовалось у пациентов с травмой в качестве индикатора восстановления спланхнического кровотока, а рН в дистальных отделах кишечника была надежным индикатором. Наиболее проксимальная область желудочно-кишечного тракта – подъязычная слизистая – является наиболее удачным местом для измерения рСО2. Когда сублингвальное рСО2 превышает порог 70 мм рт. ст., положительная предсказательность тяжести циркуляторного шока составляет 100%. Неадекватная тканевая перфузия, определяемая этими специфическими методами или традиционными системными маркерами – сывороточным лактатом, дефицитом оснований и снижением рН – должна быть корригирована по достижении окончательного гемостаза. Время, в течение которого лактат возвращается к норме после шока, достоверно коррелирует с исходом; отсутствие нормализации в пределах суток ассоциируется с большим риском МОД и вероятной смертью.
Будущее развитие реанимации
Так как интенсивная терапия геморрагического шока имеет целью стабилизацию гемостаза, усовершенствования возможностей диагностики и лечения кровотечения могут улучшить исход после травмы. Прошедшее десятилетие демонстрировало развитие и широкое распространение фокусной ультразвуковой оценки при травме и компьютерной томографии с высоким разрешением для улучшения диагностики кровотечения, операций по принципам «damage control» и ангиографической эмболизации. Различные классы протромботических агентов стали все более популярными адъювантами для использования у пациентов с кровотечением:
-
топические прокоагулянты;
-
системные прокоагулянты.
Топические препараты используются для открытых раневых поверхностей для индукции немедленного формирования сгустка. Средства длительного применения являются препаратами тромбина и фибрина. Эти «фибриновые» клеи не будут работать в присутствии свежего кровотечения, так как они быстро смываются с поверхности, однако их достоинством является эффективность при наличии медленного кровотечения с поверхностей и органов, которые трудны для ушивания или каутеризации. Фибриновый клей состоит из рекомбинантного или высоко очищенного тромбина, не несет риска передачи вирусного заболевания, хотя имелись данные о формировании антител к бычьему тромбину, назначаемому локально. Системное воздействие у таких агентов также ограничено, что означает отсутствие отдаленного воздействия на свертывание за пределами места применения. Были разработаны системы с использованием тромбина и фибриногена, размещенных на коллагеновой основе и предназначенных для быстрой остановки кровотечения при повреждениях большой площади отдельных висцеральных органов или мышечно-скелетной системы, подобные системы использовались военными медиками в Ираке и Афганистане. Также в распоряжении военных медиков есть ряд новейших топических гемостатиков, состоящих из маленьких гидрофильных частиц, которые быстро абсорбируют с поврежденной ткани, сильно концентрируя факторы свертывания и тромбоциты и увеличивая темп формирования сгустка. На данный момент ни один из этих компонентов не разрешен для внутреннего применения, однако это является вероятным перспективным направлением.
Рекомбинантный активированный человеческий фактор свертывания VII лицензирован для лечения гемофилий с продолжающимся или ожидаемым кровотечением и известными антителами к седьмому фактору. Наблюдение за быстрым гемостазом у этой популяции привело к парадоксальному использованию rFVIIa при других врожденных и приобретенных коагулопатиях, включая дилюционную коагулопатию при травматическом кровотечении. Фактор VIIa в фармакологических дозах работает, активируя формирование тромбина на поверхности тромбоцитов, которые в свою очередь активируются тканевым фактором, что ведет к быстрому формированию сгустка. Так как требуется тканевый фактор, свертывание лимитировано местом повреждения сосуда, а неожиданное свертывание в неповрежденных органах или сосудах, осознаваемое как известный риск, встречается не так часто. Проспективные исследования фактора rFVIIa демонстрировали снижение потери крови у пациентов, подвергшихся плановой открытой хирургии простаты, и быстрой реверсии коагулопатии у пациентов, принимающих варфарин. Ретроспективные отчеты отводили роль rFVIIa в лечении острого кровотечения вследствие травмы, вторичного желудочно-кишечного кровотечения при циррозе, кровотечения после сердечно-сосудистой хирургии и пересадки печени, внутричерепного кровотечения как у новорожденных, так и у пожилых. Одно небольшое плацебо контролируемое исследование rFVIIa у пациентов с травмой и кровотечением демонстрировало снижение кровопотери, снижение потребности в трансфузии и улучшение исхода. На данный момент проводится большое международное исследование.
Дальнейшее развитие реанимации включает более специфические лечебные стратегии последствий шока и реперфузии. Геморрагический шок, сопровождаемый реанимацией, может рассматриваться как ишемическое и реперфузионное повреждение всего организма. Профилактика органной ишемии или повреждения в будущем станет реальной путем назначения агентов, регулирующих клеточную функцию и гуморальные сигналы. Направления включают в себя коррекцию механизмов, связанных с шоком, таких как:
-
комплемент и активация гранулоцитов;
-
эндотелиальная активация;
-
лейкостаз;
-
формирование отека с поражением органов.
Улучшение исхода возможно путем использования переносчиков кислорода, антиоксидантов, поглотителей оксида азота и антиэндотоксиновых соединений. Еще более впечатляющим является возможность учета персонифицированного индивидуального генома пациента с контролируемыми манипуляциями с широким кругом про- и противовоспалительных агентов, используемых для достижений оптимальной сывороточных концентраций во время восстановления после повреждения. Первой ступенью данного подхода является понимание того, что экспрессия генов может предсказывать исход после повреждения.
- Аллергия
- Ангиология
- Болезни глаз
- Венерология
- Гастроэнтерология
- Гинекология
- Дерматология
- Здоровое питание
- Инфекционные болезни
- Кардиология
- Косметология
- Лекарства
- Лекарственные растения
- ЛОР-заболевания
- Мужское здоровье
- Неврология
- Неотложная помощь
- Новости
- Онкология
- Ортопедия
- Паразитология
- Педиатрия
- Пульмонология
- Расшифровка анализов
- Симптомы
- Системные заболевания
- Стоматология
- Травматология
- Урология
- Хирургия
- Эндокринология
- Нужно знать
- Еда
- Профессиональные заболевания






Комментарии